解毒护肝方对APAP肝损伤大鼠HSP70蛋白表达的影响
王 茜,张一昕,郭秋红,郝 蕾,韩 雪,石 铖,刘 宇
(河北中医学院 药学院,河北 石家庄 050200)
热休克蛋白(HSPs)是在生物进化过程中高度保守的多肽蛋白,而HSP70则是最保守、最重要的一族,在应激反应中最敏感[1]。对乙酰氨基酚(APAP)是目前国际上常用的肝炎、药物性肝损伤模型用药之一,其可降低肝细胞的抗氧化能力,从而使肝细胞产生氧化应激性损伤[2]。研究显示,小鼠在注射对乙酰氨基酚后24 h,肝脏转氨酶活性达到峰值,HSP70的表达量也达到高峰,说明HSP70的表达变化可作为评价肝损伤或修复过程中的重要指标[3]。解毒护肝方为课题组治疗肝损伤的临床效用方,本实验主要研究其基于HSP70的保肝作用机制。
1 材料及试剂
1.1 动物
Wistar大鼠,清洁级,雌雄各半,体重180~220 g,共70只,由北京维通利华生物技术有限公司提供,实验动物合格证号:11400700181914,生产许可证号:SCXK(京)2012-0001。实验动物饲养于恒温恒湿环境中[温度:(23±2) ℃,相对湿度:60% ~ 70%],12 h明/暗交替,动物自由进食水[SYXK(冀)2016-0047]。
1.2 药物
解毒护肝方由柴胡、醋香附、炒白芍、五味子、黄芪、白术、茵陈、黄芩、丹参、楮实子、生甘草组成。方中所用药物均为免煎颗粒,由四川新绿色药业科技发展有限公司提供。水飞蓟宾胶囊(每粒含水飞蓟宾35 mg,批号:750709172),由天津天士力圣特制药有限公司生产;对乙酰氨基酚片(每片含对乙酰氨基酚0.5 g,批号:016171002)由石药集团欧意药业有限公司提供。
1.3 试剂
天门冬氨酸氨基转移酶测定试剂盒(AST,批号:AUZ3645),丙氨酸氨基转移酶测定试剂盒(ALT,批号:AUZ3689)由贝克曼库尔特实验系统有限公司提供;总胆红素试剂盒(TBIL,批号:A005),直接胆红素试剂盒(DBIL,批号:A006)由长春汇力生物技术有限公司;苹果酸脱氢酶试剂盒(MDH,SEH673Ra,Cloud-Clone Corp)、谷氨酸脱氢酶试剂盒(GLDH,SEA293Ra,Cloud-Clone Corp)、精氨酸酶试剂盒(ARG,SEB120Ra,Cloud-Clone Corp),HSP70抗体(rabbit,17T01602)购自abcam公司,二抗(rabbit,K166-918D)以及DAB(K172410E)均购自北京中杉金桥生物技术有限公司。
1.4 主要仪器
Humalyzer2000半自动生化仪(德国豪迈);DP73数码显微镜(Olympus);HMIAS-2000显微图像分析系统(武汉同济医科大学);酶标仪(BIO-TEK,ELx800);低温离心机(Sigma,德国);高速离心机(上海医用分析仪器厂)等。
2 方法
2.1 分组给药
将大鼠按体重随机分为正常组,模型组,水飞蓟宾阳性对照组,解毒护肝方高、中、低剂量组,共六组,其中正常组10只,其余每组各12只,雌雄各半。各组大鼠的给药剂量按照人与大鼠体表系数法进行换算,解毒护肝方低剂量组为成人等效剂量,中剂量组为等效剂量的2倍,高剂量组为等效剂量的4倍,每天上午8∶00模型组和各给药组给予对乙酰氨基酚1 000 mg·kg-1(用40 ℃生理盐水配制)1次,正常组给予生理盐水灌胃;每天下午2∶00正常组和模型组给予生理盐水灌胃,各给药组给予相应药液灌胃,给药体积均为1 mL/100 g,连续灌胃30天。每7天称重,自由进食水。
2.2 样本采集
实验结束时,3.5%水合氯醛(1 mL/100 g)腹腔注射麻醉大鼠,腹主动脉取血,全血分别置于清洁试管中,分别以4 000 r/min,离心10 min,分离血清,分装后置于-80 ℃冰箱保存,待检相关肝功能指标。取血后迅速取固定部位肝组织2份,一份置于4%多聚甲醛液中固定,待观察肝组织HSP70蛋白表达情况。
2.3 指标检测
2.3.1 一般情况观察 给药后观察大鼠精神状态、行为活动、饮食情况、二便情况、皮肤毛色。
2.3.2 血清指标检测 由于实验过程有动物死亡,每组选取8个样本,利用半自动生化分析仪按照试剂盒说明书检测血清AST、ALT、DBIL、TBIL的含量;利用酶标仪根据试剂盒说明书检测血清MDH、GLDH、ARG的含量。
2.3.3 肝组织HSP70蛋白表达检测 用免疫组化法进行观察,每组取6例,每例测5个视野。由计算机算出所测阳性反应物相对含量的灰度值及面积,由积分光密度值(IOD)和平均光密度值(MOD)来表示。
2.4 数据统计
实验数据采用SPSS13.5软件进行处理,计量资料采用方差分析,方差齐选用LSD,方差不齐选用Dunnett T3。P<0.05表示差异有统计学意义。
3 结果
3.1 解毒护肝方对肝损伤大鼠一般情况的影响
正常组大鼠毛发滑顺,有光泽,精神状态良好,行动灵活,二便正常;对乙酰氨基酚大鼠体重减轻,毛发无光泽,精神状态欠佳,喜卧。解毒护肝方和水飞蓟宾对照组大鼠能不同程度地改善大鼠的毛发光泽度、精神状态、体重情况以及行动灵活性情况。
3.2 解毒护肝方对药物性肝损伤大鼠肝功能指标的影响
给予大鼠对乙酰氨基酚灌胃30天后,ALT、AST、DBIL水平显著升高(P<0.01);水飞蓟宾组和中、低剂量组能显著降低肝损伤大鼠的ALT、AST活性(P<0.01,P<0.05),低剂量组能显著降低肝损伤大鼠的DBIL含量(P<0.05);解毒护肝方各剂量组之间中剂量组对ALT、AST活性的影响较高剂量组明显(P<0.05)。但各剂量组之间对总胆红素(TBIL)含量的影响差异无统计学意义(P>0.05)。见表1。
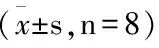
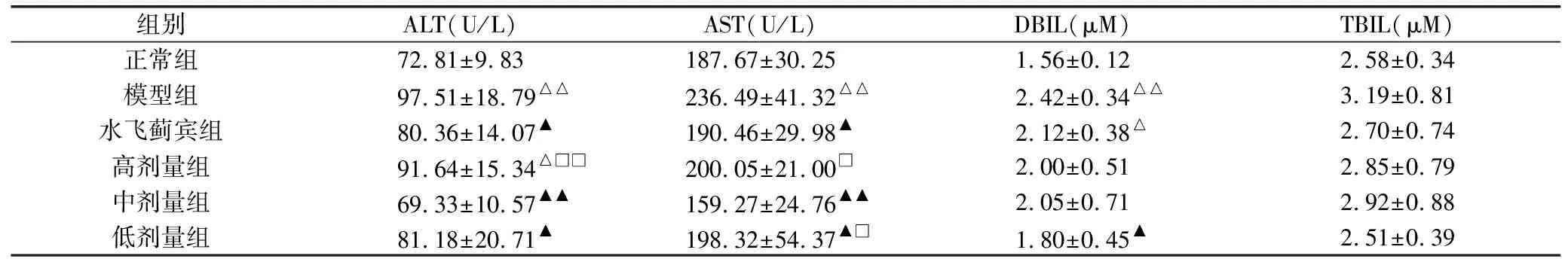
组别ALT(U/L)AST(U/L)DBIL(μM)TBIL(μM)正常组72.81±9.83187.67±30.251.56±0.122.58±0.34模型组97.51±18.79△△236.49±41.32△△2.42±0.34△△3.19±0.81水飞蓟宾组80.36±14.07▲190.46±29.98▲2.12±0.38△2.70±0.74高剂量组91.64±15.34△□□200.05±21.00□2.00±0.512.85±0.79中剂量组69.33±10.57▲▲159.27±24.76▲▲2.05±0.712.92±0.88低剂量组81.18±20.71▲198.32±54.37▲□1.80±0.45▲2.51±0.39
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与中剂量组比较,□P<0.05,□□P<0.01。
3.3 解毒护肝方对药物性肝损伤大鼠血清生物标志物的影响
大鼠给予对乙酰氨基酚药液30天后,血清PON1、ARG、GLDH、MDH、PNP的含量均显著升高(P<0.05,P<0.01),高剂量组能显著降低肝损伤大鼠血清PON1、MDH含量(P<0.05),而对血清ARG、GLDH含量有降低趋势,差异无统计学意义(P>0.05)。中剂量组均能降低肝损伤大鼠血清PON1、ARG、GLDH、MDH、PNP含量,其中对于肝损伤大鼠血清ARG、MDH的含量降低最为明显,有统计学差异(P<0.05)。低剂量组仅对血清PON1、MDH、PNP有降低趋势(P>0.05),而对其他指标无影响。见表2。
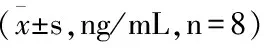
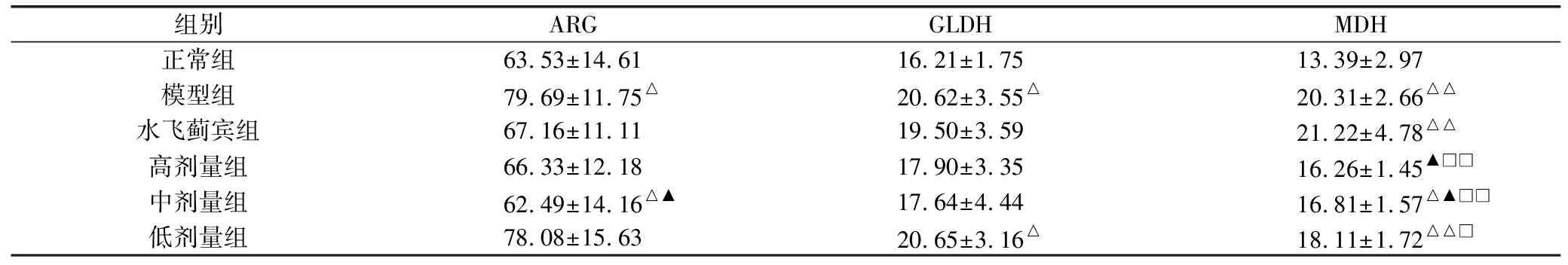
组别ARGGLDHMDH正常组63.53±14.6116.21±1.7513.39±2.97模型组79.69±11.75△20.62±3.55△20.31±2.66△△水飞蓟宾组67.16±11.1119.50±3.5921.22±4.78△△高剂量组66.33±12.1817.90±3.3516.26±1.45▲□□中剂量组62.49±14.16△▲17.64±4.4416.81±1.57△▲□□低剂量组78.08±15.6320.65±3.16△18.11±1.72△△□
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与水飞蓟宾组比较,□P<0.05,□□P<0.01。
3.4 解毒护肝方对药物性肝损伤大鼠肝脏HSP70蛋白表达的影响
大鼠给予对乙酰氨基酚药液30天后,肝组织HSP70蛋白表达的IOD和MOD值显著升高(P<0.05,P<0.01);各给药组均能显著降低肝损伤大鼠的IOD和MOD值(P<0.01);中、低剂量组HSP70蛋白表达较水飞蓟宾对照组明显降低(P<0.05,P<0.01);各剂量组之间,以高、中、低剂量组对肝损伤大鼠HSP70蛋白表达的修复作用有一定的量效关系,以高、中剂量组效果较好(P<0.01)。见表3,图1、图2、图3、图4、图5、图6。
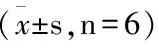
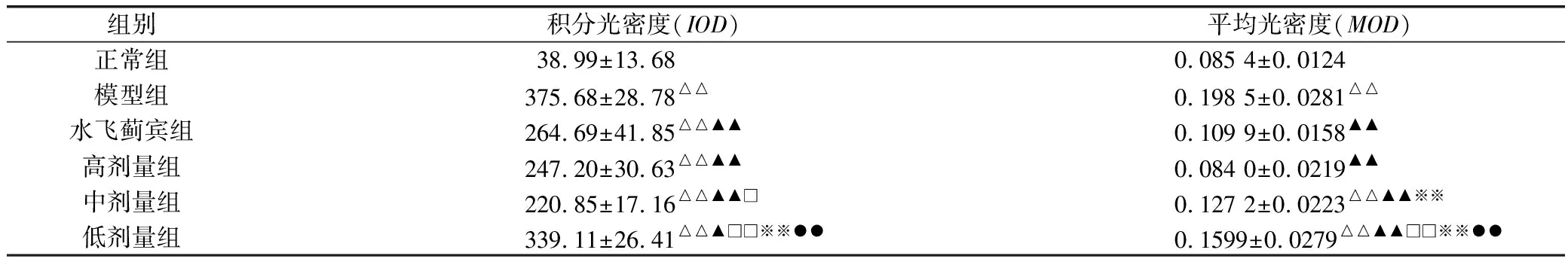
组别 积分光密度(IOD) 平均光密度(MOD)正常组38.99±13.680.085 4±0.0124模型组375.68±28.78△△0.198 5±0.0281△△水飞蓟宾组264.69±41.85△△▲▲0.109 9±0.0158▲▲高剂量组247.20±30.63△△▲▲0.084 0±0.0219▲▲中剂量组220.85±17.16△△▲▲□0.127 2±0.0223△△▲▲※※低剂量组339.11±26.41△△▲□□※※●●0.1599±0.0279△△▲▲□□※※●●
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与水飞蓟宾组比较,□P<0.05,□□P<0.01;与高剂量比较,※P<0.05,※※P<0.01;与中剂量组比较,●P<0.05,●●P<0.01。

图1 各组大鼠肝组织HSP70蛋白表达情况(组化,×20)
4 讨论
药物性肝损伤由于其特殊性若能早期诊断,早期停药治疗则能在很大程度上提高患者的生活质量。临床常用血清转氨酶和胆红素的升高作为肝损伤的主要评价标准,但这些指标主要用于肝损伤发生后的诊断检测。因此,寻找灵敏度高、特异性好的潜在生物标志物是需要亟待解决的问题。
近年来许多学者均致力于发现能早期诊断,且具有良好稳定性的肝损伤生物标志物,认为存在于肝脏的一种线粒体酶GLDH,在人体内水平较为稳定,其灵敏性高于ALT[4];而存在于肝脏一种催化反应酶ARG,则在诊断胆管损伤方面敏感度最高[5]。MDH为三羧酸循环中参与草酰乙酸与苹果酸转化的关键酶,若该循环被破坏,则肝细胞中的MDH迅速释放进入血清,而此时ALT并未发生变化[6]。朱平生团队通过用四氯化碳、对乙酰氨基酚、酒精复制不同类型的肝损伤模型,发现血清GLDH,ARG,嘌呤核苷酸磷酸化酶(PNP),α-谷胱甘肽-S-转移酶(α-GST)联合评价,对于及早发现肝损伤灵敏性更强[7]。本实验结果显示,模型组大鼠血清中ALT、AST、DBIL、MDH、GLDH、ARG含量显著升高。解毒护肝方各剂量组能够降低模型大鼠血清中ALT、AST、TBIL、DBIL、MDH、GLDH、ARG含量,提示解毒护肝方对APAP诱导的药物性肝损伤具有良好的保护作用。
HSP70 具有分子伴侣的作用,在蛋白质发生构象异常变化时,可避免其内部非疏水性氨基酸与一些肽、核酸分子或大分子发生不良的相互作用[8-9]。当肝脏受到药物刺激,发生应激反应时,可能会刺激肝脏内部的蛋白质结构发生变化,HSP70通过不断的和蛋白质结合或释放,修复损伤的蛋白质结构,进而促进肝组织的修复发挥保肝作用[10]。本实验结果显示,对乙酰氨基酚大鼠HSP70蛋白表达升高,而解毒护肝方各剂量组均能不同程度的降低模型组大鼠的HSP70表达。综上所述,解毒护肝方有较好的护肝作用,不仅能降低转氨酶和胆红素等传统肝功能指标的水平,还能降低早期标志物的水平,因此能起到一定的防治作用,其作用机理通过降低HSP70蛋白表达来实现。但药物所致的肝损伤是否影响了肝脏内部某蛋白构象的变化以及解毒护肝方是否通过调节HSP70蛋白表达修复蛋白构象发挥保肝作用,还需进行深入研究。

