Nras、Braf、Kras、Pik3ca基因突变检测在大肠癌治疗和预后中的临床研究
郑国华 代云 杨光明 杨列 蒋丽
[摘要] 目的 探讨大肠癌患者检测Nras、Braf、Kras、Pik3ca基因突变的临床价值。 方法 以2014年2月—2018年11月为时限,方便择取该院65例大肠癌患者,取术后新鲜肿瘤组织样本进行基因突变检测,观察其与大肠癌病理特征及生存率间的关系。 结果 结肠癌Braf突变率(11.11%)高于直肠癌,肿瘤直径3 cm以上患者Kras突变率(50.00%)高于3 cm以下患者,肿瘤低分化Braf突变率(21.05%)高于中高分化,肠癌复发Kras突变率(51.35%)高于未复发,差异有统计学意义(χ2=3.715、7.651、6.843、5.680,P<0.05),Nras、Braf、Kras、Pik3ca基因突变患者3年生存率分别为0.00%、20.00%、67.86%、33.33%,均低于野生型基因,差异有统计学意义(χ2=10.972、8.631、5.740、6.533,P<0.05)。 结论 Nras、Braf、Kras、Pik3ca基因突变检测能够为大肠癌靶向治疗及预后评估提供有价值的依据和指导,值得推广使用。
[关键词] 大肠癌;基因突变;基因检测;治疗;预后
[中图分类号] R735 [文献标识码] A [文章编号] 1674-0742(2019)08(b)-0029-04
[Abstract] Objective To investigate the clinical value of detecting Nras, Braf, Kras and Pik3ca gene mutations in patients with colorectal cancer. Methods From February 2014 to November 2018,convenient 65 patients with colorectal cancer were enrolled in our hospital. The fresh tumor tissue samples were taken for gene mutation detection to observe the relationship between pathological features and survival rate of colorectal cancer. Results The Braf mutation rate of colon cancer (11.11%) was higher than that of rectal cancer. The mutation rate of Kras mutation (50.00%) was higher than that of patients with tumor diameter above 3cm. The rate of poorly differentiated Braf mutation (21.05%) was higher than that of moderately differentiated colon cancer. The recurrent Kras mutation rate (51.35%) was higher than that without recurrence,the difference wasstatistically significant(χ2=3.715、7.651、6.843、5.680, P<0.05). The 3-year survival rates of patients with Nras, Braf, Kras and Pik3ca mutations were 0.00%, 20.00%, 67.86%, 33.33%, all lower than the wild type gene,the difference wasstatistically significant(χ2=10.972、8.631、5.740、6.533, P<0.05). Conclusion The detection of Nras, Braf, Kras and Pik3ca gene mutations can provide valuable evidence and guidance for targeted therapy and prognosis evaluation of colorectal cancer. It is worthy of popularization.
[Key words] Colorectal cancer; Gene mutation; Gene detection; Treatment; Prognosis
大腸癌是消化系统常见恶性肿瘤,2017中国癌症流行病学数据报告显示,发病率和死亡率分别居恶性肿瘤的第3位和第4位[1],严重威胁人群健康。靶向治疗指对已经明确的致癌位点展开细胞分子水平上的精准治疗,它开创了肿瘤化疗新领域,近年在大肠癌临床治疗中引起广泛重视[2]。有研究表明,RAS野生型基因患者抗表皮生长因子受体(EGFR)治疗客观有效率高于抗血管内皮生长因子(VEGF),能够为患者争取更长的疾病控制时间[3],因此,靶向治疗前开展基因检测十分必要。该文现以2014年2月—2018年11月该院65例大肠癌患者为例,分析探讨基因突变在大肠癌治疗及预后评估中的作用,现报道如下。
1 资料与方法
1.1 一般资料
方便择取该院收治的65例大肠癌患者,全部患者均行外科手术治疗,术后组织学检查明确病理诊断及特征,同时接受基因突变检测,排除临床资料不全者。入选病例中,男36例,女29例,年龄47~81岁,平均(66.2±9.4)岁。该研究获伦理委员会批准,患者签署知情同意书。
1.2 方法
全部患者术后石蜡组织。石蜡组织:白片置于切片盒中或组织切片转移至干净的 1.5 mL 离心管,常温环境下运输即可。样本要求样本需要满足以下标准,否则要求重新采样:
(1)石蜡组织: 肿瘤细胞比例大于 50%且避免肿瘤组织坏死(送检前先进行常规病理诊断)。石蜡组织切片厚度 8~10 μm 5 张(面积约 250 mm2)。若不能按上述操作提供样本,请提供 10 张标准石蜡组织切片(未经染色的白片),不接收染过色的切片。尽量送检一年以内的石蜡标本。常温环境下运输即可。
(2)样本处理
石蜡组织:(脱蜡过程)
①将石蜡切片放入 1.5 mL 离心管中,加入 1 mL 二甲苯,盖紧管盖并剧烈震荡混匀 10 s。
②室温(15℃~25℃)下 13 000 rpm离心5 min,吸去上清,保留沉淀。
③重复 5.4.1~5.4.2 步骤 1~2 次
④加入 1 mL 无水乙醇,剧烈震荡混匀,去除二甲苯
⑤室温(15℃~25℃)下 13 000 rpm 离心 5 min
⑥吸去上清,去除残留的乙醇,保留沉淀,重复 ④-⑤步骤一次。
⑦打开离心管盖子,室温或 37℃晾干,约 10 min,直到乙醇完全挥发
注意:如石蜡切片上蜡过多,可将加入二甲苯后的石蜡标本放置于 55℃水浴中 10 min 进行脱蜡。
(3)石蜡组织 DNA 提取
核酸提取及纯化(上海源奇公司, 货号 W006)
方案1
①加入 200 μL Buffer M1 和 20 μL Proteinase K,充分混匀,56℃孵育 1 h 直至样本完全裂解,(可以过夜消化)。
②置于 90℃孵育 1 h。
③(可选步骤)如果要去除RNA,可以向样本中加入 2 μL RNase A(100 mg/mL)(客户自备, TIANGEN, RT405-12),室温孵 2 min 后,进行下一步操作。
④在上管中加入 220 μLBuffer M2 涡旋混匀,再加入 250 μL 无水乙醇,涡旋震荡充分混匀,短暂离心使管壁上的溶液收集到管底。
⑤将上一步所得的混合液加入一个吸附柱 Spin Columns CR 中,8 000rpm(~6 000xg)室温离心 2 min,倒掉废液,重新将吸附柱放回收集管中。
注意:吸附柱最大容量为 700 μL,可将剩余液体重复上述步骤上柱。
⑥向吸附柱 Spin Columns CR 中加入 500 μL Buffer M3,8 000rpm(~6 000xg)室温离心 60sec, 倒掉收集管中的废液,将吸附柱放回收集管中。
⑦向吸附柱 Spin Columns CR 中加入 600 μL Buffer M4,8 000rpm(~6 000xg)室温离心 60sec, 倒掉收集管中的废液,将吸附柱放回收集管中。
⑧重复操作步骤⑦。
⑨将吸附柱 Spin Columns CR 放回收集管中,空管 12 000rpm(~13 400xg)离心 2 min,倒掉废液,将吸附柱开盖置于室温放置 2~5 min,以彻底晾干吸附材料中残余的 Buffer M4。
注意:乙醇残留会抑制后续的酶反应,所以晾干时要确保乙醇挥发干净。但也不要干燥太长时间, 以免难以洗脱DNA。
⑩将吸附柱 Spin Columns CR 转入下一个干净的离心管中,向吸附膜的中间部位悬空滴加 65℃预热的 30~100 μL Buffer M5 或 ddH2O 洗脱,室温放置 2~5 min,12 000rpm(~13 400xg)离心 2 min, 将收集有 DNA 的离心管-20℃保存。
注意:Buffer M5 體积不应少于 30 μL,体积过小影响回收效率。为增加基因组 DNA 的得率,可将离心得到的溶液再加入吸附柱 Spin Columns CR 中,室温放置 2 min,12 000rpm(~13 400xg)离心 2 min。洗脱液的 pH 对于洗脱效率有很大影响。若用 ddH2O 做洗脱液应保证其 pH 值在 7.0~8.5 范围内,pH 值低于 7.0 会降低洗脱效率;且 DNA产物应保存在-20℃,以防 DNA 降解。
操作步骤严格遵照肠癌6基因检测(NGS法)标准操作流程。检测采用仪器Ion torrent PGM 测序仪/III umina测序仪,检测基因包括Kras 2外显子 G12D、G12A、G12R、G12C、G12V、G12S、G13C、G13D、3外显子Q61L、Q61R、Q61H、4外显子、5外显子等。同时,取样肿瘤组织标本常规石蜡包埋、HE染色等处理,镜下观察肿瘤病理学特征,术后随访3年统计生存率,观察基因突变检测结果与患者大肠癌临床特征、病理特征及生存率间的关系。
1.3 统计方法
以SPSS 21.0统计学软件处理数据,计量资料用(x±s)表示,行t检验,计数资料以率(%)表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基因检测结果
65例患者中,基因突变33例(50.77%),其中5例患者2个基因合并突变,共计基因突变38例次,包括Nras突变2例(3.08%),Braf突变5例(7.69%),Kras突变28例(43.08%),Pik3ca突变3例(4.62%)。
2.2 基因突变与大肠癌病理特征分析
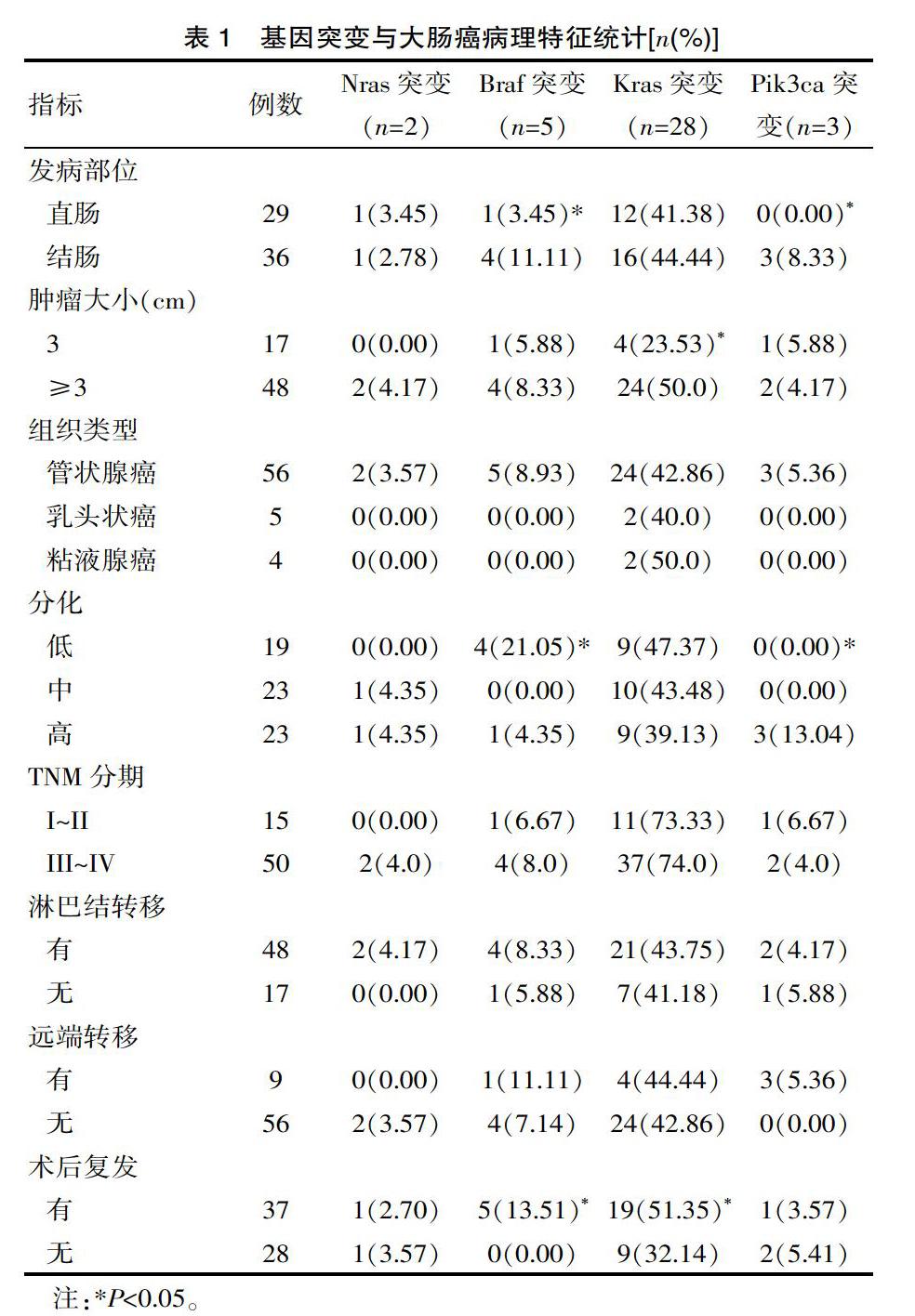
结肠癌患者Braf突变、Pik3ca突变发生率高于直肠癌患者,肿瘤直径3 cm以上患者Kras突变发生率高于3 cm以下患者,肿瘤低分化患者Braf突变发生率高于中高分化患者,术后肠癌复发患者Braf突变、Kras突变发生率高于未复发患者,差异有统计学意义(χ2=3.715、3.286、7.651、6.843、4.305、5.680,P<0.05),余各指标基因突变发生率相当,见表1。
2.3 基因突变与肠癌预后分析
随访显示,65例患者3年生存54例,生存率83.08%。各基因突变型患者3年生存率均明显低于野生型,差异有统计学意义(P<0.05),见表2。
3 讨论
近年研究发现,肠癌的发生与进展同一连串癌基因与抑癌基因突变有关[4],是一个受多基因调控的复杂过程,主要包括各种RAS基因、Braf基因、Pik3ca基因、Tp53基因等,其中Kras基因突变为主要肠癌标记。本研究纳入的65例肠癌患者中,基因检测突变33例,构成比50.77%,与文献报道大肠癌患者基因突变48.5%检出率的结论相近[5]。对比观察不同基因突变患者的病理特点,结果显示,不同发病部位、肿瘤直径、肿瘤分化程度及预后的患者Braf、Kras、Pik3ca基因突变率存在明显差异,能够为该病临床治疗提供一定参考。其中,Braf基因突变患者术后随访期间肿瘤均转移复发,考虑是影响患者预后的危险因素。Pik3ca基因突变是近年临床关注热点,有研究指出其与大肠癌远处转移存在密切相关性,考虑可能与该突变基因引起大肠癌对抗EGRF药物不敏感有关[6],该次临床研究中,3例Pik3ca基因突变患者均出现远端转移,发生率5.36%,与文献报道结论(4.79%)相近[7]。Nras基因在该研究中不同病理特点的肠癌患者中差异无统计学意义(P>0.05),考虑与样本数较少、Nras基因突变检出率过低等因素有关。另外,研究发现基因突变的肠癌患者生存率显著较野生型患者下降,但目前临床尚未完全明确其机制。国外有研究指出,基因突变可能在“畸形隐窝灶-增生性息肉-锯齿状瘤-癌”这一肠癌病理改变中扮演着催化角色[8],从而促进了癌细胞增殖分化,加剧癌细胞侵袭性生长。
综上所述,Nras、Braf、Kras、Pik3ca基因突变检测能够为大肠癌靶向治疗及预后评估提供有价值的依据和指导,值得推广使用。
[參考文献]
[1] 邹劲林,牛斌,莫湘琼,等.左、右半结肠癌KRAS基因和VEGF表达水平及其临床意义[J].重庆医学,2018,47(31):4010-4013,4017.
[2] 季硕超,刘淑真,郑德杰,等.结肠癌KRAS基因突变与病理特征、吸烟和饮酒的相关性[J].湖北民族学院学报:医学版,2018,35(3):22-24.
[3] 刘亮,杨丽,黄劲柏,等.结肠癌~(18)F-FDG摄取与KRAS突变及患者临床特征的相关性研究[J].临床放射学杂志,2018, 37(5):811-815.
[4] 史敏,郭晓波,李思远,等.结直肠癌患者组织中K-ras和BRAF基因突变与不同病理特征的相关性分析[J].现代检验医学杂志,2018,33(3):27-30.
[5] 厉金雷,蔡剑辉,任约翰,等.Nras、Braf、Kras、Pik3ca基因突变检测在大肠癌治疗和预后中的临床价值研究[J].中国现代医生,2017,55(23):1-5,169.
[6] 王雷动,吴淑华,李扬扬,等.大肠癌中PIK3CA、PIK3CB与EGFR表达的相关性及其临床意义[J].世界华人消化杂志,2015,23(26):4200-4207.
[7] 温菲菲,吴淑华,李扬扬,等.大肠癌组织中PIK3CA、PIK3CB蛋白与多药耐药基因产物表达的相关性及其临床意义[J].世界华人消化杂志,2015,23(2):202-209.
[8] Dopeso Higinio,Rodrigues Paulo,Bilic Josipa,et al.Mechanis ms of inactivation of the tumour suppressor gene RHOA in colorectal cancer[J].The British journal of cancer,2018,118(1):106-116.
(收稿日期:2019-05-17)

