CCNB1在原发性肝癌中的表达及临床意义
石小康,丁佑铭,汪斌,余斌,徐雨
(武汉大学人民医院 肝胆外科,湖北 武汉 430060)
原发性肝癌(以下简称肝癌)是最常见的恶性肿瘤之一,其中以肝细胞癌(hepatocellular carcinoma,HCC)多见,约占70%~90%[1]。据统计,在癌症死因中,肝细胞癌是仅次于肺癌和胃癌的第三大死因,全球每年新增肝癌患者约841 000例患者,死亡病例高达782 000左右[2]。值得注意的是,仅中国就占每年新增病例和死亡人数的一半以上[3]。根治性治疗术是目前治疗肝癌的主要手段,通过严格的入选标准,部分患者甚至可以达到治愈的效果。尽管如此,由于大多数肝癌患者发现时间晚,且术后复发率高,故其预后仍然欠佳[4]。因此,亟需深入研究肝癌的发病机制,寻找敏感性高、特异性强的肿瘤标志物,以期为肝癌的早期诊断、有效治疗及预后判断提供可靠依据。细胞周期是生命活动的重要生物过程,肿瘤的形成与正常细胞周期失调息息相关。细胞周期蛋白B1(CyclinB1,CCNB1)为G2/M期的起重要调控作用的细胞周期蛋白,是启动有丝分裂的关键分子。诸多研究发现其在肿瘤组织中表达上调,如非小细胞肺癌[5]、乳腺癌[6]、胃癌[7]、结直肠癌[8]等。亦有研究发现该基因在肝癌组织呈高表达,且其表达水平与肝癌患者不良预后关系密切[9]。CCNB1是否可作为肿瘤治疗的新靶点,引起国内外学者的关注。本文基于癌症基因图谱(The Cancer Genome Atlas,TCGA)公共数据库肝癌组织标本数据,利用生物信息学分析CCNB1在肝癌中的表达并探究其异常表达的潜在机制;同时还分析了其异常表达在肝癌患者中的临床意义,旨在阐明其在肝癌早期诊断及预后评估等方面的价值。
1 资料和方法
1.1 数据来源与数据筛选
截至目前,TCGA数据库收录了来源于11 000多个肿瘤样本的33种类型的癌症数据资料。基于此,本研究从TCGA数据库(https://cancergenome.nih.gov/)中下载肝癌及正常肝组织样本的mRNA seqV2表达谱数据集及匹配的患者临床病理资料。纳入标准:(1)病理确诊为肝细胞肝癌的肝癌患者;(2)有完整的临床资料及预后随访资料;获取的CCNB1基因表达谱数据经Log2处理后用于后续分析。经严格的纳入标准筛选,最终余下正常肝组织样本50例,肝癌组织样本365例,其中有314例包含完整的无病生存时间随访。同时,从The Human Protein Atlas(HPA)数据库(https://www.proteinatlas.org/)[10]下载CCNB1蛋白在肝癌组织(n=12)及正常组织(n=3)中的表达数据,旨在研究CCNB1在肿瘤组织及正常组织中蛋白水平的表达差异;此外,从UCSC xena网站(https://xena.ucsc.edu)[11]下载与之匹配的目的基因拷贝数变异及甲基化数据,旨在深入研究该基因表达上调的可能作用机制。
1.2 方法
1.2.1 患者分组:提取371例肝癌患者CCNB1 mRNA seqV2表达谱数据集及匹配的患者临床病理资料,按照CCNB1表达水平,以中位数为截断值,小于中位数的患者定义为CCNB1低表达组,反之则为高表达组。
1.2.2 富集分析:提取从cBioPortal数据库下载的CCNB1共表达基因集[12],筛选标准为:皮尔森系数≥0.8,共获取95个共表达基因。然后,利用DAVID网站(https://david.ncifcrf.gov/)[13]进行基因本体论(gene ontology,GO)及KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析,并利用Cytoscape软件进行富集结果比对。其中,GO分析结果包括三个部分,分别为细胞组分(cellular component,cc)、分子功能(molecular function,mf)、生物过程(biological process,bp)。
1.3 作图及统计学分析
使用GraphPad Prism 6软件作图,采用SPSS 22.0版软件进行统计分析。癌组织与正常组织间基因表达水平及甲基化水平的差异表达比较采用配对t检验;CCNB1基因表达水平与肝癌患者临床病理学特征采用χ2检验;受试者工作特征曲线(ROC)用于评价指标诊断效能,计算曲线下面积(area under the curve,AUC);Kaplan-Meier法分别分析两组患者的总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS),Log-Rank法检验;单因素及多因素Cox回归模型评价各临床病理学参数及CCNB1表达水平对肝癌患者预后的影响;线性回归分析分析CCNB1表达与其DNA甲基化水平的相关性。以P<0.05表示具有统计学意义。
2 结果
2.1 CCNB1在肝癌组织及正常肝组织中的差异表达及诊断价值
利用GEPIA数据库在线分析CCNB1基因在肝癌组织和正常肝组织中的表达水平,同时提取TCGA数据库中肝癌组织(n=371)和正常肝组织(n=50)中CCNB1 mRNA seqV2表达谱数据,结果一致表明CCNB1在肝癌组织中表达水平明显高于正常肝组织,二者差异具有统计学意义(P<0.001) (图1A和B)。为研究CCNB1 mRNA在肝癌组织和肝组织中的蛋白表达水平,我们利用HPA数据库,发现CCNB1在正常肝组织(n=3)中无表达,肝癌组织(n=12)中有9例为中度表达,3例无表达(图1D)。进一步利用ROC模型对该基因表达情况分析,结果显示ROC曲线下面积AUC=0.9799,95%CI0.9673~0.9924,提示CCNB1对肝癌具有良好的诊断效能(图1C)。
2.2 CCNB1 mRNA表达与肝癌患者临床病理特征的关系
根据TCGA数据库现有的肝癌患者临床病理资料,按照CCNB1 mRNA表达水平,以中位数为截断值,将肝癌患者分为高表达组(n=186)和低表达组(n=185),并分析高/低组患者临床病理资料间的差异。结果显示:两组患者的种族(P=0.005)、AFP表达水平(P<0.0001)、病理分级(P<0.0001)、血管侵袭(P<0.0001)等之间有显著统计学差异,但比较两组患者年龄(P=0.123)、性别(P=0.337)、TNM分期(P=0.057)、Child-Pugh肝功能(P=0.062)等发现无明显统计学差异。见表1。
2.3 CCNB1 mRNA表达与肝癌患者OS的关系
为了探究CCNB1 mRNA表达对肝癌患者生存预后的影响,利用Kaplan-Meier法进行高/低表达组与肝癌患者OS的生存分析,结果显示CCNB1 mRNA高表达患者与其不良OS显著相关(P=0.0015) (图2A)。为进一步探究该基因表达对评估肝癌患者OS的预后价值,利用Cox比例风险模型进行了单因素和多因素分析。在单因素Cox回归表明,CCNB1表达水平(P=0.001)、AFP表达水平(P=0.021)、TNM分期(P<0.001)与肝癌患者OS显著相关;在多因素Cox回归分析进一步提示TNM分期(HR2.088,95%CI1.421~3.066,P<0.001)、CCNB1 mRNA表达水平(HR1.544,95%CI1.052~2.266,P=0.027)是影响肝癌患者OS的独立危险因素。见表2。
2.4 CCNB1 mRNA表达与肝癌患者DFS的关系
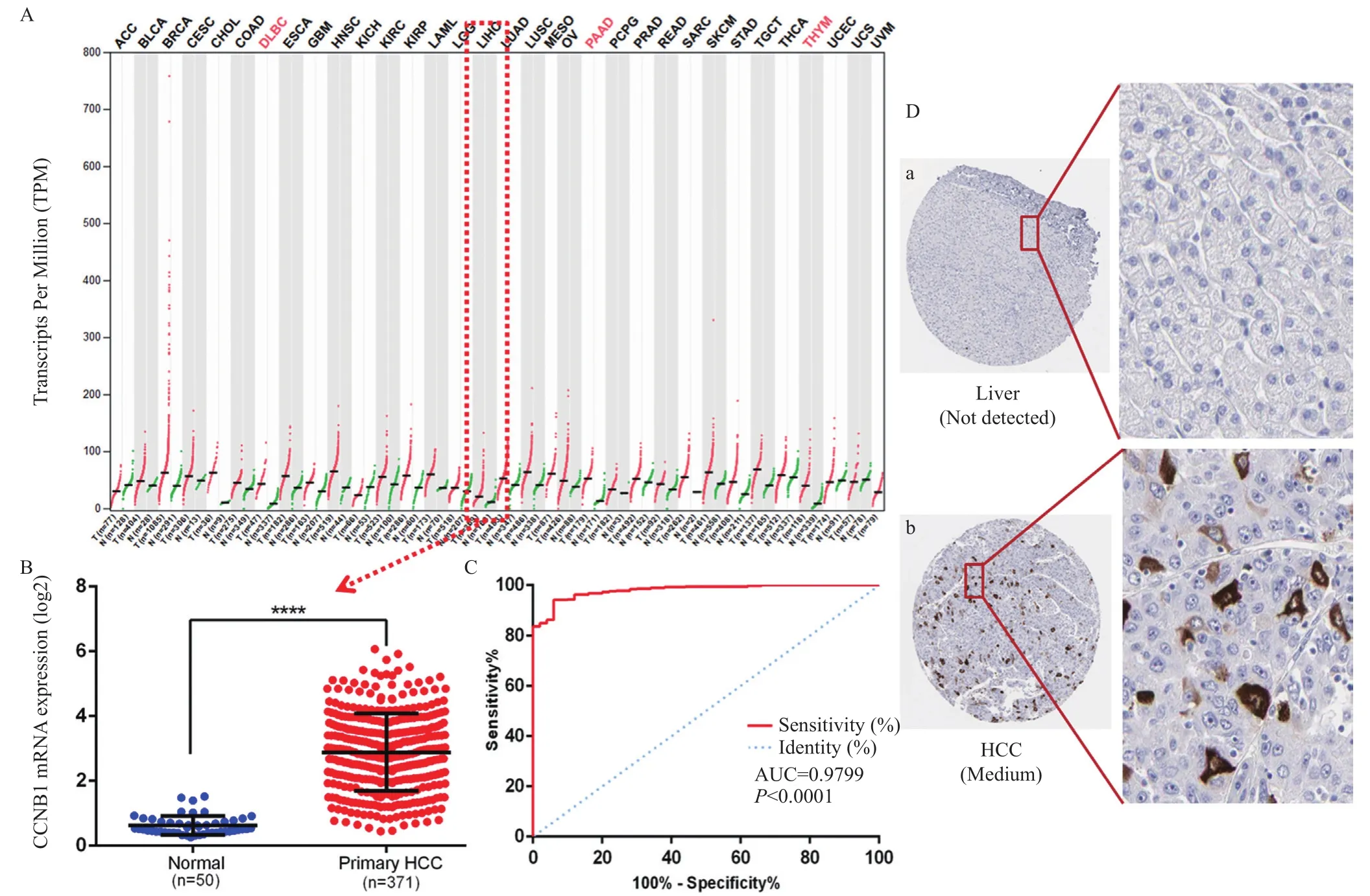
图1A:CCNB1基因在多种肿瘤中的差异表达;B:CCNB1基因在肝癌组织(n=371)及正常肝组织(n=50)中表达比较;C:肝癌患者CCNB1基因表达的ROC曲线;D:CCNB1蛋白在正常肝组织(a)及肝癌组织(b)中的表达

表1 CCNB1表达与肝癌患者临床病理特征的关系
与此同时,利用Kaplan-Meier法进行高/低表达组与肝癌患者DFS的生存分析,结果同样表明,CCNB1 mRNA高表达患者与其不良DFS显著相关(P=0.0004) (图2B)。在单因素Cox回归表明,CCNB1 mRNA表达水平(P<0.001)、AFP表达水平(P=0.029)、TNM分期(P<0.001)、血管侵袭(P<0.001)与肝癌患者OS显著相关;在多因素Cox回归分析进一步提示TNM分期(HR1.849,95%CI1.292~2.645,P=0.001)、CCNB1 mRNA表达水平(HR1.793,95%CI1.277~2.517,P=0.001)及血管侵袭(HR1.608,95%CI1.127~2.294,P=0.009)是影响肝癌患者DFS的独立危险因素(见表3)。
2.5 CCNB1 mRNA共表达基因集的GO分析和KEGG分析结果
为探讨CCNB1基因参与肝癌形成的潜在机制,我们对CCNB1共表达基因进行聚类分析,以预测CCNB1的基因功能。利用DAVID在线分析工具进行富集分析,GO分析结果显示,CCNB1共表达基因参与的生物过程(BP)包括细胞增殖、细胞周期调控、有丝分裂细胞周期的G1/S转换、有丝分裂细胞周期的G2/M转换、染色体分离、细胞分裂、DNA损失修复等;主要涉及的分子功能(MF)包括:染色质结合、微管运动、蛋白质结合等;主要涉及的细胞成分(CC)包括:细胞质、核质、染色体及着丝粒区域等。KEGG分析结果显示,CCNB1共表达基因主要参与细胞周期调控、孕酮介导的卵母细胞成熟、p53信号通路等信号通路(图3A)。同时利用Cytoscape软件进行KEGG富集分析,分析结果与上述基本一致(图3B)。这提示,CCNB1可能通过细胞周期调控、介导DNA损失及影响p53信号通路等参与肝癌的发生、发展。

图2A:CCNB1高表达和低表达肝癌患者OS生存曲线;B:CCNB1高表达和低表达肝癌患者DFS生存曲线

表2 影响肝癌患者OS的临床病理因素的单因素和多因素分析

表3 影响肝癌患者DFS的临床病理因素的单因素和多因素分析
2.6 CCNB1 DNA甲基化与其基因表达的关系

图3A:CCNB1共表达基因的GO和KEGG通路分析;B:CCNB1共表达基因的通路富集分析
为深入探究该基因在肝癌中异常表达的潜在机制,我们利用UCSC xena网站进一步对371例TCGA肝癌组织及50例正常肝组织标本进行数据挖掘和分析。在所有肝癌组织标本(n=371)中,共364例组织同时包含CCNB1拷贝数变异(copy number alterations,CNAs)和CCNB1 mRNA表达数据(图4A),其中,94例(25.8%)为复制子扩增(+1/+2),223例(61.2%)例拷贝数无改变(0),按其拷贝数变异情况,分为扩增组(+1/+2)和无改变组(0),进一步分析两组病人组织CCNB1基因表达差异,结果表明扩增组患者CCNB1 mRNA表达明显高于无改变组(图4D),差异具有统计学意义(P<0.01)。然后我们进一步分析CCNB1 mRNA表达与其DNA甲基化水平的关系,结果表明CCNB1在肝癌组织中有12个甲基化位点(图4B),且在肝癌组织中甲基化明显低于正常肝组织(P<0.001) (图4C),CCNB1 mRNA与其平均甲基化水平呈负相关(r=-0.1327,P=0.011,图4E)。这提示CCNB1异常表达可能部分受其基因甲基化水平的调控。
3 讨论
原发性肝癌是最常见的恶性肿瘤之一,占全世界癌症死亡人数的9%,而在发展中国家则高达12%[1]。目前肝癌治疗方式主要包括手术切除、肝移植、消融治疗及肝动脉化疗栓塞术(TACE)等,尽管治疗手段多样,但肝癌发病较为隐匿,大多数被诊断时已处于中晚期,因此其整体预后仍欠佳。鉴于临床上肝癌发病隐匿、易转移和复发等特点,早发现、早诊断、早治疗对改善肝癌患者治疗效果和提高患者生存率则尤为重要。众所周知,AFP是原发性肝癌诊断中应用最为广泛的一个肿瘤标记物,但其诊断敏感性和特异性并不高,分别为39%~64%和76%~91%[14]。因此仍需探寻新的分子靶标,提高肝癌患者的早期诊断和预后判断,以期更为积极有效地改善肝癌患者预后。CCNB1表达的蛋白cyclin B1是成熟促进因子(maturation promoting factor,MPF)的调节亚单位,其与MPF的催化亚单位细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)结合后,在G2/M期交接处发挥作用,驱动细胞周期时相转换,是启动有丝分裂的关键分子。作为细胞周期的重要调节因子,诸多研究发现CCNB1蛋白在多种肿瘤中呈现表达上调,且与患者不良预后显著相关。Cooper等[5]研究发现,CCNB1在非小细胞肺癌中表达明显上调,且高CCNB1表达患者总生存率明显低于低表达组。同样地,Begnami等[7]发现CCNB1在胃癌中表达明显上调且与患者不良预后显著相关。鉴于CCNB1在人类肿瘤中普遍表达上调且与大多数肿瘤患者预后相关,笔者推测其可能成为潜在的癌症检测、治疗及预后评估的重要靶标。然而,关于CCNB1在肝癌组织及肝癌患者临床预后研究目前尚少,因此本文利用TCGA数据库分析了CCNB1在肝癌组织中的异常表达水平及其与肝癌患者临床预后相关性,同时探究了其在肝癌组织中异常表达的潜在机制。

图4A:CCNB1基因拷贝数变异与基因表达的关系;B:CCNB1基因表达与其DNA甲基化水平的关系;C:CCNB1在肝癌组织和正常肝组织甲基化水平比较;D:CCNB1表达在不同拷贝数变异组肝癌患者中的比较;E:CCNB1 DNA甲基化平均水平与CCNB1表达水平的相关性分析结果
细胞周期是细胞生命活动的基本过程,其主要受到细胞周期蛋白(Cyclins)、周期蛋白依赖性蛋白激酶(CDKs)以及周期蛋白依赖性蛋白激酶抑制因子(CKIs)等的调控。它们之间相互调控以完成对细胞周期的准确调控。既往文献报道,Cyclins-CDKs-CKIs调节系统中的相关蛋白或基因的改变与肿瘤的发生关系极为密切[15-17]。近年来,有学者认为肿瘤实质上就是一类细胞周期疾病,其发生、发展与正常细胞周期的失调控密切相关。因此,深入研究以细胞周期相关基因为靶标的肿瘤治疗有着广阔的前景[18]。本研究基于TCGA数据库发现,无论是mRNA水平还是蛋白水平,CCNB1在肝癌组织表达均高于正常肝组织,且与肝癌患者不良OS和DFS明显相关。分析CCNB1 mRNA与肝癌患者临床病理特征间的关系发现,CCNB1 mRNA表达水平与患者种族、AFP水平、病理分级、血管侵袭等显著相关。Cox回归分析表明CCNB1高表达是影响肝癌患者临床预后的独立危险因素。为进一步深入探索CCNB1在肝癌中表达上调的机制,我们采用UCSC在线数据库分析得出,其表达上调可能与CCNB1基因复制子扩增有关,且CCNB1 DNA甲基化部分参与调控该基因的表达。
Yuan等[19]研究发现沉默CCNB1可以显著降低乳腺癌细胞(MCF-7、MDA-MB-435及BT-474)的增殖能力同时提高细胞的凋亡率。为了研究CCNB1异常表达是否影响肝癌细胞的生物学特征,张勇等[20]通过靶向CCNB1基因敲除技术,发现CCNB1基因敲除可以明显增加肝癌细胞HepG2对化疗药物柔红霉素的敏感性,CCNB1低表达的肝癌细胞克隆增殖能力显著受到抑制,由此可知,HepG2的克隆增殖能力的确受到CCNB1高表达的影响。值得关注的是,通过抑制CCNB1表达不仅有效抑制肝癌细胞的能力增殖,还可增加其对化疗药物的敏感性。因此,探究CCNB1与肝癌的关系极具潜在的临床价值。为了进一步探究CCNB1在肝癌中的重要作用,我们利用GO和KEGG富集分析探究了CCNB1共表达基因的生物学功能。结果表明,CCNB1共表达基因集主要参与细胞周期调控相关的功能如有丝分裂细胞周期的G1/S转换、有丝分裂细胞周期的G2/M转换、染色体分离、细胞分裂、DNA损失修复等,参与的调控通路包括细胞周期调控、孕酮介导的卵母细胞成熟、p53信号通路等。Zhang等[21]研究发现通过CCNB1沉默可以诱导p53再活化和调节凋亡相关蛋白,降低胰腺癌细胞的增殖能力,减少肝癌细胞S期比例,相反显著增强了胰腺癌细胞的凋亡和衰老,提高了G0/G1期细胞比例。同样,有文献亦报道CCNB1的异常表达可通过p53信号通路等影响肿瘤的生物学效应[22-23]。有鉴于此,我们推测CCNB1亦可能通过上述机制参与肝癌的发生、发展,但仍需后续实验予以佐证。
本研究利用生物信息学方法分析了CCNB1在肝癌患者中的表达并探究其在肝癌组织中异常表达的潜在机制,同时分析了其异常表达在肝癌患者中的临床意义,为进一步研究CCNB1在肝癌中的基础和临床研究提供线索和依据,但仍需进一步予以佐证。基于此,本实验室将会进一步在细胞和动物水平上验证CCNB1在肝癌中的具体作用机制,以期为肝癌的临床诊断和治疗提供新方向。

