含硫化合物对不同土壤硝化作用和N2O排放的影响
王梦思,马红亮,b*,高人,b,尹云锋,b,彭园珍,b,杨柳明,b
(福建师范大学 a.地理科学学院,b.湿润亚热带山地生态国家重点实验室培育基地,福州 350007)
0 引言
氨基酸是主要的土壤有机氮化合物,20%~50%的土壤氮素存在于氨基酸中[1]。氨基酸-N能在土壤中迅速矿化成NH4+-N和NO3--N,是固定N的重要储存库,对土壤氮素保持和迁移转化过程起重要作用[2-3]。已有研究发现,性质不同的氨基酸(酸性、中性、碱性和含硫氨基酸)的C/N比、侧链结构、分解速率等差异可能会对土壤氮素转化产生不同的影响[4]。如Vinolas等[5]发现带正电性的氨基酸(赖氨酸)可被土壤中阳离子交换位有力吸附,而中性的甘氨酸和带负电性的谷氨酸则相反。裴广廷等[6]发现丙氨酸和甲硫氨酸对土壤NH4+-N、NO3--N、N2O的影响有很大差异,理化性质不同的酸性、中性、碱性氨基酸在土壤中表现相似,而与含硫氨基酸差异较大。进一步发现,甲硫氨酸显著抑制土壤硝化和亚硝化过程,使土壤中NH4+-N积累,并在一定程度上促进N2O的排放[7],还有人发现甲硫氨酸添加进土壤 48 h 后,其含量显著下降的同时伴随着硫矿化的增加[8],硫酸还原菌能显著促进水环境中甲硫氨酸的降解[9],它的分解产物 CS2[10]与氨单加氧酶(AMO)活性中心的亲核氨基酸(与Cu原子很接近)发生可逆反应,阻碍NH4+-N向NO2--N转化,导致硝化底物NO2--N含量减少,从而抑制硝化作用[11]。因此,含硫氨基酸在土壤氮素转化中具有特殊性,可能与硫的作用有关。
目前模拟氮沉降对土壤排放N2O研究较多,大多数研究表明氮沉降对土壤排放N2O有明显的促进作用[12-13]。含硫化肥比不含硫化肥产生更多的N2O[13],且含硫化肥使土壤pH降低,使硝化过程中硝酸盐转化成N2O的速率和反硝化过程中N2O转化为N2的速率加快[14],因此,硫沉降对土壤N2O排放也具有重要影响[13]。土壤硝化作用是氮素循环的重要环节,也是生态系统中氮素损失和影响生态环境的潜在途径之一,且土壤的矿化和硝化作用特征与土壤类型密切相关[15]。而不同含硫化合物是否对土壤氮转化具有相似的影响,是理解硫沉降和土壤有机氮转化机理的内容之一。
因此,以不同pH值的3种森林土壤为研究对象,在60%饱和持水量(WHC)条件下,分别添加有机含硫化合物(甲硫氨酸、半胱氨酸)和无机含硫化合物(硫酸钠),分析了土壤中NH4+-N、NO3--N、总可溶性氮(Total soluble nitrogen,TSN)、可溶性有机氮(Soluble organic nitrogen,SON)含量和N2O释放量的变化,研究含硫化合物对土壤硝化作用的抑制是否具有普遍性,以期为酸沉降机理和N2O释放的调控提供参考。
1 材料与方法
1.1 供试土壤
3种不同pH值土壤选自:黑土(Mollisols)采自长白山,中国东北(127°42′E,41°43′N),土壤标记为D。红壤(Haplohumults)来自中国福建省建瓯市万木林自然保护区(118°09′E,27°03′N)土壤标记为F。碱性土壤(Inceptisol)来自中国河南省洛阳市(112°27′E,34°49′N),土壤标记为H。在样地的上、中、下坡随机选取10个采样点,用土钻采集样地表层(0~15 cm)土壤,挑除石块和凋落物,充分混匀土壤带回实验室,土壤过2 mm筛后,装袋放入冰箱(4 ℃)保存备用。3种土壤的特征见表1。
1.2 室内培养
表 1 土壤主要理化特性Table 1 Major soil physiochemical properties

土样全碳/(g·kg-1)全氮/(g·kg-1)C/N铵态氮/(mg·kg-1)硝态氮/(mg·kg-1)pH饱和持水量/(g·kg-1)黏粒/%粉砂/%砂粒/%D89.2a7.47a11.9a18.1a28.3a5.86a1 426a11.1a16.7a32.2aF46.3b3.01b15.4b52.8b26.1b4.13b925b13.4b31.4b55.2bH19.0c1.35c14.4c12.0c11.2c8.34c649c10.3c48.0c41.7c
注:D,东北黑土;F,福建红壤;H,河南碱性土壤,下同。不同的小写字母代表土壤性质上存在显著差异(P<0.05)。数据为平均值(n=3)。设4个处理,分别是对照(CK)、添加甲硫氨基酸(Met)、添加半胱氨酸(Cys)、添加硫酸钠(S),每种处理3个重复。称取相当于烘干土质量30 g的新鲜土样装入300 mL培养瓶中,Met、Cys、S的添加量分别为40 mg·N·kg-1、40 mg·N·kg-1[16]、91 mg·S·kg-1,根据需水量配制成溶液均匀添加进土壤,并用蒸馏水称重法调至60%WHC,对照添加等量蒸馏水。用保鲜膜封盖瓶口并打孔保鲜膜以保持有氧条件,随机排列置于25 ℃恒温培养箱中培养。通过称重加入需要的去离子水来调节含水量,每2~3天调整一次。在第0、21天破坏性取土样,每次取样随机选取3个重复,称取相当于8 g烘干土的培养土置于60 mL离心管中,加入40 mL 0.5 mol·L-1K2SO4溶液浸提土壤(水土比5∶1),盖上瓶盖置于摇床中振荡1 h(250 r·min-1)后,离心10 min(4 000 r·min-1),离心后用0.45 μm滤膜过滤,得到的待测滤液用于测定NH4+-N、NO3--N、总可溶性氮(Total soluble nitrogen,TSN);在第5、10、21天采集气体、测定N2O浓度。每次气体取样前打开瓶口保鲜膜,将培养瓶置于通风口换气,使瓶内气体与空气充分混合,随机选取3个培养瓶,收集瓶内气体;然后立即密封培养瓶,24 h之后,再次抽取气体,打开瓶盖,用扎孔保鲜膜覆盖培养瓶继续培养。采集的气体,注入到铝膜气袋(50 mL,大连徳霖)中保存,待测N2O浓度。
1.3 测定方法
土壤理化性质:土壤pH采用电位法,水土比为2.5∶1(V/V);土壤粒径采用土壤粒径分析仪(SEDIMAT 4-12)按美国标准进行分析,将全土分为砂粒(50~2 000 μm)、粉粒(2~50 μm)和黏粒(<2 μm)。用环刀法测定土壤饱和持水量,采用烘干法测定土壤含水量(105 ℃,24 h);使用连续流动分析仪(SKALAR SAN++,荷兰)测定土壤滤液中的NH4+-N、NO3--N和TSN含量;用气相色谱仪(GC-2014,日本)测定气体中的N2O浓度,载气为高纯He,流速30 mL·min-1,检测器为PECD1,检测器温度320 ℃,柱温60 ℃,标准气体N2O浓度为0.353 μL·L-1;土壤全碳、全氮用碳氮元素分析仪(Elemantar vario MAX CN,德国)测定。
1.4 数据计算
土壤可溶性有机氮(SON)含量的计算[17]:
SON=TSN-(NH4+-N-NO3--N)
(1)
式(1)中:SON为可溶性有机氮(mg·kg-1),TSN为总可溶性氮(mg·kg-1),NH4+-N 为铵态氮(mg·kg-1),NO3--N为硝态氮(mg·kg-1)。
土壤N2O产生速率的计算方法[18]:
(2)
式(2)中:F表示气体产生速率(μg·kg-1·h-1);k为常数,取值1.25(kg·m-3);△c/△t为气体在观测时间内浓度随时间变化的直线斜率(10-6·h-1);V为培养容器体积(mL);m为土重(kg);T为培养温度(℃)。
氮矿化量为培养期内氨化作用产生NH4+-N 含量加上硝化作用产生NO3--N含量[19]。氮净氨化(或硝化)量等于土样从培养起始到培养终止NH4+-N(或 NO3--N)浓度随时间的变化值[19]。土壤净氮矿化、氨化、硝化速率(mg·kg-1·d-1)的计算公式[3]:
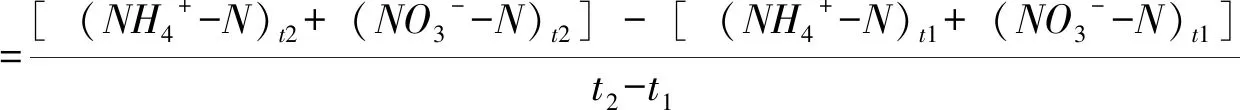
(3)
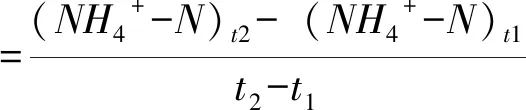
(4)
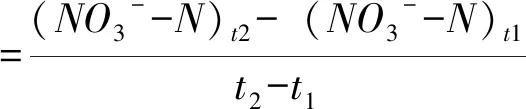
(5)
式(3~5)中:(NH4+-N)t2、(NO3--N)t2分别为培养后的铵态氮和硝态氮含量(mg·kg-1);(NH4+-N)t1、(NO3--N)t1分别为培养初的铵态氮和硝态氮含量(mg·kg-1)。
SON变化量=SONt2-SONt1
(6)
TSN变化量=TSNt2-TSNt1
(7)
式(6~7)中:SONt2、TSNt2分别为培养后的可溶性有机氮和总可溶性氮含量(mg·kg-1);SONt1、TSNt1分别为培养初的可溶性有机氮和总可溶性氮含量(mg·kg-1);t2、t1分别代表第21、1天。
1.5 统计分析
采用SPSS 18.0中的单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)分析不同含硫化合物处理间的差异显著性;采用双因素方差分析土壤类型、含硫化合物处理及二者交互作用对净转化速率和氮素变化量的影响,以及时间、含硫化合物处理及二者交互作用对N2O产生速率的影响;利用Pearson相关系数检验各氮素之间的相关性。图表中数据为平均值±标准差。
2 结果与分析
2.1 土壤氮净转化速率的变化
在CK处理中,净氨化速率在土壤D,F和H分别为0.10、-0.17和0.07 mg·kg-1·d-1(图1a)。与CK相比,Met和Cys处理D和F土壤的净氨化速率显著升高,在D土壤分别为1.53和1.22 mg·kg-1·d-1,在F土壤分别为1.78和2.31 mg·kg-1·d-1;H土壤的净氨化速率,为负值。S处理变化不明显,且均为负值。方差分析显示,土壤类型、含硫化合物处理及二者交互作用对净氨化作用有极显著影响(P<0.001)。
在CK处理中,D土壤的净硝化速率分别显著高于F和H土壤 49.2%和130.1%(图1 b)。与CK相比,净硝化速率在D土壤的各处理变化不明显;F土壤在Met和Cys中分别显著降低了146.4%和122.4%;但是H土壤在Met和Cys中显著提高了403.6%和312.0%。在CK和S处理中,净硝化速率表现为土壤D>F>H,而在Met和Cys中则表现为土壤H>D>F。方差分析显示,土壤类型以及土壤类型和含硫化合物处理二者的交互作用对净硝化速率有极显著影响(P<0.001)。
在CK处理中(图1 c),D土壤的净矿化速率分别显著高于F和H 土壤96.2%和122.2%。与CK相比,Met和Cys处理分别使D土壤的净矿化速率提高了109.0%和207.9%,F土壤的净矿化速率提高了109.0%、207.9%,H土壤的净矿化速率提高了267.5%和215.8%,而S处理仅显著提高了F土壤105.1%。在Met处理中,D和H土壤的净矿化速率显著高于F土壤73.8%和55.2%,而在Cys处理中,D土壤显著高于F和H土壤 39.6%和54.1%,S处理中3种土壤的净矿化速率变化不明显。方差分析显示,只有含硫化合物处理对净矿化速率有极显著影响(P<0.001)。
2.2 土壤中可溶性有机氮和总可溶性氮的变化
如图2 a所示,实验期间,土壤SON在CK处理增加,但是在Met处理降低;在Cys处理3个土壤差异较大,而在S处理F和H土壤增加。因此,与CK相比,Met处理中土壤D、F和H的SON变化量显著降低964.9%、497.6%和321.6%,Cys处理中D和F土壤SON变化量显著降低1 284.0%和270.4%,H土壤则高于CK 28.8%,在S处理D土壤的SON变化量显著降低421.6%,而F和H土壤显著高于CK 326.7%和76.1%。方差分析显示,土壤类型和含硫化合物处理及二者交互作用对土壤SON含量变化均有显著影响(P<0.05)。

注:CK,对照Contrast;Met,甲硫氨酸Methionine;Cys,半胱氨酸Cysteine;S,硫酸钠Sodium sulfate。统计分析包括土壤类型和 含硫化合物处理及二者交互作用对净转化速率的影响,P<0.05表示因素对净转化速率的影响显著。不同的小写字母代表相同 处理中不同土壤之间存在显著差异(P<0.05);不同大写字母代表相同土壤中不同处理之间存在显著差异(P<0.05)。下同。图 1 不同含硫化合物添加对土壤氮净氨化速率、净硝化速率和净矿化速率的影响Figure 1 Effects of different sulfur compounds on soil net ammonification,net nitrification and net nitrogen mineralization rate
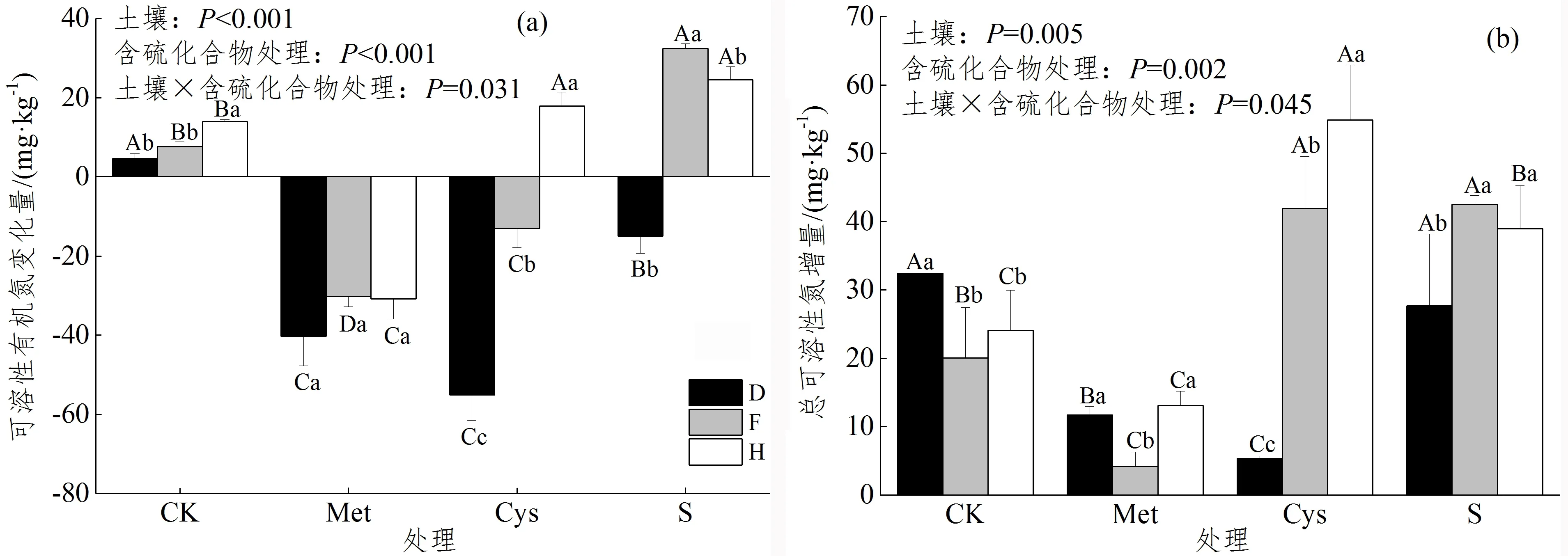
图 2 不同含硫化合物添加对土壤SON和TSN含量变化的影响Figure 2 Effects of different sulfur compounds on changes of soil SON and TSN
实验过程中,不同处理和土壤的TSN均有所增加(图2b)。与CK相比,Met处理的D、F和H土壤 TSN增量分别降低了63.9%、79.0%和45.8%,Cys处理的D土壤TSN增量显著低于CK 83.6%,但是F和H土壤显著升高108.9%和127.7%,S处理的F和H土壤显著高于CK 117.9%和61.6%。方差分析显示,土壤类型和含硫化合物处理及二者交互作用对土壤TSN含量变化均有显著影响(P<0.05)。
2.3 不同含硫化合物处理土壤氧化亚氮排放
如图3所示,3种土壤中N2O产生速率均在培养第5天最高,之后显著降低。培养第5天,在CK处理中,N2O产生速率在土壤D、F和H分别为215.71、201.96和95.34 μg·kg-1·h-1。Met和Cys处理在D土壤显著高出CK 1.4和1.5倍,在H土壤显著高出CK 1.8和2.2倍,在F土壤显著高出CK 1.9和3.9倍,D和H土壤中Met和Cys处理显著高出CK和S(P<0.05)。第10天,在CK处理中,N2O产生速率在土壤D、F和H分别仅为21.92、12.04和2.86 μg·kg-1·h-1。与CK相比,Met和Cys处理在F土壤分别高于CK 2.9和8.8倍,D土壤各处理差异不显著。而Cys和S处理在H土壤分别比CK显著降低76.9%和42.3%。第21天,在CK处理中,N2O产生速率在土壤D、F和H分别为56.07、12.96和18.56 μg·kg-1·h-1。Met和Cys处理在F土壤分别高出CK 0.4和4.9倍,Met处理在H土壤显著低于CK 65%(P<0.05)。方差分析显示,土壤类型和含硫化合物处理对土壤N2O产生速率均有极显著影响(P<0.001)。
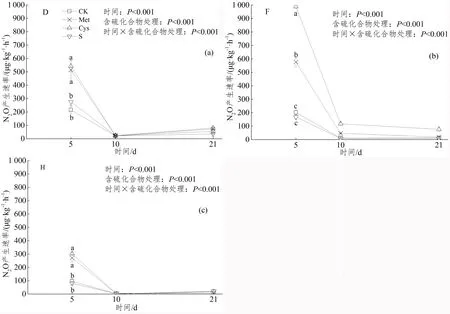
注:D,东北黑土;F,福建红壤;H,河南碱性土壤。图 3 不同含硫化合物添加对土壤N2O产生速率的影响Figure 3 Effects of different sulfur compounds addition on soil N2O production rate
2.4 不同土壤氮素的相关性分析
各土壤氮素之间显著的正相关性主要体现在与TSN的正相关(表2);在F和H中,NH4+-N含量与NO3--N含量呈显著的负相关,且F中NH4+-N含量与NO3--N含量的负相关性大于H中的,H中NH4+-N含量与SON含量呈正相关;在D中NO3--N含量与SON呈显著的负相关。
表 2 不同土壤氮形态之间的相关性分析Table 2 Correlation analysis between nitrogen forms in different soils

氮形态NH4+-NDFHNO3--N DFHSONDFHNO3--N-0.105-0.628∗∗-0.526∗∗SON-0.1790.1520.432∗-0.591∗∗-0.1140.062TSN0.647∗∗0.708∗∗-0.0540.132-0.1360.782∗∗0.2750.676∗∗0.636∗∗
3 讨论
3.1 含硫化合物对土壤硝化作用的影响
氨基酸容易矿化[3],因此,Met和Cys处理铵态氮增加,净氨化速率显著提高,这与添加氨基酸的相关研究一致[7,15,20]。裴广廷等[6]研究发现,Met抑制硝化,谷氨酸、赖氨酸和丙氨酸没有抑制硝化作用的效果。为探究是否与硫有关,本研究中选取含硫化合物作为氮添加处理,发现在D和F土壤中,Met和Cys处理净氨化速率显著提高,但净硝化速率在F土壤显著降低为负值,处理后的NH4+-N含量与 NO3--N含量呈显著负相关(表2),表明Met和Cys添加在一定程度上促进了氨氧化而抑制了硝化作用,尤其是F土壤。然而本研究发现,与CK相比,在H中则表现相反,净氨化速率显著降低为负值(负激发效应,即氮的固定),而净硝化速率显著提高,各处理净硝化速率变化不明显,说明Met和Cys对土壤硝化作用的影响因土壤类型不同而存在差异(图1b)。林伟等[7]发现Met添加使NH4+-N含量增加,而NO3--N含量显著降低,二者呈显著负相关,这与本研究结果一致,说明氨基酸在土壤中迅速发生矿化。本研究中添加氨基酸降低了土壤SON含量(图2a),而土壤D中SON与NO3--N含量呈显著的负相关性(表2),所以,氨基酸添加可能在一定程度上促进了土壤有机氮库向无机氮库转化。有研究认为中国北方土质偏碱性,南方偏酸性,氨含量北高南低,土壤中氨的挥发量随土壤pH的升高而增加[21],H土取样于河南,土壤pH值(pH=8.34)显著高于F,土质偏碱性,氨挥发量增多而导致土壤氮素损失,故H土壤净氨化速率降低,而pH较低的F土壤则抑制了硝化作用。还可能是氨基酸的增加,增加了一些异养微生物增值的直接能源,减少了这些异养微生物与硝化菌、亚硝化菌之间的竞争,从而促进硝化[22],使净硝化速率增加。
马芬等[20]也发现添加富含氮的氨基酸显著增加了土壤NH4+-N含量,与异养微生物通过吸收氨基酸分子增大活性有关[16],而对土壤NO3--N含量和 N2O 排放影响较小,说明氨基酸在短期内可提高土壤氮的有效性。通常认为土壤 pH 值高可增加土壤有机质的可溶性,为微生物活动提供了大量的碳、氮基质,从而促进土壤氮矿化[23],产生更多的铵态氮。Cys与Met一样是一种含硫的非必需氨基酸,具有很强的还原性[24]。Met和Cys之所以能抑制土壤硝化,是因为两者的分解产物都有CS2,而CS2会抑制土壤硝化作用[10]。也可能与土壤硫酸还原菌有关,它能显著促进Met和Cys的降解[9],故出现NH4+-N含量增加,NO3--N含量降低的情况。Saad等[25]发现向土壤中添加硫代硫酸盐会降低土壤NH4+-N氧化为NO3--N的速率,从而在一定程度上抑制了硝化反应。这与本研究添加Met和Cys后NO3--N含量下降的结果一致,其原因是Met也是一种含硫化合物,与硫代硫酸盐性质相似,对土壤硝化反应具有一定的抑制作用。
研究发现,外源硫输入会增加土壤氮的有效性[26],降低土壤中NO3--N的淋溶损失。例如Brown等[27]在草地酸性土壤中发现添加15.2 kg·S·hm-2·a-1可使高氮(450 kg·N·hm-2·a-1)处理土壤中NO3--N淋失减少58%~72%,低氮(200 kg·N·hm-2·a-1)处理中减少10%左右。含硫化合物显著增加土壤NH4+-N含量,且抑制了NH4+-N硝化,元素S抑制NH4+-N的硝化机理是硫在土壤中氧化为SO42-过程中形成的两种中间体S2O32-和S4O62-的作用[28]。Wang等[26]对半干旱区栗钙土的研究也发现添加氮显著提高了各粒级土壤团聚体有效硫的含量,说明氮和硫的有效性是相互促进的,二者的协同增效作用可能与有机质矿化有关,还可能因为二者都是蛋白质的主要组成成分[27]。因此,有机和无机硫对土壤硝化作用的影响不同,可能原因是有机硫化合物与无机硫化合物分解状态不同,有机硫化合物比无机硫更易分解,但也更易流失。
3.2 含硫化合物对土壤N2O的影响
N2O是硝化和反硝化作用的产物[29]。本研究中,在培养第5天,Met和Cys处理使各土壤N2O产生速率均高于CK,表明含硫氨基酸促进矿化和硝化。氨基酸在森林土壤中能迅速转化为NH4+-N和NO3--N基质,与可矿化氮存在正相关性[16],其矿化和硝化可能是N2O排放的主要来源之一,还有学者发现氨基亚砜甲硫氨基酸(MSX)能促进土壤净矿化作用,并对土壤的氮固持起抑制作用[30]。低土壤 pH可能通过NO2--N的化学反硝化作用抑制N2O还原酶活性,进而提高硝化速率和N2O产生量[31]。由于F土壤净硝化作用为负值,这些结果表明,可能在F土壤并不是不产生NO3--N而是被保持了,且D土壤保持低于F土壤。有机硫促进了N2O的释放,可能是异养硝化细菌经羟胺氧化酶(HAO)的催化作用,将羟氨转化为亚硝酸盐和少量的N2O[32];也可能是因为Met经微生物分解后产生大量的乙烯(C2H4),C2H4的形成需要消耗O2使土壤形成厌氧环境,更利于土壤N2O的释放量[33]。此外,无机硫处理第5天 N2O产生速率与CK差异不明显,但显著低于有机硫,表明无机硫对N2O产生速率的影响不明显。土壤酸化还加速 SO42-和 NO3--N向下层土壤迁移,导致土壤无机碳分解和交换性阳离子流失[17]。也有人在草地生态系统土壤硫平衡和有机碳库监测的长期(50年)试验中发现,硫含量增加阶段,土壤矿化减少,利于有机碳的积累;有机碳含量低,土壤硫含量也相对较少[34],说明土壤有效碳的多少可能决定无机硫对N2O产生速率的影响程度。
在培养第10和21天,各处理中N2O产生速率均低于培养之初(第5天),原因是随着有效碳的消耗,土壤 N2O 释放量减少。Dobbie & Smith[35]也发现高N2O通量通常主要发生在施用矿物氮肥后相对短暂的时期。随着外源氮的累积,硝化细菌和反硝化细菌氮的可利用性增加,土壤中氮的限制作用被缓解,土壤硝化和反硝化作用增强,土壤N2O的排放量急剧增加。这与本研究结果一致。由于D和F中碳氮含量远高于H(表1),N2O产生速率也明显多于H,表明在C基质充足条件下,异养硝化细菌可利用NO3--N生成大量的N2O。
4 结论
含硫氨基酸(甲硫氨酸和半胱氨酸)添加促进酸性土壤氨化、抑制硝化作用,但对碱性土壤影响相反。有机硫和无机硫对土壤氮影响不同,在有机硫化合物处理中,净氨化速率和净硝化速率分别与土壤pH值呈负相关正相关。然而在无机硫化合物处理中,净氨化速率与土壤pH值呈正相关,对净硝化速率没有影响。有机含硫化合物促进了N2O的释放,无机含硫化合物对N2O产生速率的影响不明显。由于N2O是硝化作用的产物,因此,福建红壤(F)土壤硝态氮降低可能与硝态氮保持有关,并不是限制了硝化。

