黄喉拟水龟对冬眠期间急性高温胁迫的氧化应激响应
陈 威,胡小瑜,蒋柳阳,瞿潇月,朱菁华,徐志旺,李树然,张永普
温州大学生命与环境科学学院, 温州 325035
由于生理体温调节机制较弱,外温动物体温受环境温度影响较大,其生理和行为更易受环境温度制约[1- 3]。对于外温动物而言,冬眠期间是其较为脆弱的时期,此时很难通过行为体温调节迅速响应温度的变化,外界气温的变化将直接影响其生理生化状态[4]。作为外温动物的代表类群,爬行动物是受未来气候变暖威胁最为严峻的类群之一[5- 6]。随着气候变暖的加剧,冬季温度升高,甚至极端高温出现的情形增多[7],爬行动物冬眠期间受到急性温度胁迫的可能性大大增加,探讨冬季温度波动对爬行动物的影响,不仅是今后研究气候变暖对生物影响的新热点领域,也能够为爬行动物保护提供前瞻性和预防性对策[8]。
已有研究表明,剧烈的温度变化,如急性冷暴露或者高温胁迫,会刺激外温动物机体内活性氧增多,导致脂质过氧化物,如丙二醛(MDA)的含量增加,并加剧细胞膜的损伤[9- 11];而外温动物机体的抗氧化防御系统,如抗氧化酶系统,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)等,则可以清除机体多余活性氧,以抵御其对机体的损伤[12- 13]。然而,目前有关冬眠期间的高温胁迫对外温动物的氧化应激以及抗氧化系统影响的研究仅见于一些两栖类和鱼类,对爬行类的研究则极为匮乏[14- 15]。
黄喉拟水龟(Mauremysmutica)是典型的具有冬眠特征的爬行动物,在我国主要分布于浙江、江苏、安徽、广西、广东、海南、福建、台湾等地。由于黄喉拟水龟的这种跨纬度远距离分布,其冬眠期间的环境温度也存在明显的纬度变异。因此,黄喉拟水龟是研究爬行动物冬眠期间受环境温度调控氧化应激和抗氧化防御动态平衡的理想系统。本实验以浙江(代表高纬度的北方种群)和广西(代表低纬度的南方种群)两个种群的黄喉拟水龟幼体为研究对象,通过比较南北两个种群在冬眠期间急性高温刺激下的氧化应激反应以及抗氧化酶系统的响应,揭示不同种群的黄喉拟水龟幼体对极端温度变化的生理适应策略与生化基础,不仅为该物种的保护和养殖提供一定的参考,同时对预测其受气候变暖的影响提供理论依据。
1 材料与方法
1.1 实验动物
实验动物为2017年孵出的一龄黄喉拟水龟幼龟,分别购于浙江海宁(30°19′N,120°25′E)和广西桂平(23°60′N,110°12′E)的养殖场,南北种群各40只。所购黄喉拟水龟幼体均为当地物种来源,具有纯净的遗传背景和本地适应特征[16]。
1.2 实验过程
冬眠前,将黄喉拟水龟南北种群幼龟置于塑料养殖槽(长 × 宽 × 高=45 cm × 27 cm × 25 cm)中,每个槽内随机分配南种和北种幼龟各5只,槽内盛5 cm深的水,每天上午10时投喂足量的龟粮,饲养温度与室温相同,光周期为自然光周期,每日下午用脱氯自来水换水。
当饲养室环境温度降至12℃时,将幼龟连同塑料养殖槽转移至BINDER培养箱中(KB400,BINDER GmbH,Tuttlingen),温度设置从12℃开始,每24 h降低1℃,7 d后降至6℃,人工诱导其进入冬眠并在6℃中冬眠1个月。随后,每个种群随机选取8只幼龟取样(对照0 h组);然后将各种群剩余幼龟置于25℃培养箱中,在经历高温处理2 h(高温2 h组)和12 h(高温12 h组)时各取样一次,剩余个体放回6℃培养箱中,恢复24 h后再次取样(恢复24 h组)。南北种群各组取样样本均为8只。
取样时采用断头法迅速处死幼龟,在冰盘上迅速分离心脏、脑、肌肉和肝脏组织,液氮冷冻,然后置于超低温冰箱(CryoCube F570,Eppendorf,Hamburg)-80℃下保存备用。
1.3 MDA含量及SOD、CAT、GSH-Px活力的测定
测定前,将组织块按重量(g): 体积(mL)=1∶9的比例加入0.85%的冷生理盐水于匀浆管中,冰水浴环境下尽快剪碎组织块,用组织匀浆机进行快速研磨,制成10%的组织匀浆液。将制备好的匀浆液用低温离心机(5810R,Eppendorf,Hamburg)以3000 r/min离心15 min,取上清液进行测定。
采用南京建成生物工程研究所生产的丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒和谷胱甘肽过氧化物酶(GSH-Px)试剂盒测定各组织中MDA含量、SOD 活力,以及肝脏CAT 活力和GSH-Px活力(脑、心脏和肌肉的组织量在测定MDA含量和SOD 活力之后已不足以测定CAT和GSH-Px),具体操作按照说明书的要求进行。由于幼龟心脏重量较轻,各种群每个处理随机取两个个体的心脏合并测定MDA含量和SOD活力。
1.4 数据处理
用Statisitca 6.0统计软件包分析数据。用Kolmogorov-Smirnov检验与Bartlett′s检验分别检验数据的正态性与方差均质性。MDA含量、SOD活力、CAT活力和GSH-Px活力采用双因子方差分析(Two-way ANOVA),多重比较均采用LSD检验。描述性统计值用平均值±标准误表示,显著性水平设置为α=0.05。
2 结果
2.1 MDA含量
冬眠期间急性高温胁迫对黄喉拟水龟两个种群幼龟心脏MDA含量均无显著影响;南种大脑MDA含量在高温处理2 h较初始对照显著降低(P<0.05),北种则不受温度处理影响(P> 0.05);南种群肌肉MDA含量未受温度处理影响(P> 0.05),而北种群肌肉MDA含量则在高温处理12 h达到最高(P<0.05),恢复24 h后降至初始对照水平;南种群肝脏MDA含量随处理时间增加逐渐升高,在恢复24 h达到最高(P<0.05),北种群肝脏MDA含量则不受温度处理影响(P> 0.05)。总体上,南北种群心脏、大脑、肌肉等组织MDA含量无显著种群差异(P> 0.05),南种群幼龟肝脏MDA含量显著高于北种(P<0.05)(图1)。

图1 冬眠期间高温处理对黄喉拟水龟幼龟南北种群各组织MDA含量的影响Fig.1 Effect of heat stress during hibernation on MDA content in different tissues of the southern and northern populations of Mauremys mutica不同大写字母代表黄喉拟水龟南种群各处理间差异显著,不同小写字母代表北种群各处理间差异显著,星号代表同一处理南北种群间存在差异
2.2 SOD活力
冬眠期间高温刺激仅对北种群大脑SOD活力产生显著影响,北种群大脑SOD活力在高温处理2 h和12 h显著高于高温处理后恢复24 h(P< 0.05);其余组织中SOD活力均不受温度处理的影响(所有的P> 0.05)。南北种群各组织中SOD活力均不存在显著的种群间差异(所有的P> 0.05)(图2)。
2.3 CAT活力
南种群的肝脏CAT活力在高温处理2 h显著高于高温处理12 h以及恢复24 h组(P< 0.05),北种群不受温度处理影响(P> 0.05);同时,南种群各处理组CAT活力均高于北种群(P< 0.05)(图3)。
2.4 GSH-Px活力
南种群肝脏GSH-Px活力不受温度处理影响(P> 0.05),而北种群肝脏GSH-Px活力在高温处理12 h达到最高(P< 0.05),且高于南种群各处理组(P< 0.05)(图3)。
3 讨论
3.1 急性高温胁迫对冬眠黄喉拟水龟脂质过氧化作用的影响
冬眠期间的高温胁迫能够促使外温动物代谢水平迅速增加,产生过量的活性氧,造成氧化应激损伤[17]。本研究发现,黄喉拟水龟幼体冬眠期间经历急性高温刺激后,肌肉和肝脏MDA含量升高。类似的,高温胁迫亦会引起其他外温动物,如中华绒螯蟹(Eriocheirsinensis),组织MDA水平的升高[18]。此外,不同种群的黄喉拟水龟对冬眠期间急性高温刺激的反应存在明显差异:北种群在经历12 h的高温刺激后,肌肉MDA含量达到最高,但在放回6℃冬眠条件24 h后又恢复至对照水平,肝脏MDA含量则不受高温刺激的影响;南种群幼龟肌肉MDA含量未受高温刺激的影响,但肝脏MDA含量则随高温刺激时间的增长而逐渐升高,甚至在放回6℃冬眠条件恢复24 h后仍在升高,并且南种群肝脏MDA含量高于北种。这表明虽然冬眠期间的急性高温可能会对黄喉拟水龟南北种群均产生一定的脂质损伤,但黄喉拟水龟北种群机体能够更快地降低细胞膜上的脂质过氧化反应,以减少细胞膜损伤,而南种群则可能受冬眠期间高温胁迫的脂质损伤更大。这可能是由于低纬度生存的外温动物由于栖息地环境温度波动较小,导致其代谢率等生理功能的温度敏感性更高,而高温度栖息的外温动物由于栖息地环境温度波动较大而生理功能对温度的敏感性较低导致[19]。
3.2 急性高温胁迫对冬眠黄喉拟水龟抗氧化酶活性的影响
急性温度胁迫下,外温动物机体活性氧增加,而抗氧化防御系统成分的活性或含量改变,如SOD、CAT、GSH-Px等抗氧化酶活力升高,清除活性氧以缓解氧化应激对机体的损伤[20-21]。在本研究中,面对冬眠期间的高温胁迫,黄喉拟水龟两种群幼龟SOD活力在心脏、大脑、肝脏、肌肉等器官中均表现出一定地上升趋势,但并未达到显著水平。这暗示了SOD活力对于黄喉拟水龟应对冬眠期间的急性高温胁迫作用有限。类似的,高温胁迫冬眠的金鱼(Carassiusauratus)各组织SOD活力均无显著影响[15]。相反的,冬眠的湖蛙(Ranaridibunda)在受到急性高温刺激后,肝脏和肌肉SOD活力升高超过2倍[14]。
肝脏的抗氧化防御系统高度发达,对于冬眠期间的外温动物,肝脏抗氧化酶在清除氧化应激产物方面有重要作用[14,22]。冬眠期间的黄喉拟水龟幼龟在受急性高温刺激后,虽然肝脏SOD活力升高不明显,但CAT活力和GSH-Px活力显著上升,这表明CAT与GSH-Px可能是冬眠期间黄喉拟水龟幼龟应对温度剧烈波动造成的氧化应激的关键酶。同时本研究发现,这两种酶活力对高温刺激的响应在黄喉拟水龟南北种群中表现各异:南种群肝脏中CAT的活力在高温刺激2 h后迅速上升,随后逐渐降低,同时各组间南种群CAT活力均高于北种群,而肝脏GSH-Px活力对高温刺激不敏感;相反的,北种群肝脏CAT活力并未受冬眠期间高温刺激的影响,而北种群幼龟肝脏GSH-Px活力随高温刺激时间延长而上升,在高温刺激12 h 达到最高。这表明冬眠期间黄喉拟水龟南种群可能始终面临较北种群更高的氧化应激水平,而机体通过维持较高的CAT活性以应对这种威胁,这可能是南种群为应对其易受环境变化的影响以及由此带来的氧化应激对机体的损害,而形成的自我保护措施[23];而黄喉拟水龟北种群在面对急性高温胁迫时,肝脏中GSH-Px可能起着主导作用。
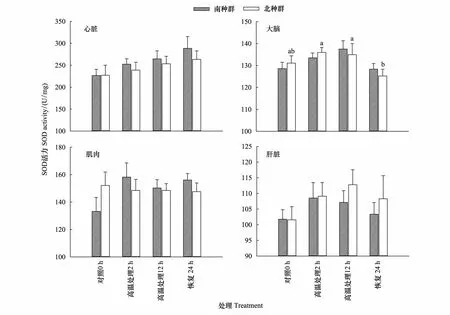
图2 冬眠期间高温处理对黄喉拟水龟幼龟南北种群各组织SOD活力的影响Fig.2 Effect of heat stress during hibernation on the SOD activity in different tissues of the southern and northern populations of Mauremys mutica不同小写字母代表北种群各处理间差异显著
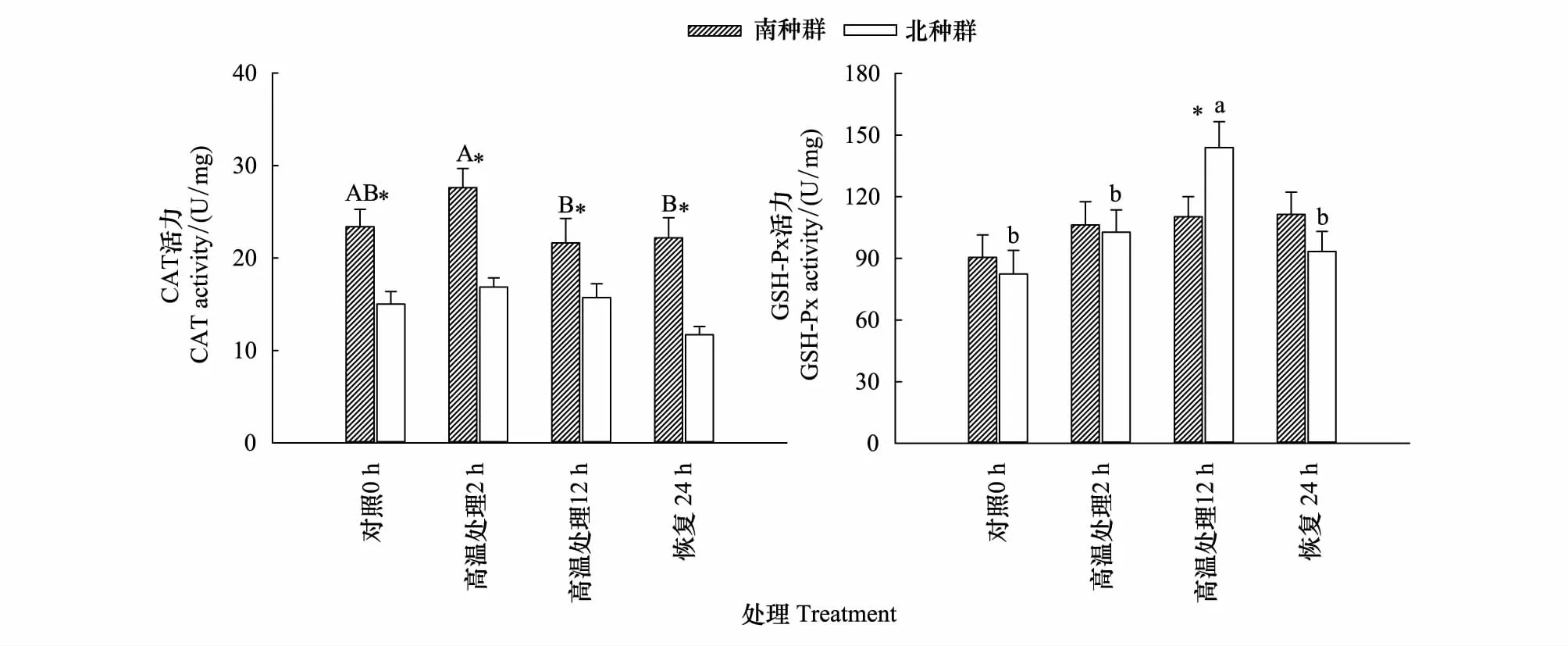
图3 冬眠期间高温处理对黄喉拟水龟幼龟南北种群肝脏CAT活力和GSH-Px活力的影响Fig.3 Effect of heat stress during hibernation on the CAT and GSH-Px activity in livers of the southern and northern populations of Mauremys mutica不同大写字母代表黄喉拟水龟南种群各处理间差异显著,不同小写字母代表北种群各处理间差异显著,星号代表同一处理南北种群间存在差异
综上,冬眠期间急性高温胁迫对黄喉拟水龟幼龟产生了一定程度的氧化损伤,而黄喉拟水龟可在短时间内通过增强抗氧化酶(CAT与GSH-Px)活力来清除体内由于氧化应激产生的活性氧,以减轻机体的氧化损伤。同时,面对冬眠期间急性高温胁迫,南北种群的氧化应激损伤以及抗氧化能力均表现出了一定的地理变异,南方种群可能更易受到冬眠期间温度波动的影响,但机体具有更强的抗氧化酶(CAT)活力以应对高温胁迫的威胁。因此,我们的研究表明外温动物响应冬眠期间温度变化的生理策略存在显著的种群间差异,并且提示了我们在研究氧化应激和抗氧化平衡时,应注重种群来源以及其栖息地温度环境特征的重要性。同时,对于黄喉拟水龟的保护,应当针对不同种群氧化应激反应的差异采取不同的措施。

