干旱区不同地理种群骆驼刺元素组成及表面结构特征的对比研究
尹 辉,张 波,荆瑞雪,曾凡江,*,牟书勇
1 中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室, 乌鲁木齐 830011 2 新疆大学,乌鲁木齐 830046 3 中国科学院大学,北京 100049 4 新疆策勒荒漠草地生态系统国家野外科学观测研究站,策勒 848300 5 中国科学院干旱区生物地理与生物资源重点实验室,乌鲁木齐 830011
碳(C)、氮(N)、磷(P)元素是构成一切生命的主要元素,三者的含量变化及其比值控制着植物的营养和生长状况[1]。植物体中的C几乎全部来源于大气中的CO2,它是连接外界无机环境与有机体的最重要环节,是一切有机体的基本骨架。N和P元素是植物体中最重要的调节物质,是组成蛋白质和核酸的基本元素,也常常是环境中的限制因素[2- 3]。叶、茎、根之间的营养分配模式反映了植物获取,运输和储存营养物质的能力。例如木本植物中,储存蛋白质占总可溶性蛋白质的25%—30%,并且这些蛋白质主要存储在茎和根中[4]。这些储存的营养物质在干旱条件下对维持植物营养吸收、二氧化碳同化、支持叶片生长方面起着重要作用[5]。植物各器官由于养分储存及功能差异,导致同一植物不同器官间(叶、茎、根和生殖器官)的N、P含量存在显著差异,但不同器官间的N、P浓度变化密切相关[6]。韩文轩等[7]通过测定北京及周边地区358种植物的C、N、P含量发现,叶片中C、N、P含量分别是叶柄中相应元素含量的1.1、2.4和1.8倍,认为叶片的高营养(N和P)含量与其活跃的同化功能有关。植物体表面是与环境接触最密切的部位,也是最敏感部位,表面形貌变化也可作为植物对环境适应性的又一衡量指标[8- 9]。因此,研究植物体中C,N,P元素分配特征及表面形貌变化对于揭示植物的生态适应性和养分利用特征有重要意义。荒漠植物骆驼刺(AlhagisparsifoliaShap.)是豆科多年生草本植物[10],单叶,全缘。枝上具有大量针刺,刺对骆驼刺适应荒漠环境起到至关重要的作用,因而本研究中将其作为单独的器官处理。
同一种植物,在异质环境中生存,经过长期的适应和进化,会在形态结构、元素组成及生理功能上产生变化,形成特殊的地理种群[11]。骆驼刺分布于我国内陆干旱地区的新疆、甘肃、内蒙古、宁夏。新疆全疆均有分布,尤以南疆塔克拉玛干沙漠周围,吐鄯托盆地及北疆古尔班通古特沙漠南部扇缘最多[12]。本研究选取干旱区3个典型的骆驼刺分布区为研究对象:塔里木盆地策勒种群,吐鄯托盆地托克逊种群,及准噶尔盆地阜康种群。研究各器官C,N,P元素组成及表面形貌变异,从而揭示骆驼刺在不同环境中的适应能力,此研究对骆驼刺的保护和开发具有重要意义。
1 材料与方法
1.1 研究区概况
策勒骆驼刺种群采自中国科学院策勒荒漠草地生态系统国家野外科学观测研究站(表1),策勒属典型的内陆极端干旱荒漠气候,日照资源丰富。年降水量35.1 mm,风沙活动频繁,多年平均沙尘天数25.9 d,最多年达59 d。采样地地表沙质非常细腻,所有植物表面均覆盖一层细沙土。骆驼刺在该群落属于优势建群种,相对多度>70%,伴生有沙拐枣,盐生草和花花柴等植物。
托克逊骆驼刺种群采自吐鲁番地区托克逊县(表1),属暖温带极端干旱荒漠气候,夏季气候炎热,年平均降水量仅9.4 mm,是全国降水最少的地方。托克逊多风,平均大风天数84 d,遇到大风天气极易将地表的尘土扬起,因而采样点地表主要是颗粒1 mm左右的沙砾。采样地骆驼刺为该群落的建群种,相对多度>80%,伴生有刺山柑。
阜康骆驼刺种群采自阜康市222团附近(表1),属温带大陆性干旱气候,年平均降水164 mm,冬季有约20 cm厚的积雪,因而比策勒和托克逊湿润。阜康风小,且土壤较湿润,因而少见扬沙天气。此处骆驼刺与梭梭,沙蓬,琵琶柴等植物混生,形成多样性较高的群落。骆驼刺相对多度<30%。

表1 3个采样点的自然条件
GC: geographic coordinate; MAP: mean annual precipitation; MAE: mean annual evaporation; MAT: mean annual temperature; HT: highest temperature; A: accumulated temperature
1.2 样品采集和指标测定
试验于2017年8月实施,在策勒、托克逊和阜康3个骆驼刺自然种群中,各随机选择三株骆驼刺,将整个地上部分带回实验室,叶、茎、刺分开,装入牛皮纸袋,80℃烘干至恒重。粉碎,过100目筛,用于检测C,N,P元素含量。C含量用总有机碳分析仪(OI 1030)测定,N含量用FOSS全自动定氮仪测定,P含量用钼锑抗比色法测定。
每个区域选取一株有代表性的植株,将成熟的叶,茎,刺,剪成5 mm×5 mm左右的小块,快速投入FAA固定液中(FAA固定液配方:38%的甲醛5 mL,冰醋酸5 mL,75%酒精90 mL,丙三醇1 mL),带回实验室。样品经乙醇梯度脱水,叔丁醇置换,冷冻干燥处理后,用扫描电子显微镜(ZEISS SUPRA55VP)观测表面结构。
用土钻分别采集0—20 cm,20—40 cm,40—60 cm,60—80 cm土层的土壤样品,装入自封袋带回实验室。土样经风干后,过100目筛,全N和速效N含量用FOSS全自动定氮仪测定,全P和速效P含量用钼锑抗比色法测定。
1.3 数据分析
用Excel和SPSS17.0软件进行数据处理和统计分析,采用One-Way ANOVA方法进行方差分析,选择LSD(P=0.05)方法进行显著性检验和多重比较。扫描电镜图片用Photoshop CS5和Illustrator CS5软件剪切和拼接。
2 结果与讨论
2.1 营养元素在3个地理种群骆驼刺叶,茎,刺中的分配特征
C,N,P元素是植物生长必需的营养元素。植物体通过光合作用固定C元素,并将其分配到各个器官中。叶片是骆驼刺最主要的光合作用器官;刺也具有气孔和叶绿体,是重要的同化和输导组织,很多研究者将刺描述为同化枝[13]。C含量在3个地理种群骆驼刺叶,茎,刺中的分配没有显著规律。3个地理种群相同器官相比,叶片中C含量存在显著差异,策勒种群叶片C含量最高((404.0±8.25) mg/g),阜康种群叶片次之((377.9±1.75) mg/g),托克逊种群叶片C含量最少((351.7±0.4) mg/g)(表2)。阜康种群茎中C含量显著高于策勒种群和托克逊种群,而3个种群刺中C含量差异不显著(图1)。

图1 不同地理种群骆驼刺不同器官C,N,P含量的比较Fig.1 Comparison of C, N, P content among different organs of A. sparsifolia in different geographical populationsn=3,不同大写字母表示同一地点不同器官之间差异显著(P<0.05);不同小写字母代表相同器官不同地点之间差异显著(P<0.05)
N是核酸和蛋白质的重要组成成分,是构成生命的重要物质基础。植物中75%的N可以从叶绿体中提取出来,而其中30%—50%在Rubisco(核酮糖- 1,5-二磷酸羧化酶/加氧酶)中,参与光合作用[14- 15]。Olde等的研究也表明,在一定范围内,叶片含氮量、叶绿素含量、Rubisco含量分别与光合速率呈正相关[16]。3个地理种群的骆驼刺的N含量均以叶片最高(策勒种群:15.6±3.2 mg/g,托克逊种群:10.5±1.3 mg/g,阜康种群:12.1±0.1 mg/g)(表2),茎中最低(策勒种群:6.2±1.0 mg/g,托克逊种群:5.1±0.4 mg/g,阜康种群:6.4±0.5 mg/g)。策勒种群刺中的N含量(9.3±0.6 mg/g)与茎中N含量没有显著差异,而明显小于叶(图1)。推测此时期策勒种群刺的光合作用能力与茎中较为接近。托克逊刺中的N含量(8.2±0.5 mg/g)介于叶与茎之间,说明此时期刺的光合作用强度介于叶和茎之间。阜康种群刺中的N含量与叶差不多,而显著高于茎,推测此时期阜康种群的刺与叶的功能更接近。不同地理种群的叶N含量相比,策勒种群最大,托克逊种群最小,阜康种群介于二者之间。由于叶C含量也呈现出相同的变化规律,策勒种群最高,托克逊种群最低(图1)。因此推测,策勒种群叶片光合作用能力最强,托克逊种群光合作用能力最差。刺中N含量阜康种群>策勒种群>托克逊种群,阜康种群刺N含量与叶N含量相当,因而推测阜康种群刺的光合作用能力较强。3个地区茎中N含量没有显著差别。
生长速率理论认为,在植株快速生长部位具有较高的P含量,因为快速生长部位需要大量的核糖体来合成蛋白质,而核糖体是含磷量最高的细胞器(P约占5%)[17]。策勒种群和阜康种群的骆驼刺均以叶片中P含量最高(策勒种群:1.2±0.0 mg/g,阜康种群:0.9±0.2 mg/g),茎与刺中含量相当。但是托克逊骆驼刺的茎中P含量显著高于其他部位,也高于其他地理种群茎中含量。托克逊种群茎中P含量1.7±0.2 mg/g,约为策勒种群和阜康种群茎中P含量的2倍(策勒种群:0.8±0.1 mg/g,阜康种群:0.7±0.0 mg/g)。3个地理种群叶片中P含量没有显著差异。采样期托克逊骆驼刺处于结实期,茎秆不是快速生长部位,那么如此高的P含量应是存储的无机P元素。据报道,植物体中无机P含量与生存环境密切相关[18- 19]。因此对3个采样区域0—80 cm土层土壤的全N,速效N,全P,速效P含量进行检测,从图2可看出,每个区域4个土层间差异不显著,但3个区域之间的差异较大。速效P,全N,速效N含量均为托克逊最多(图2),策勒和阜康差异不大。且采样过程中发现,托克逊地区80 cm以上的土层中,骆驼刺毛细根非常密集。因此推测托克逊种群茎中大量的P元素积累可能与土壤中高浓度的养分含量有直接关系。耿燕等的研究指出,当叶片磷元素含量足够且稳定时,外界磷的供应量不会影响植物的光合速率。而当外界环境磷元素供给量降到一定程度时,才会成为植物生长的限制因子[20]。3个地理种群叶片中P含量差异不大,说明托克逊的骆驼刺将多余的P储存于茎中,叶片仍旧保持比较稳定的N∶P比。
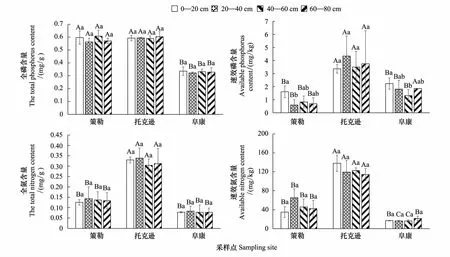
图2 不同地理种群不同深度的土壤样品全N,速效N,全P,速效P含量Fig.2 The total nitrogen, available nitrogen, the total phosphorus and available phosphorus contents of soil at different depths in different geographical populationsn=3,不同大写字母表示相同土层不同地点之间差异显著(P<0.05);不同小写字母代表不同土层同一地点之间差异显著(P<0.05)
叶片作为最重要的光合器官,其C∶N,C∶P比值往往代表植物养分利用效率,而N∶P值与土壤养分状况直接相关。贺金生等对中国草原在3个不同地区(内蒙古、青藏高原和新疆)C∶N化学计量比的研究中发现草原植被有着极为稳定的C∶N值,并认为C∶N化学计量比与物种组成以及气候变化无关[21]。本研究中3个地理种群的骆驼刺叶片C∶N,C∶P,N∶P值均无显著差异(表2),3个地理种群骆驼刺叶片中C∶N,C∶P,N∶P均值为30.6±4.3,357.4±49.9,12.0±2.4。说明虽然营养元素含量、干旱程度和温度等环境因子存在显著差异,但骆驼刺具有较高的内稳性,这也可能是它能在全疆范围普遍生存的重要原因。

表2 不同地理种群骆驼刺叶片C,N,P,C∶N,C∶P,N∶P含量差异
n=3,同列不同字母表示差异极显著(P<0.05)
2.2 3个地理种群骆驼刺叶,茎,刺表面结构特征
蜡质是覆盖在植物表面的一层防水保护层,与表皮层一起,有效防止植物体内水分的非气孔性散失,同时可以降低紫外线伤害[22]。蜡质一般分成外蜡质层和内蜡质层(蜡质晶体下面的薄层)[23]。图3C和3F显示阜康种群叶片蜡质层,内外蜡质层清晰可见。外蜡质层呈片状直立于内蜡质层上,排列规则;内蜡质层较薄,但是致密,与表皮结合的不是非常紧密。策勒种群骆驼刺叶表皮明显增厚((1.42±0.07) μm)(图3D),约为阜康种群表皮的2倍((0.75±0.02) μm)(图3F)。策勒种群骆驼刺表皮蜡质较致密,没有明显的内外蜡质层之分,从图3A可看出,策勒种群表皮蜡质也有垂直于表面的片层结构,但由于策勒夏季干旱高温,且多风沙,片层的蜡质可能融化而粘附大量沙粒,扫描电镜制样过程中梯度酒精10次的冲洗仍不能洗脱。托克逊种群骆驼刺叶的上表皮异常增厚,与蜡质结合得相当紧密(图3E),且表面蜡质非常致密(图3B)。以上结果表明,随着外界干旱程度的加剧及年积温的增加,阜康,策勒,托克逊种群叶的上表皮逐渐增厚,蜡质越来越致密,主要用于防止水分蒸发及减少热损伤。

图3 不同地理种群骆驼刺叶表面扫描电镜图片Fig.3 Surface structure in leaves of A. sparsifolia in different geographical populationsA,B,C分别为策勒,托克逊,阜康骆驼刺叶上表面2500倍照片;D,E,F分别为策勒,托克逊,阜康叶上表皮纵切面10000倍照片,图中标示表皮厚度;G,H,I分别为策勒,托克逊,阜康叶下表面500倍照片
气孔是植物水分代谢和光合作用中气体交换的重要通道。气孔密度受到多种因素调控,杨利民等对我国东北样带羊草的水分利用效率及气孔密度的研究指出,东北样带自东向西,随年降水量、年均温、土壤水分的降低和海拔的升高,羊草水分利用效率和气孔密度有明显增大的趋势,说明水分条件是气孔密度变化最重要的生态因子[24]。但温度、CO2浓度等条件亦是气孔密度变化的重要因素。杨惠敏等的研究指出,在其他条件一致的情况下,温度升高会使小麦气孔密度降低[25]。本研究中,不同地理种群的骆驼刺各器官的气孔密度存在极大差异。骆驼刺叶片两面均有气孔,下表皮气孔数量比上表皮略多。不同地理种群的相同器官相比,托克逊种群叶正面、叶背面、茎、刺中的气孔密度均最大(分别为(298.5±9.6)个/mm2,(328.7±6.3)个/mm2,(161.4±6.8)个/mm2,(226.6±8.9)个/mm2)(图4)。且托克逊种群表皮蜡质非常厚,正面气孔多被蜡质覆盖,表现出明显的干旱适应特征。策勒种群叶片正面和背面气孔密度分别为(117.0±12.8)个/mm2,(298.5±9.6)个/mm2,明显小于阜康种群(叶正面和叶背面分别为:(184.8±11.1)个/mm2和(266.5±15.1)个/mm2)(图4),策勒种群刺与茎的气孔密度与阜康种群差异均不显著。说明,虽然策勒比阜康干旱程度高得多,但策勒种群骆驼刺没有表现出明显的干旱胁迫特征,且策勒种群在该群落中属于优势种,说明策勒种群更加适应当地环境。策勒种群骆驼刺根系发达,能够利用地下水维持生存与生长[26- 27]。罗维成的研究也指出策勒绿洲的骆驼刺,整个生长季没有表现出水分胁迫的现象[28]。

图4 3个地理种群骆驼刺叶,茎,刺气孔密度差异 Fig.4 The different stomatal density of leaves, stems, and thorns in different geographical populationsn=5,不同大写字母代表相同器官不同地点之间差异显著(P<0.05)
3 结论
3个地理种群骆驼刺在长期适应环境过程中,各器官元素组成和表面结构发生显著变化。
(1)策勒种群叶片C、N含量均最高,托克逊种群最低,阜康种群介于二者之间,推测策勒种群叶片光合作用能力最强,而托克逊种群最弱。
(2)3个地理种群相比,刺N含量阜康种群>策勒种群>托克逊种群。策勒种群刺N含量与茎中相似,远低于叶片,而阜康种群刺N含量与叶差异不大,显著高于茎,托克逊种群刺N含量介于叶与茎之间。N含量与植物光合作用能力呈显著正相关关系,因此推测策勒种群刺同化作用能力与茎差不多,而阜康种群刺同化作用能力更接近于叶片,3个地理种群相比,阜康种群刺的同化作用最强。
(3)策勒种群和阜康种群各器官P含量差异不大,但托克逊种群茎中P含量异常高,不仅高于其他种群茎的含量,同时也高于自身叶和刺。因此对3个区域0—80 cm深度土壤的全N,速效N,全P,速效P含量进行检测,结果表明托克逊全N,速效N,速效P含量均比策勒和阜康高得多。从而推测外界环境中高的养分含量使得骆驼刺吸收较高的P,并积累于茎中。3个地理种群叶片C∶N,C∶P,N∶P均未受到外界环境的影响,平均值为C∶N=30.6±4.3,C∶P=357.4±49.9,N∶P=12.0±2.4,说明骆驼刺能够保持较高的内稳态,这也可能是它能在新疆广泛分布的重要原因。
(4)本研究中,只有极端干旱的托克逊种群表现出明显的干旱适应特征:表皮和蜡质极厚,蜡质非常致密;各个器官气孔密度显著大于其他两个地区。相对干旱的策勒种群比相对湿润的阜康种群叶表皮增厚,蜡质致密,但气孔密度却小得多,说明策勒种群未受到明显的干旱胁迫,因为其根系能够以地下水为主要水源。且策勒种群在该群落中是优势种,说明骆驼刺更加适应策勒的环境条件。
通过对骆驼刺叶、茎、刺元素组成和表面结构分析,能够确定骆驼刺与当地环境的适应程度,因而为骆驼刺的保护与开发提供重要的理论支持。
致谢:Alzhan Kurmangozhinov博士在野外采样过程中给予帮助,新疆资源环境科学大型仪器区域中心、新疆生态与地理研究所中心实验室对实验给予帮助,特此致谢。

