固相萃取-液相色谱法测定婴幼儿配方乳粉中的游离核苷酸
尹丽丽, 李 珊, 周传静, 程 志, 郑 红, 刘艳明
(山东省食品药品检验研究院, 山东 济南 250101)
核苷酸是由含氮的碱基、环状核糖或脱氧核糖、磷酸3种分子连接而成,碱基与糖通过糖苷键连接成核苷,核苷与磷酸以酯键连接,组成核苷酸。目前,婴幼儿配方乳粉中添加的核苷酸的形式主要有5种:胞嘧啶核苷酸(CMP)、尿嘧啶核苷酸(UMP)、腺嘌呤核苷酸(AMP)、鸟嘌呤核苷酸(GMP)和次黄嘌呤核苷酸(IMP)。核苷酸是婴儿生长发育必需的营养素,特别是在新生儿维持机体免疫系统功能、促进肠道成熟、肝脏的生长发育和代谢、脂质代谢等方面发挥重要作用[1-3]。当内源性核苷酸不能满足人体需要时,补充外源性核苷酸非常必要[4,5]。由于牛乳、羊乳中核苷酸质量浓度和人乳中差距较大,所以部分代乳品中逐渐添加核苷酸以达到与人乳更加接近的目的。我国国家标准GB 14880-2012食品营养强化剂使用标准中规定了核苷酸在婴幼儿配方食品中的添加量为0.12~0.58 g/kg(以核苷酸总量计)。由于羊奶中含有200多种营养物质和生物活性因子[6],营养价值高,比牛奶更容易消化吸收,所以越来越受欢迎,但也为检测带来了挑战。
目前,婴幼儿乳粉中核苷酸检测的仪器方法主要有毛细管电泳法[7]、离子色谱法[8]、液相色谱-串联质谱法[9-12]、液相色谱法[13-23]。毛细管电泳法灵敏度低、重现性差;离子色谱法易受其他寡核苷酸的干扰。液相色谱-串联质谱虽然灵敏度高,去除干扰能力强,但质谱检测器价格昂贵、操作复杂,同时因奶源及添加营养成分的复杂及多样性,受基质影响比较大,需要用基质加标[9]或内标法定量,然而多数配方奶粉都添加了核苷酸,空白基质不易获得,此外内标价格昂贵,成本较高。液相色谱-离子对色谱法[15,16]用离子对试剂作为流动相,因离子对试剂和固定相结合产生不可逆吸附,进而影响固定相活性位点,故可能对色谱柱造成不可逆的伤害。婴幼儿乳粉中核苷酸检测的前处理主要有沉淀蛋白质[18]、固相萃取[20-22]和快速溶剂萃取[13]等方式。沉淀法只能选择性去除部分蛋白质,抗干扰能力差;赵贞等[20,21]选用的固相萃取方式上样即接液或未经淋洗步骤,净化效果弱。快速溶剂萃取法具有全封闭式萃取-无污染、自动化程度高的优点,但同时存在必须配备自动化萃取仪的缺陷,方法的适用性和推广性差。
羊奶中蛋白质、脂肪结构与母乳十分相似,是公认的最接近人奶的奶品,被称为“奶中之王”,关注度也越来越高。但由于羊奶中除了本身含有允许添加的核苷酸外,还富含多种非蛋白氮、更多的不饱和脂肪酸等200多种营养素和生物活性物质,给羊奶粉中核苷酸检测带来较大挑战[24,25]。目前,未查到针对羊奶粉中核苷酸的测定及分析的相关文献。本文针对小分子干扰多的羊奶粉,通过对多种方法比较,优化了提取、净化和色谱条件,建立了适用于牛奶粉和羊奶粉中核苷酸检测的液相色谱法,方法适用性强、抗干扰能力佳、净化效果好,结果准确度高,为婴幼儿配方乳粉的质量监控和研究提供了参考和依据。
1 实验部分
1.1 仪器、试剂与材料
Waters 2695高效液相色谱仪(配二级管阵列检测器)、Atlantis T3色谱柱(250 mm×4.6 mm, 5 μm)、ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm, 1.8 μm)、HLB固相萃取柱(20 mL/1 000 mg)购自美国Waters公司;Gemini C18色谱柱(250 mm×4.6 mm, 5 μm)购自美国Phenomenex公司;AB204-S型电子天平购自瑞士Mettler Toledo公司。SAX固相萃取柱(6 mL/1 000 mg)购自德国MACHEREY NAGEL公司。
甲醇(色谱纯)购自德国Merck公司;磷酸(色谱纯)、磷酸二氢钾(KH2PO4,优级纯)、氢氧化钾(分析纯)、盐酸(分析纯)、氢氧化钠(分析纯)、氯化钠(NaCl,分析纯)、乙二胺四乙酸二钠(EDTA,分析纯)、溴化钾(分析纯)购自国药集团化学试剂有限公司;CMP(纯度≥99%)、UMP(纯度≥99%)、IMP(纯度≥99%)、GMP(纯度≥98%)、AMP(纯度≥98%)购自美国Sigma公司;奶粉质控样品NIST SRM 1849a购自美国国家标准技术研究所。
1.2 标准溶液的配制
准确称取5种核苷酸标准物质各10 mg,用水溶解并定容至10 mL,配制成质量浓度为1 g/L的标准物质母液。分别量取标准物质母液(25、50、100、250和500 μL)至50 mL容量瓶中,用0.5 mol/L pH 3.0磷酸二氢钾溶液定容至刻度,配制成质量浓度为0.5、1、2、5和10 mg/L的标准工作液。
1.3 样品处理过程
1.3.1等电点沉淀法(方法一)
准确称取1 g样品于50 mL离心管中,加入30 mL温水溶解,涡旋,超声10 min,用1 mol/L盐酸调节样品的pH值至1.7±0.1,静置1 min,再用1 mol/L氢氧化钠溶液调节样品的pH值至4.5±0.1。定容至50 mL,混匀后经滤纸过滤,待净化。
1.3.2等电点沉淀&HLB柱净化法(方法二)
移取2 mL 1.3.1节待净化液过HLB柱(经4 mL甲醇、10 mL水活化),加入4 mL水淋洗,用4 mL甲醇洗脱,收集洗脱液,过0.22 μm水相滤膜待上机测定。上样、淋洗、洗脱步骤流速应控制在2 mL/min。
1.3.3等电点沉淀&SAX柱净化法(方法三)
移取4 mL 1.3.1节待净化液过SAX柱(经4 mL甲醇、10 mL水活化),加入4 mL溴化钾淋洗液(0.3 mol/L),用4 mL 0.5 mol/L pH 3.0磷酸二氢钾洗脱液,收集洗脱液并定容至4 mL,过0.22 μm水相滤膜待上机测定。上样、淋洗、洗脱步骤流速应控制在2 mL/min[21]。
1.3.4NaCl& EDTA沉淀&SAX柱净化法(方法四)
准确称取1 g样品于50 mL离心管中,加入30 mL提取液(1 mol/L NaCl和5 mmol/L EDTA),涡旋,超声10 min,用水定容至50 mL,待净化。移取4 mL处理液过SAX柱(经4 mL甲醇、10 mL水活化),用4 mL溴化钾(0.3 mol/L)淋洗,用4 mL 0.5 mol/L pH 3.0磷酸二氢钾洗脱,收集洗脱液并定容至4 mL,过0.22 μm水相滤膜待上机测定。上样、淋洗、洗脱步骤流速应控制在2 mL/min。
1.4 高效液相色谱条件
色谱柱:Atlantis T3(250 mm×4.6 mm, 5 μm)和Gemini C18(250 mm×4.6 mm, 5 μm);柱温:40 ℃;进样量:20 μL;流速:0.6 mL/min;流动相A: 10 mmoL/L pH 5.6 KH2PO4;流动相B:甲醇;检测波长:260 nm。梯度洗脱条件见表1。
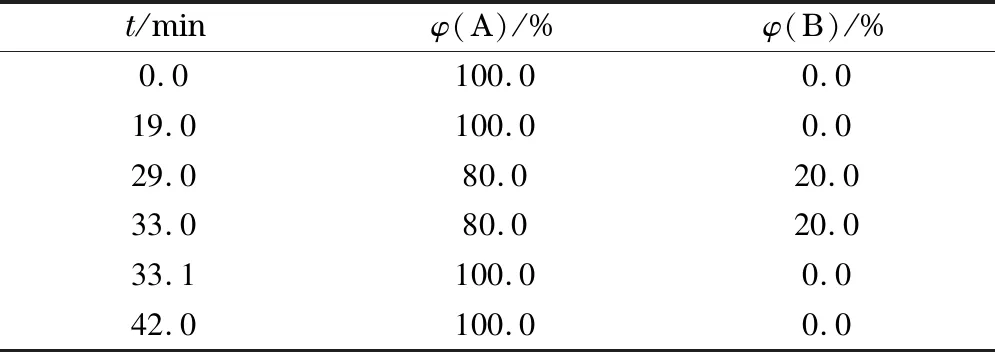
表1 液相色谱法梯度洗脱条件
A: 10 mmoL/L pH 5.6 KH2PO4; B: methanol.
1.5 超高效液相色谱-串联质谱条件
1.5.1液相色谱条件
色谱柱:ACQUITY UPLC HSS T3(100 mm×2.1 mm, 1.8 μm);柱温:40 ℃;进样量:5 μL;流速:0.25 mL/min;流动相A: 0.1%(体积分数)甲酸水;流动相B:甲醇。梯度洗脱条件见表2。
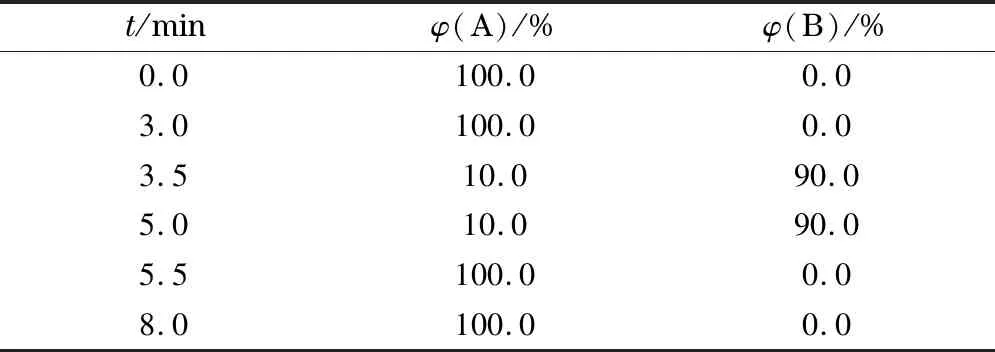
表2 超高效液相色谱-串联质谱法梯度洗脱条件
A: 0.1% (v/v) formic acid; B: methanol.
1.5.2质谱条件
离子源:电喷雾离子源(ESI+);离子源温度:150 ℃;锥孔气流量:150 L/h;脱溶剂气温度:450 ℃;脱溶剂气流量:850 L/h;锥孔电压:40 V;扫描模式:多反应监测(MRM)扫描;其他质谱参数见表3。

表3 CMP质谱参数
* Quantitative daughter ion.
2 结果与讨论
2.1 前处理的考察
针对婴幼儿乳粉中核苷酸的前处理方式主要有沉淀蛋白质[18]、固相萃取[20-22]等,其中固相萃取主要包括HLB柱和SAX柱净化两种。本文考察了方法一----等电点沉淀蛋白质法对目标物含量的测定,实验(结果见图1)发现,牛奶粉和羊奶粉都存在多种干扰物质,尤其是CMP和GMP附近干扰严重,严重影响定量,须进一步对样品净化。
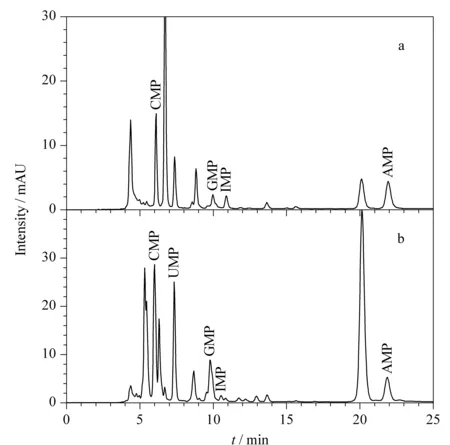
图1 方法一处理乳粉后的色谱图
由于HLB柱是以亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按照一定比例聚合成的大孔共聚物,其保留机理为反相,为通用型固相萃取小柱。本研究尝试采用方法二----等电点沉淀& HLB柱净化法实施样品净化,结果显示HLB柱在上样过程有CMP、UMP和IMP流出、淋洗过程有CMP、UMP、GMP和AMP流出,说明核苷酸在HLB柱上保留效果差,此柱不适合乳粉中核苷酸的净化。

图2 CMP光谱图比较
由于强阴离子交换柱-SAX键合基团为永久性带正电的基团----季铵基,针对弱酸性化合物选择性高、保留能力强。本文参考郑红等[21]的文献,根据化合物等电点优化的最佳pH,考察了方法三----等电点沉淀&SAX柱净化法对5种目标物的净化效果,结果(见图2)表明,牛奶粉净化效果良好,但羊奶粉中CMP的色谱峰形虽然良好,但其光谱图与标准工作液差异大,仍存在干扰杂质。
鉴于方法三去除CMP中的干扰杂质能力差,利用NaCl的盐析功能和EDTA的络合作用(即方法四)去除杂质,结果表明,该方法对牛奶粉和羊奶粉均有较好的净化效果,很好地解决了羊奶粉CMP的杂质干扰问题。方法三测定CMP值为0.369 3 g/kg、CMP光谱图与标准工作液光谱图明显不一致,方法四测定CMP值降至0.066 5 g/kg, CMP光谱图与标准工作液一致,说明方法四净化效果好。
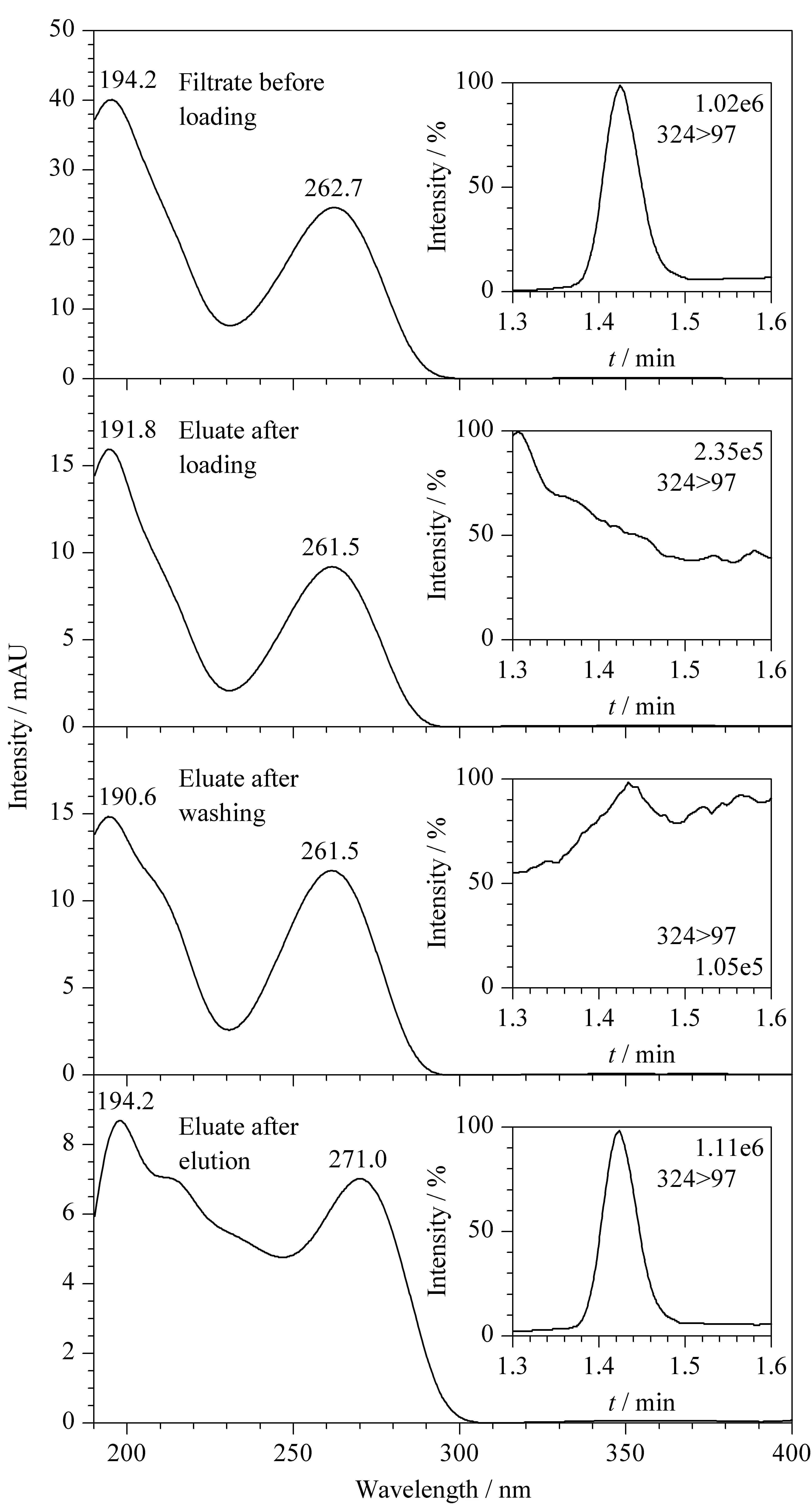
图3 不同阶段CMP光谱图和LC-MS/MS色谱图
为进一步研究方法四对羊奶粉中CMP的净化及保留效果,分别测定上样后溶液、淋洗后溶液,发现均有与CMP保留时间一致的化合物流出,但光谱图与标样存在差异。如图3所示,经液相色谱-串联质谱进一步确认,上样、淋洗后溶液在CMP保留时间处无目标峰,不存在与CMP相同的母离子、子离子,故为杂质。此外洗脱液中CMP离子比率与标样一致,结果与方法四一致。
综上所述,方法四用NaCl& EDTA沉淀&SAX柱净化法的前处理条件,对目标物选择性好,净化效果优,适用于婴幼儿乳粉尤其是羊奶粉中核苷酸的检测。

图4 不同色谱柱对羊奶粉的分离效果

图5 杂质峰1、GMP、杂质峰2及IMP光谱图
2.2 色谱条件的考察
Atlantis T3色谱柱对硅羟基进行特殊封端处理----裸露硅羟基适量但不完全封端,对极性化合物保留强,兼容100%水相。Gemini C18色谱柱与聚合物型填料类似,具有宽广的PH稳定性,在100%缓冲液流动相中保持稳定。本文考察了Gemini C18柱和Atlantis T3色谱柱对于目标物的分离效果。牛奶粉基质中GMP和IMP峰前不存在干扰峰,Gemini C18和Atlantis T3色谱柱对其分离效果相当。羊奶粉中由于小分子化合物多,尤其在GMP和IMP峰前易存在干扰峰,色谱柱的分离效果直接影响准确定量(见图4)。如图5所示,羊奶粉中杂质峰1光谱图与GMP类似,在Gemini C18柱上两者分离度差,影响准确定量;IMP在Gemini C18柱定量结果偏高,可能是由于IMP与杂质峰2在Gemini C18柱上合为一个峰所致;Atlantis T3柱能有效分离干扰杂质峰1和峰2,使GMP和IMP定性定量准确。综合比较,Atlantis T3色谱柱抗干扰能力强,分离效果好,适用于复杂基质中核苷酸的测定。
2.3 方法学考察
2.3.1线性范围与检出限
将标准工作液由低浓度到高浓度经液相色谱测定,以5种核苷酸峰面积为纵坐标(以Y表示)、浓度为横坐标(以X表示,单位为mg/L)绘制标准曲线。采用空白基质加标的方法,以信噪比S/N=3得到目标物的检出限(LOD),以信噪比S/N=10得到目标物的定量限(LOQ),计算方法检出限和定量限。线性回归方程及检出限、定量限值见表4。
2.3.2回收率和精密度
实验采取阴性样品中添加0.05、0.10和0.50 g/kg 3个水平的标准溶液,每个水平平行测定6次,得到方法的回收率及精密度,结果见表5。结果显示,3个水平的加标回收率为91.1%~110%,相对标准偏差为2.3%~4.7%。本方法对乳粉质控样品NIST SRM 1849a进行检测,结果与中位值比较的偏差在10%以内,具体结果见表6。
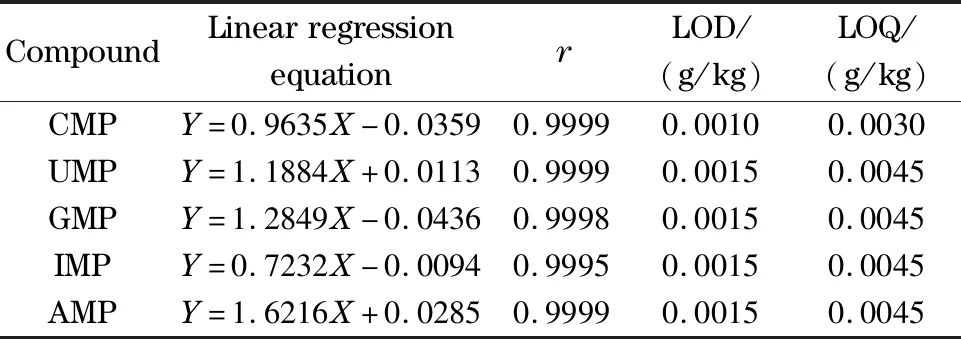
表4 5种核苷酸的线性回归方程、相关系数、检出限及定量限
Y: intensity,X: mass concentration, mg/L.
2.4 实际样品的测定
选择市售品牌(品牌1~3为牛奶粉,品牌4~6为羊奶粉)的婴幼儿配方乳粉进行测定,结果见表7。结果显示,核苷酸的测定结果与标示值含量相当,且满足GB 14880-2012中0.12~0.58 g/kg的要求。
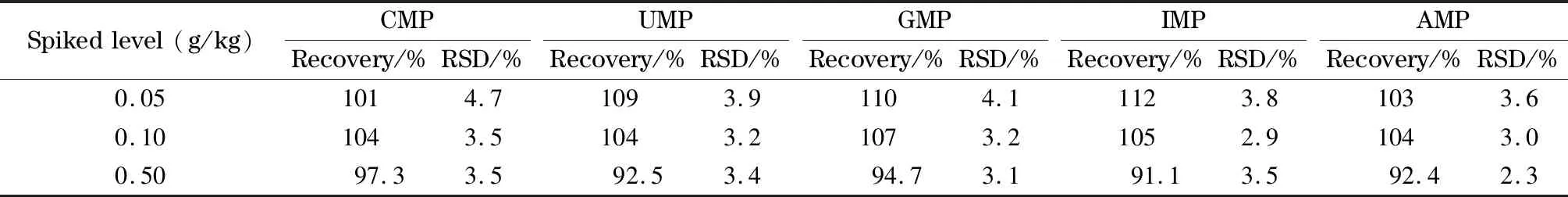
表5 样品中5种核苷酸的回收率及精密度(n=6)

表6 NIST SRM 1849a中核苷酸的含量
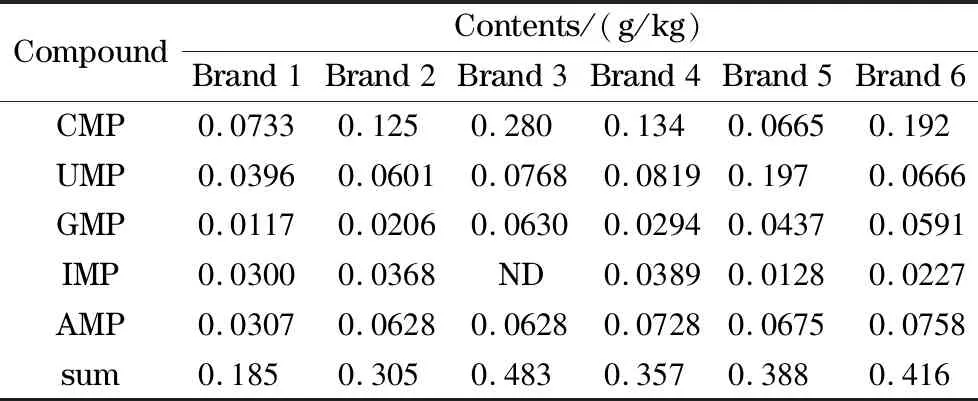
表7 婴幼儿配方乳粉中核苷酸的含量
ND: not detected.
3 结论
本文优化了前处理条件和色谱条件,建立了婴幼儿乳粉中5种核苷酸的高效液相色谱法,解决了羊奶粉中核苷酸测定的干扰问题。通过方法学验证,比对了乳粉质控样NIST SRM 1849a的检测结果,结果满意。综上所述,该方法稳定性好,准确度高,结果可靠。通过本文的研究,为监管部门和企业自控提供了技术支持。