教学考试杂志社“优师计划”阶段性成果展示——“化学平衡原理”相关试题选登
一、化学反应与能量



下列说法正确的是
( )

A.反应②中的能量变化如图所示,则ΔH2=E1-E3
B.H2的燃烧热为241.8 kJ·mol-1,反应③中反应物的总能量高于生成物总能量
C.在2 L密闭容器中通入1 mol N2和3 mol H2,平衡时放出热量Q=92.4 kJ

【答案】D
【例2】利用H2和O2制备H2O2的原理为:


已知:A、B均为有机物,两个反应均能自发进行,下列说法正确的是
( )
A.ΔH2>0
B.B为H2和O2制备H2O2的催化剂
C.反应①的正反应的活化能大于逆反应的活化能

【答案】D
二、化学反应速率与化学平衡
【例1】电镀含氰废水中氰化物主要是以CN-形式存在。生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应),实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。下列说法不正确的是
( )
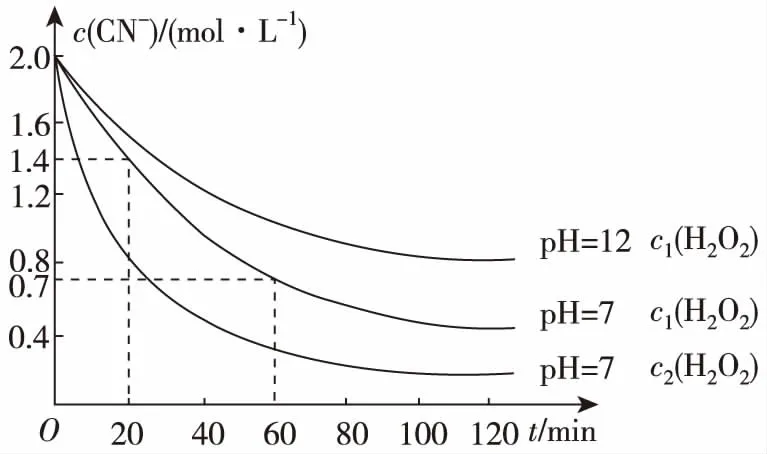
A.含氰废水的pH为7时,20~60 min时间段内反应速率v(CN-)为0.017 5 mol·L-1·min-1
B.含氰废水的pH增大,破氰反应速率减小
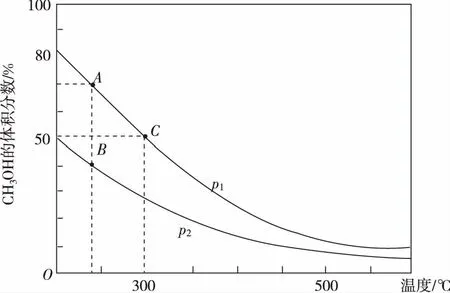
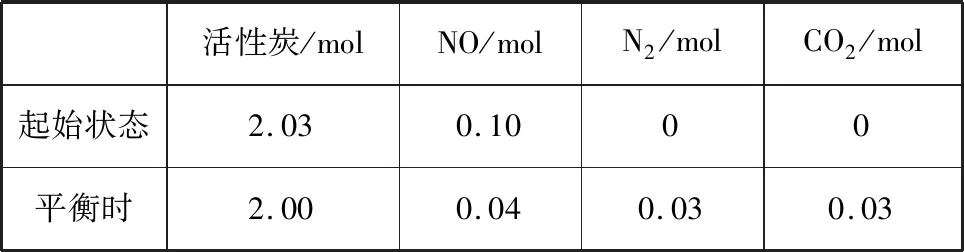
C.实验中双氧水的浓度的大小顺序为c1(H2O2) D.温度越高,破氰反应速率越大 【答案】D ( ) A.该反应的正反应为吸热反应 B.容器压强:p1 C.反应速率:A D.平衡常数:B>C 【答案】D ( ) A.A、B、C三点均达到平衡状态 B.该反应的ΔH<0 C.该反应中CO的浓度C点大于A点 D.H2转化率C点小于D点 【答案】B 【例4】“十八大”指出,着力推进绿色发展、循环发展、低碳发展,形成节约资源和保护环境的空间格局。治污是化学工作者研究的重要课题。 Ⅰ.汽车尾气中含有NO、CO等有害物质,治理原理如下: (1)汽缸中生成NO的原因为________________(用化学方程式表示);汽缸内温度越高,单位时间内NO排放量越大,其原因:________________。 (2)某研究小组在三个容积均为1 L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示: ①实验甲从开始至达到平衡时的反应速率v(CO)=________。 ②与实验乙相比,实验甲和实验丙分别仅改变一种反应条件,则实验丙所改变的条件是____________________,其理由为________________。 ③甲、乙两组实验中NO的平衡转化率大的是____________(填“甲”或“乙”)。 活性炭/molNO/molN2/molCO2/mol起始状态2.030.1000平衡时2.000.040.030.03 (1)计算T℃时,该反应的平衡常数K=________。 (2)为了提高NO的转化率和反应速率,可采取的措施有________(填字母)。 A.增加NO的用量 B.增加活性炭的用量 C.升高温度 D.减小体系压强 (2)①0.05 mol·L-1·min-1②催化剂 达到平衡的时间比乙短,平衡没有移动 ③乙 【例1】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根离子、酸根离子)的组成分数如图所示。下列说法正确的是 ( ) A.HX-的电离程度小于水解程度 B.在pH=7的溶液中HX-和X2-能大量共存 C.在pH=9时,H2X与NaOH恰好完全中和 D.1 L 0.1 mol·L-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol 【答案】A 【例2】T℃时,浓度均为1 mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。下列叙述错误的是 ( ) 已知: ②pKa=-lgKa A.酸性:HA>HB B.a点对应的溶液中:c(HA)=0.1 mol/L,c(H+)=0.01 mol/L C.T℃时,弱酸HB的pKa≈5 D.弱酸的Ka随溶液浓度的降低而增大 【答案】D 【例3】下列图示与对应的叙述相符的是 ( ) 甲 乙 丙 丁 A.图甲表示同温度下,等体积的pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 B.图乙中纯水仅升高温度,就可以从a点变到c点 C.图丙用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图丙曲线可确定首先沉淀的是Cl- D.图丁表示0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸溶液的滴定曲线 【答案】D 【例1】煤燃烧后的主要产物为CO、CO2、SO2、NOx、固体颗粒物等,对燃烧产物的处理及综合利用有重要意义。CO可作为能源和化工原料,应用十分广泛。 反应中相关的化学键键能数据如下: 化学键H—HC OC ←OH—OE/(kJ·mol-1)abcd 由此计算ΔH=________kJ·mol-1(用含a、b、c、d的式子表示)。 ①该反应是________(填“吸热”或“放热”)反应。 ②图中压强p1、p2由大到小的关系是________________。 ③反应在p1及T℃条件下达到平衡时,此时反应的平衡常数为________。若保持温度不变,再向上述达到平衡后的容器中充入1 mol CO与1 mol CH3OH,则平衡________(填“正向”“逆向”或“不”)移动。 ④下列能说明上述反应达到平衡状态的是________。 a.单位时间内生成2nmol H2的同时生成nmol CO b.v(CO)正=2v(H2)逆 c.CO的转化率不再变化 d.密闭容器中压强不再改变 e.混合气体的密度不再改变 f.CH3OH的物质的量不再改变 (3)甲醇可用于制作燃料电池,电解质为硫酸溶液,如图为甲醇燃料电池示意图,则该燃料电池的负极电极反应式为________________。 【答案】(1)c+2d-a-2b (2)①放热 ②p2>p1③4 不 ④cdf 【例2】基于我国“贫油、少气、煤资源相对丰富”的能源结构,发展煤制乙醇技术对我国能源多元化变革有重要意义。煤制乙醇的过程表示如下: (1)将甲醇(CH3OH)循环使用的目的是________________。 (2)由合成气(组成为H2、CO和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应: 甲醇合成反应: 水煤气变换反应: 二甲醚合成反应: ②分析二甲醚合成反应ⅳ对于CO转化率的影响:______________________________。 (3)过程Ⅲ、Ⅳ反应如下: ①压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则ΔH1________(填“>”或“<”,下同)0,ΔH2____________0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图乙所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是________________。 ②若压强为pkPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2 min时达到平衡,则前2 min内CH3COOCH3的平均生成速率为________,该条件下平衡常数K=________。 【答案】(1)甲醇分子间脱水可以生成二甲醚,实现了甲醇的回收利用,又增加了二甲醚的含量,提高了目标产物的产率(或实现甲醇的回收利用,提高原子利用率等,合理即可) (2)①-204.7 ②消耗甲醇,促进甲醇合成反应ⅰ平衡右移,CO转化率增大;生成的H2O(g),通过水煤气变换反应ⅲ消耗部分CO (3)①< < 300~600 K 范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小 ②0.225 mol·L-1·min-1180





三、水溶液中离子平衡




四、化学反应原理综合


















