Ca2+、Mg2+对剩余污泥自培养产酶影响
李婧,南亚萍,袁林江,邹建旻,王龄侦
(西安建筑科技大学 环境与市政工程学院 陕西省环境工程重点实验室 西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
酶法预处理是一种清洁可行的厌氧消化预处理手段[1],但其成本高且酶易失活[2],因此生产廉价高效的水解酶成为酶法预处理需解决的首要问题。若将剩余污泥作为基质培养水解菌(自培养),使其水解利用污泥并产酶,以此作为厌氧消化酶法预处理用酶,即可降低酶法预处理成本,但其产酶效果仍需提高。有报道,Ca2+可促进微生物生长产酶[3],325种酶的激活均需Mg2+参与[4]。
本文研究Ca2+、Mg2+对污泥自培养产酶的影响,并探讨Ca2+、Mg2+对酶活力影响与污泥水解间关系,为提高污泥产酶效率并应用于污泥资源化实践提供科学依据。
1 实验部分
1.1 材料与仪器
剩余污泥,取自西安市第四污水厂二沉池,静置24 h弃去上清液,通过0.45 mm筛网过滤以除杂质,添加蒸馏水,配制成浓度为1 500 mg/L左右的污泥,于4 ℃冰箱内保存备用。实验时于121 ℃灭菌30 min后使用。灭菌剩余污泥中Ca2+、Mg2+浓度分别为5×10-4,8.3×10-5mol/L,剩余污泥其它性质见表1;无水CaCl2、MgCl2均为分析纯;液体培养基:牛肉膏蛋白胨培养基;细菌:地衣芽孢杆菌(Bacilluslicheniformis,BNCC189067)、蜡状芽孢杆菌(Bacilluscereus,BNCC192974)均购自北京北纳生物有限公司,分别为高效产蛋白酶、淀粉酶菌株。
pH5-3E型酸度计;热电/iCE3300型原子吸收光谱仪;CJ-1S型超净工作台;DH-500型电热恒温箱;THZ-82型电热恒温振荡器;DSX-280B型手提式压力蒸汽灭菌器;Z-36HK型高速冷冻离心机;UV-2600型紫外可见分光光度计;美国热电Nicolet iS50型傅里叶变换红外光谱仪;日立F-7000型荧光分光光度计。
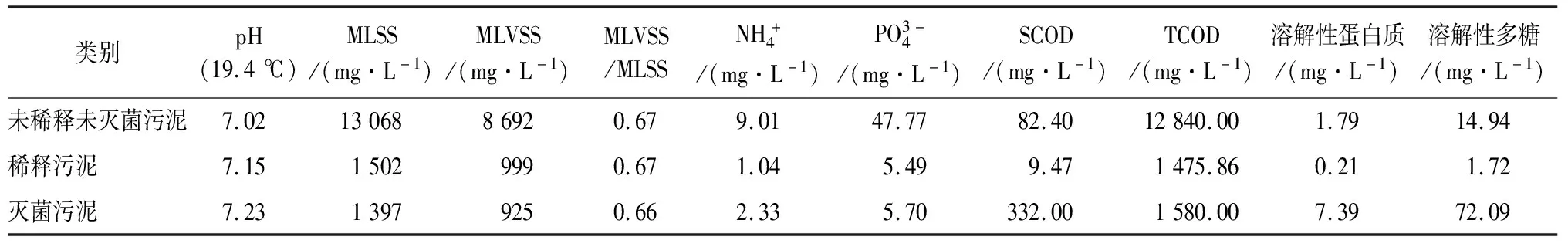
表1 剩余污泥性质Table 1 Characters of excess activated sludge
1.2 实验方法
1.2.1 混合菌剂制备 将菌株于牛肉膏蛋白胨液体培养基中分别培养活化,培养至稳定生长期(OD600=1.6左右)。取地衣芽孢杆菌混悬液50 mL和蜡状芽孢杆菌混悬液25 mL混合,使两菌比例为2∶1。无菌状态下10 000 r/min离心10 min,弃去上清液,并用无菌水重悬,再次离心,反复3次,以去除原混悬液中培养基有机物对后续实验中灭菌污泥性质的影响。完成后再加5 mL无菌水,制成菌悬液备用,共制备12支菌悬液。
1.2.2 剩余污泥产酶实验方法 实验分两批进行,但采用同一批次污泥。第1批设置为空白组、0.03,0.06 mol/L Ca2+组,第2批设置为空白组、0.03,0.06 mol/L Mg2+组,每组设两个平行样。每批实验取冰箱保存的浓度为1 500 mg/L的稀释剩余污泥1 500 mL,充分搅拌混合后,分装至6个500 mL广口锥形瓶中,每瓶各250 mL,Ca2+、Mg2+按所需浓度加入对应组别锥形瓶中,空白组不加,121 ℃灭菌30 min。无菌条件下每个锥形瓶中各加入5 mL混合菌剂菌悬液,以无菌透气塞覆盖,于30 ℃、120 r/min摇床培养7 d,锥形瓶中DO维持在3~4 mg/L。分别于第0,1,2,3,5,7 d测定蛋白酶、淀粉酶活力,第0 d和第7 d测定污泥成分变化和污泥DOM成分变化。
1.3 测定方法
2 结果与讨论
2.1 Ca2+、Mg2+对污泥自培养产水解酶效果的影响
2.1.1 Ca2+、Mg2+对污泥自培养产蛋白酶效果分析 Ca2+、Mg2+添加浓度对污泥自培养产蛋白酶的影响见图1。
由图1可知,两批实验的空白组中蛋白酶活力均呈随时间增加先快速上升后下降的规律,分别在第1 d上升至最大值216.69 U/mL和231.04 U/mL。添加0.03 mol/L Ca2+组(图1a),污泥中蛋白酶活力在第1 d上升最快,随后一直呈缓慢稳定上升趋势,在第7 d达最大值340.07 U/mL,较空白组的蛋白酶活力最大值增加了53.94%,由此可知,添加0.03 mol/L Ca2+能有效提高污泥自培养产酶活力,且酶活力上升趋势较稳定。添加0.06 mol/L Ca2+组,在第1 d内快速升至110.95 U/mL,但上升幅度明显低于空白组和0.03 mol/L Ca2+组,然后维持在稳定水平,其7 d内最大值为143.70 U/mL,相较空白组的蛋白酶活力最大值下降了33.68%,在产酶实验后期,其酶活力始终维持在一较低水平。表明添加0.06 mol/L Ca2+,对污泥产酶不但没有促进作用,反而产生了抑制。添加Mg2+组(图1b)中,两组蛋白酶活力均呈第1 d快速上升趋势,但酶活力最大值均小于空白组,且两组酶活力均能维持在较稳定范围内。表明Mg2+不能促进蛋白酶活性,且对酶活有一定抑制,但能够维持蛋白酶活力稳定。
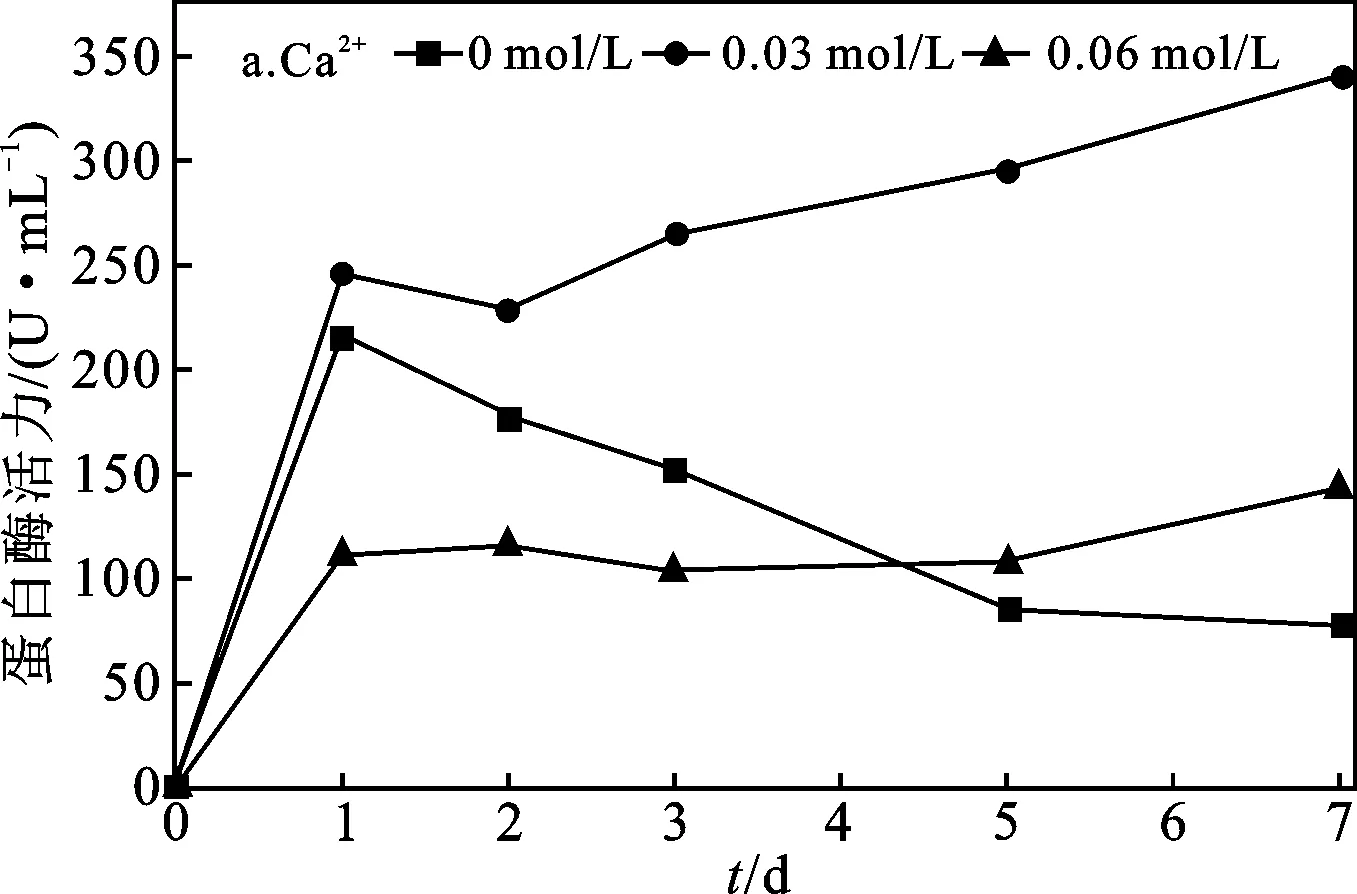
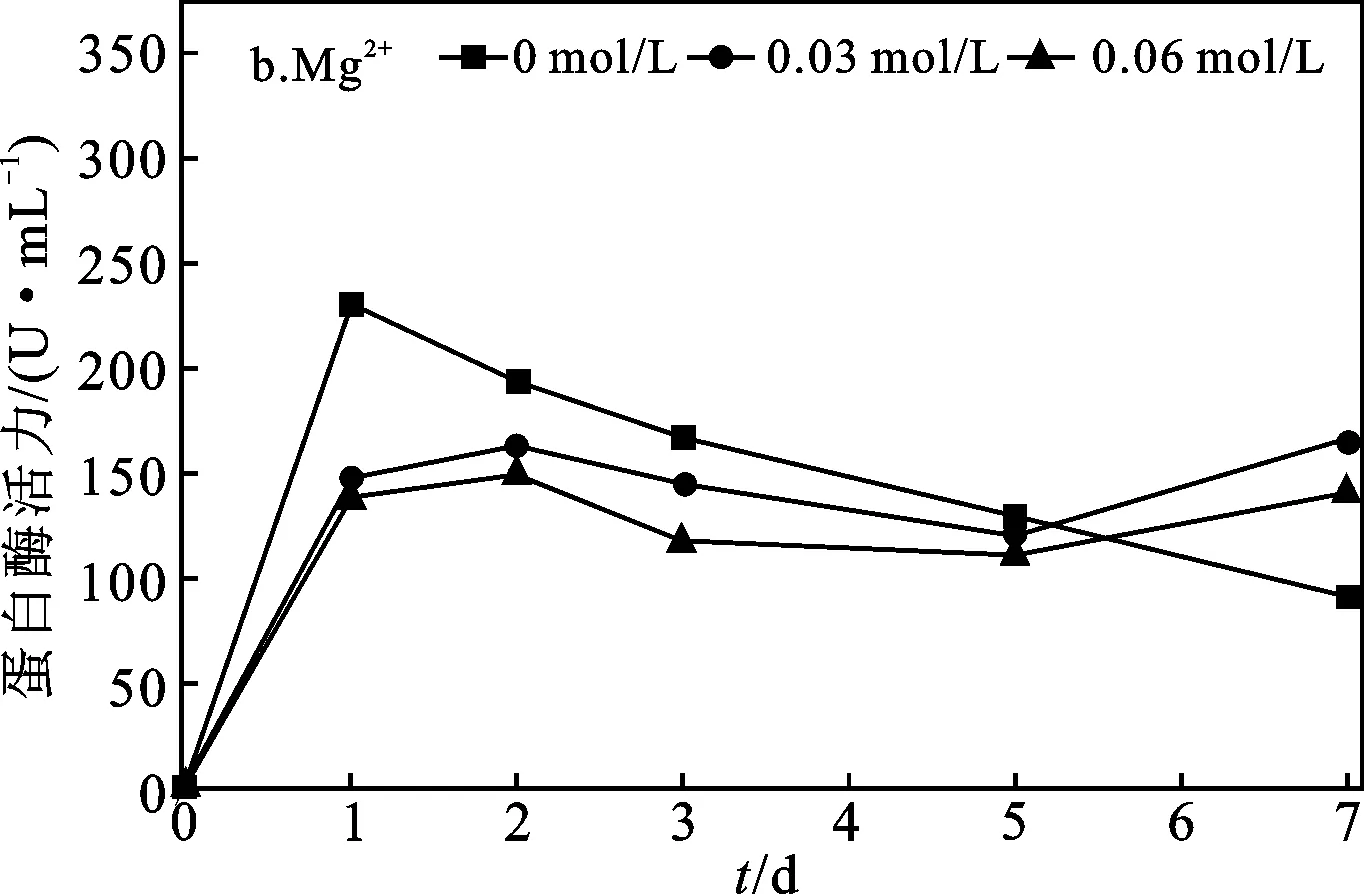
图1 Ca2+、Mg2+添加浓度对污泥蛋白酶活力的影响Fig.1 Effect of Ca2+,Mg2+ concentrations on protease activity variation of excess activated sludge
2.1.2 Ca2+、Mg2+对污泥自培养产淀粉酶效果分析 Ca2+、Mg2+添加浓度对污泥自培养产淀粉酶的影响见图2。

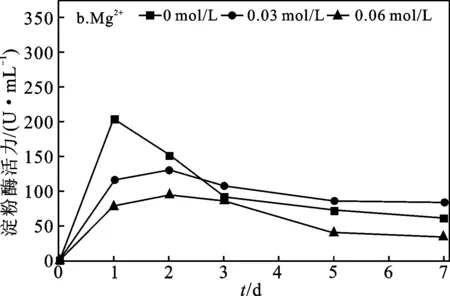
图2 添加不同浓度Ca2+、Mg2+条件下污泥淀粉酶活力变化Fig.2 Amylase activity variation of excess activated sludge with different concentrations of Ca2+,Mg2+
两批实验空白组中,淀粉酶活力随时间的增加均呈先快速上升后下降的规律,且分别在第1 d上升至最大值215.58 U/mL和204.49 U/mL。添加Ca2+的两组(图2a)中,淀粉酶活力在第1 d上升至最大值,分别为351.02,289.44 U/mL,较空白组淀粉酶最大活力分别增加了62.83%,41.54%,但随时间延长快速下降,表明添加Ca2+能短期内提高淀粉酶活力。添加Mg2+的两组(图2b)中,淀粉酶活力均呈随时间增加先上升后维持稳定的趋势,但两组的最大淀粉酶活力均小于空白组,表明添加Mg2+对污泥中淀粉酶活力升高无作用,但能维持酶活稳定,这与Mg2+对蛋白酶活力影响结果一致。
2.2 污泥成分变化分析
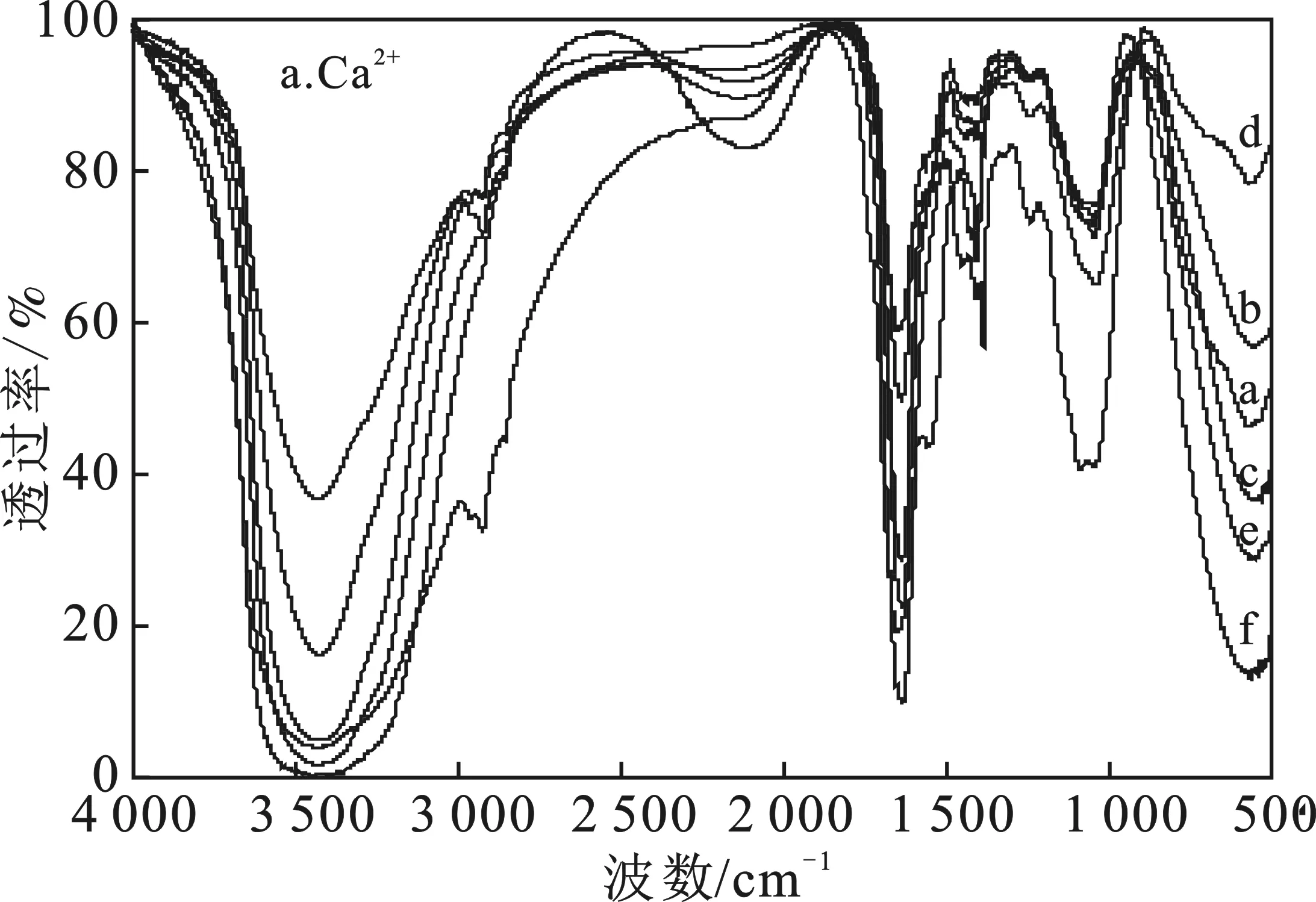
污泥要产生更多水解酶,首先需要污泥本身被利用水解酸化,为研究污泥自培养产酶过程中污泥利用情况,采用FTIR分析污泥成分变化,结果见图3。
由图3可知,3 450~3 400 cm-1为O—H或N—H伸缩振动峰,空白组及加Ca2+组(图3a)污泥在3 450~3 400 cm-1处出现尖峰,而加Mg2+组(图3b)污泥在3 400~3 200 cm-1处出现钝峰,这是由于Mg2+与蛋白质络合,造成光谱变化[8]。2 500~1 900 cm-1是三键及累积双键吸收区,1 643~1 850 cm-1处为羰基振动吸收峰,空白组水解前后均无该两种峰,加Ca2+、Mg2+组水解7 d后均出现该两种峰,认为是Ca2+、Mg2+对外加菌的生长代谢及污泥中的化学物质种类有一定影响所致[9]。1 640~1 407 cm-1处为蛋白质肽键频段,加Ca2+、Mg2+组7 d后的污泥中肽键都有所增加,表明污泥产酶过程中产生了蛋白,该蛋白有可能是产生的水解酶,也可能是污泥水解过程中产生的其它类蛋白[10]。
2.3 污泥上清液组成成分
污泥中官能团的改变说明其组成成分改变,污泥在一定程度上发生水解,水解产物可用于污泥自培养中添加的复合菌进一步的生长及产酶。为研究添加Ca2+、Mg2+对产酶的影响与污泥水解产物间关系,对污泥自培养产酶过程中的污泥进行DOM三维荧光分析。
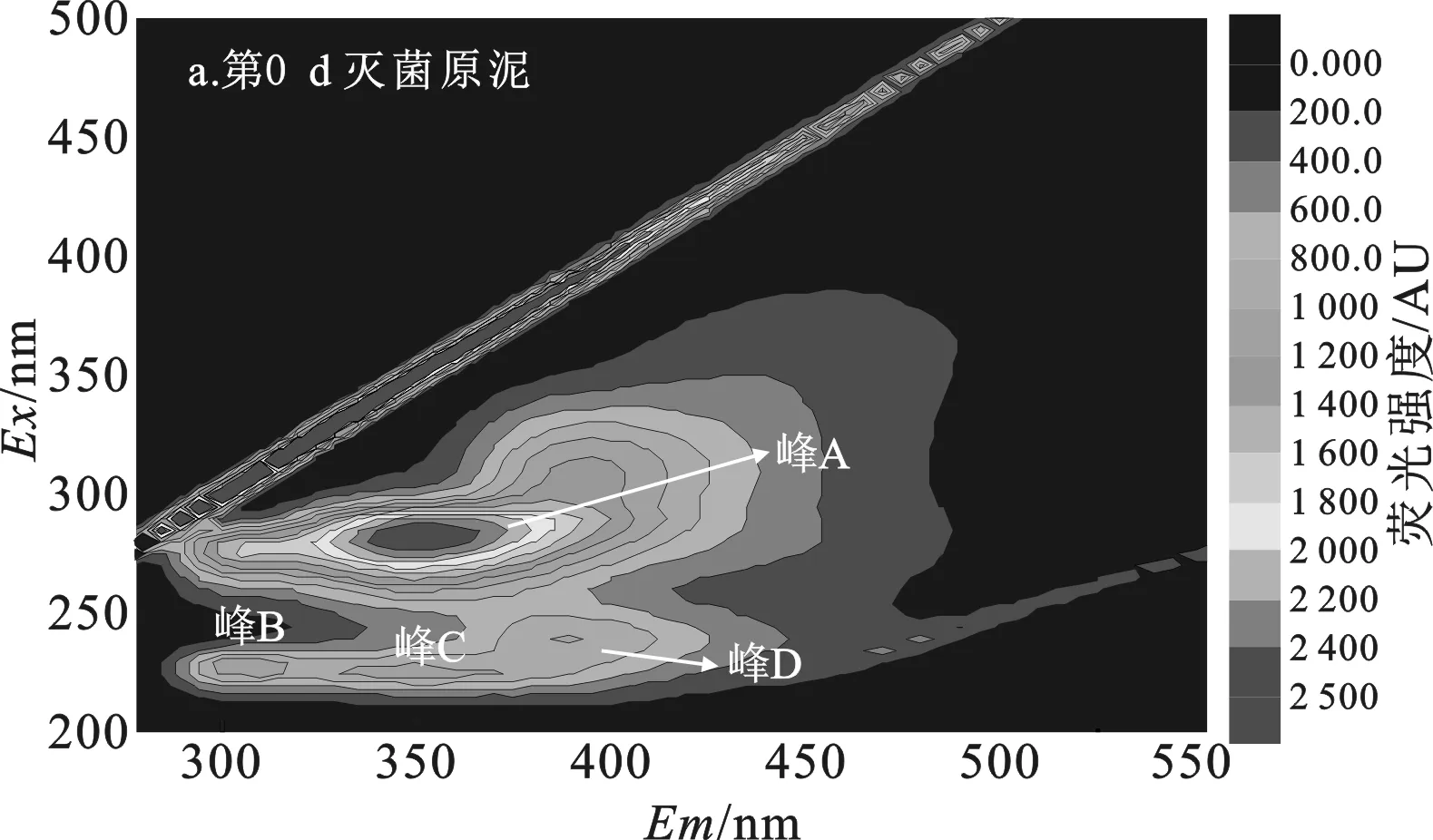
2.3.1 添加Ca2+组 污泥DOM三维荧光分析结果见图4、表2。
环境中常见DOM通常分为5类,即微生物沥出物(微生物生长、代谢、死亡过程中产生的溶解性有机物)、芳香性蛋白质I、芳香性蛋白质II、腐殖酸类、富里酸类[11]。
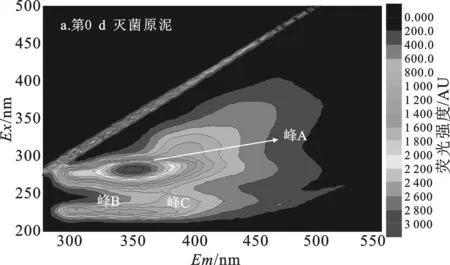
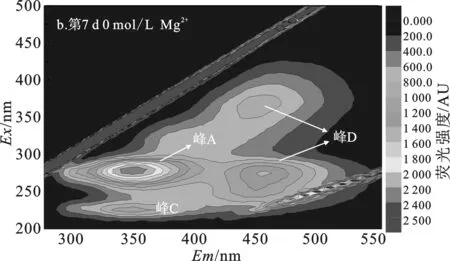
由图4、表2可知,第0 d污泥DOM(图4a)有4个不同类型的荧光峰,分别是微生物沥出物(峰A)、芳香性蛋白质I(峰B)、芳香性蛋白质II(峰C)、富里酸类(峰E)。其中荧光强度最强的是微生物沥出物峰,认为是对污泥进行高温高压灭菌后,污泥中大部分微生物胞内物质溶出产生的结果[11]。
经7 d水解,空白组污泥DOM中(图4b)出现了3个腐殖酸类峰(峰D)、芳香性蛋白II峰,但芳香性蛋白I峰消失,微生物沥出物峰减弱但荧光强度仍最强。说明空白组污泥经过7 d水解,最初灭菌产生的微生物沥出物剩余量仍很多,空白组污泥水解很不充分。
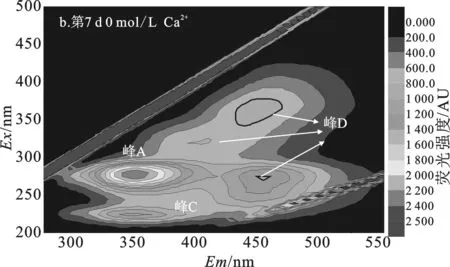
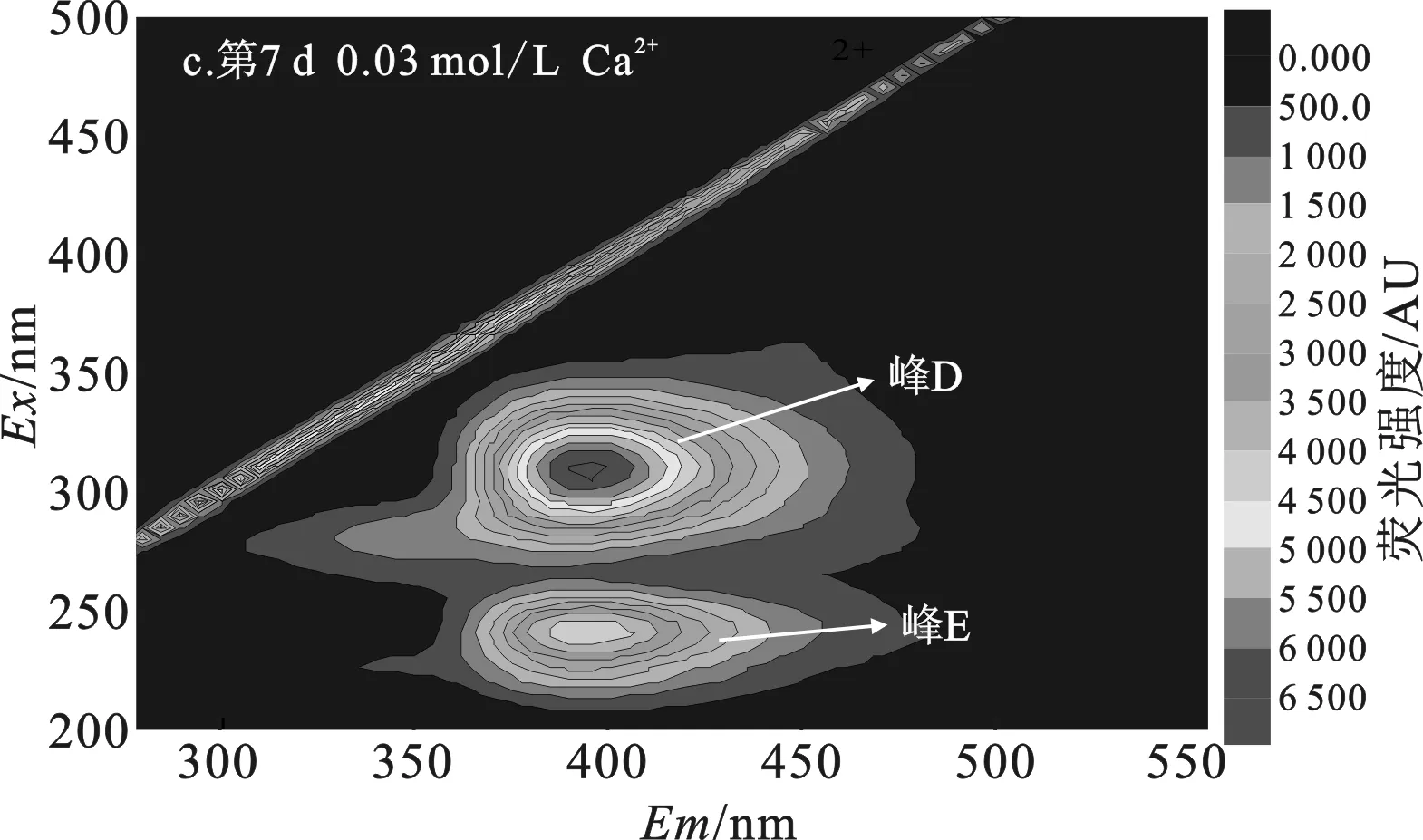
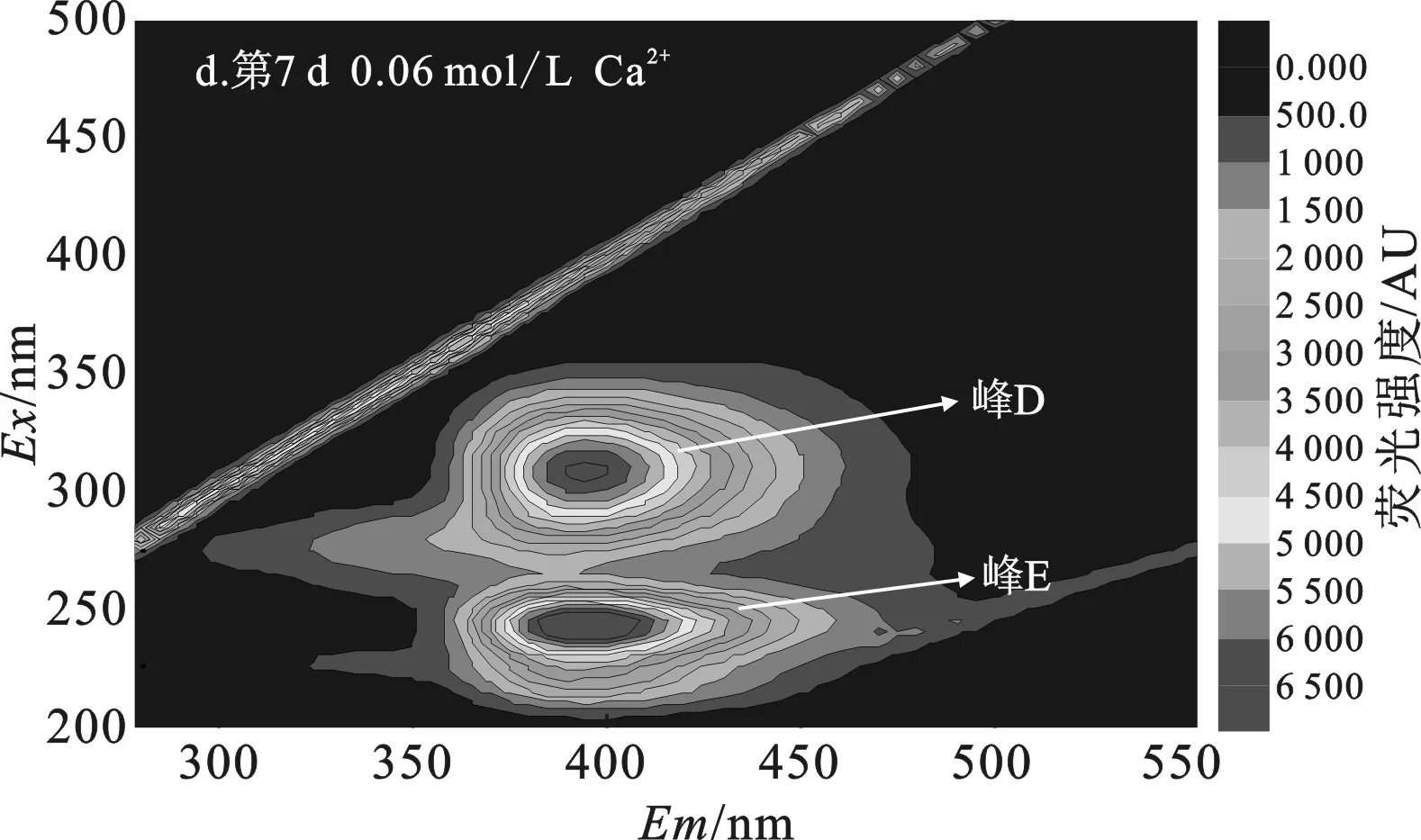
添加0.03 mol/L Ca2+组和0.06 mol/L Ca2+组污泥DOM中(图4c、4d)均出现高荧光强度的腐殖酸类和富里酸类峰,而微生物沥出物、芳香性蛋白质I、芳香性蛋白质II峰消失,且添加0.06 mol/L Ca2+组中富里酸量显著高于0.03 mol/L Ca2+组,表明添加0.03 mol/L Ca2+组和添加0.06 mol/L Ca2+组污泥经过7 d水解,污泥DOM中微生物沥出物、芳香性蛋白质I、芳香性蛋白质II均被水解,转化成难被生物利用的富里酸类和腐殖酸类物质[12]。
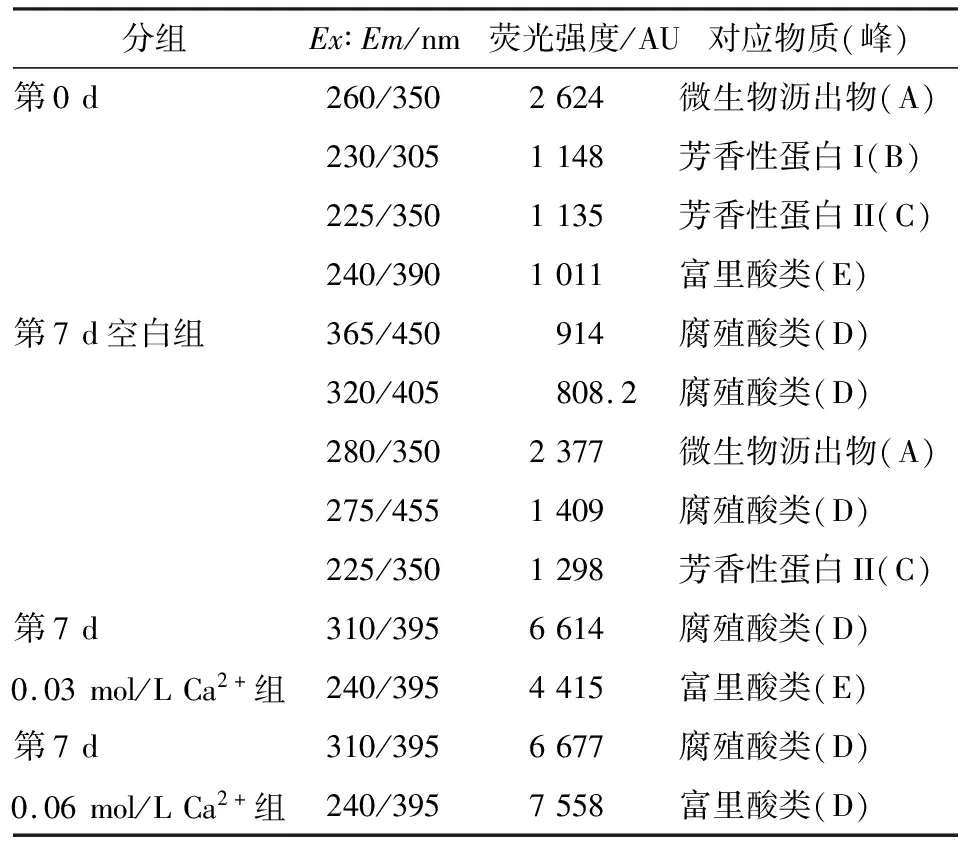
表2 添加Ca2+组污泥DOM三维荧光数据Table 2 Data analysis of three-dimensional fluorescence of excess activated sludge DOM with different concentrations of Ca2+
2.3.2 添加Mg2+组 污泥DOM三维荧光图谱分析见图5、表3。
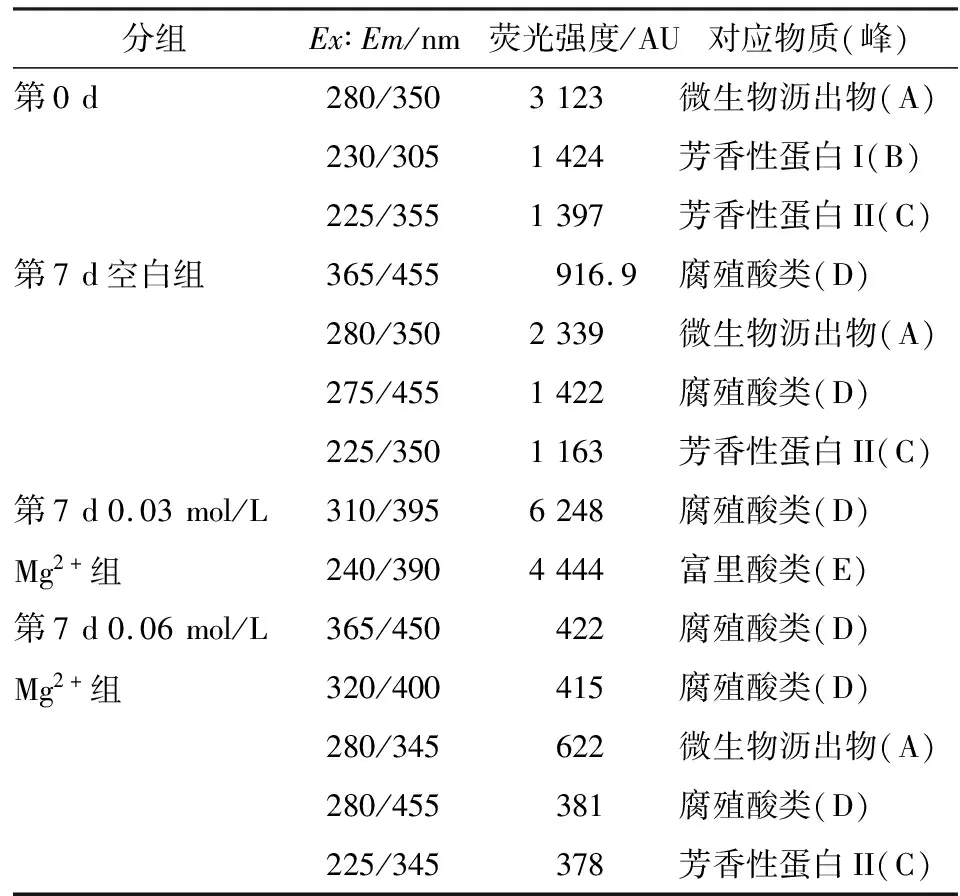
分组Ex∶Em/nm 荧光强度/AU对应物质(峰)第0d280/3503123微生物沥出物(A)230/3051424芳香性蛋白I(B)225/3551397芳香性蛋白II(C)第7d空白组365/455916.9腐殖酸类(D)280/3502339微生物沥出物(A)275/4551422腐殖酸类(D)225/3501163芳香性蛋白II(C)第7d0.03mol/L310/3956248腐殖酸类(D)Mg2+组240/3904444富里酸类(E)第7d0.06mol/L365/450422腐殖酸类(D)Mg2+组320/400415腐殖酸类(D)280/345622微生物沥出物(A)280/455381腐殖酸类(D)225/345378芳香性蛋白II(C)
由图5和表3可知,第0 d灭菌污泥DOM(图5a)中有3个不同类型的荧光峰,分别微生物沥出物、芳香性蛋白质I和芳香性蛋白质II峰,其中荧光强度最强的是微生物沥出物峰。经过7 d水解,空白组污泥DOM中(图5b)出现4个荧光峰,包括两个腐殖酸类、微生物沥出物、芳香性蛋白II峰,其中荧光强度最强的是微生物沥出物峰,其结果与Ca2+对污泥DOM影响实验中空白组的基本一致,表明空白组污泥并没有被水解利用。
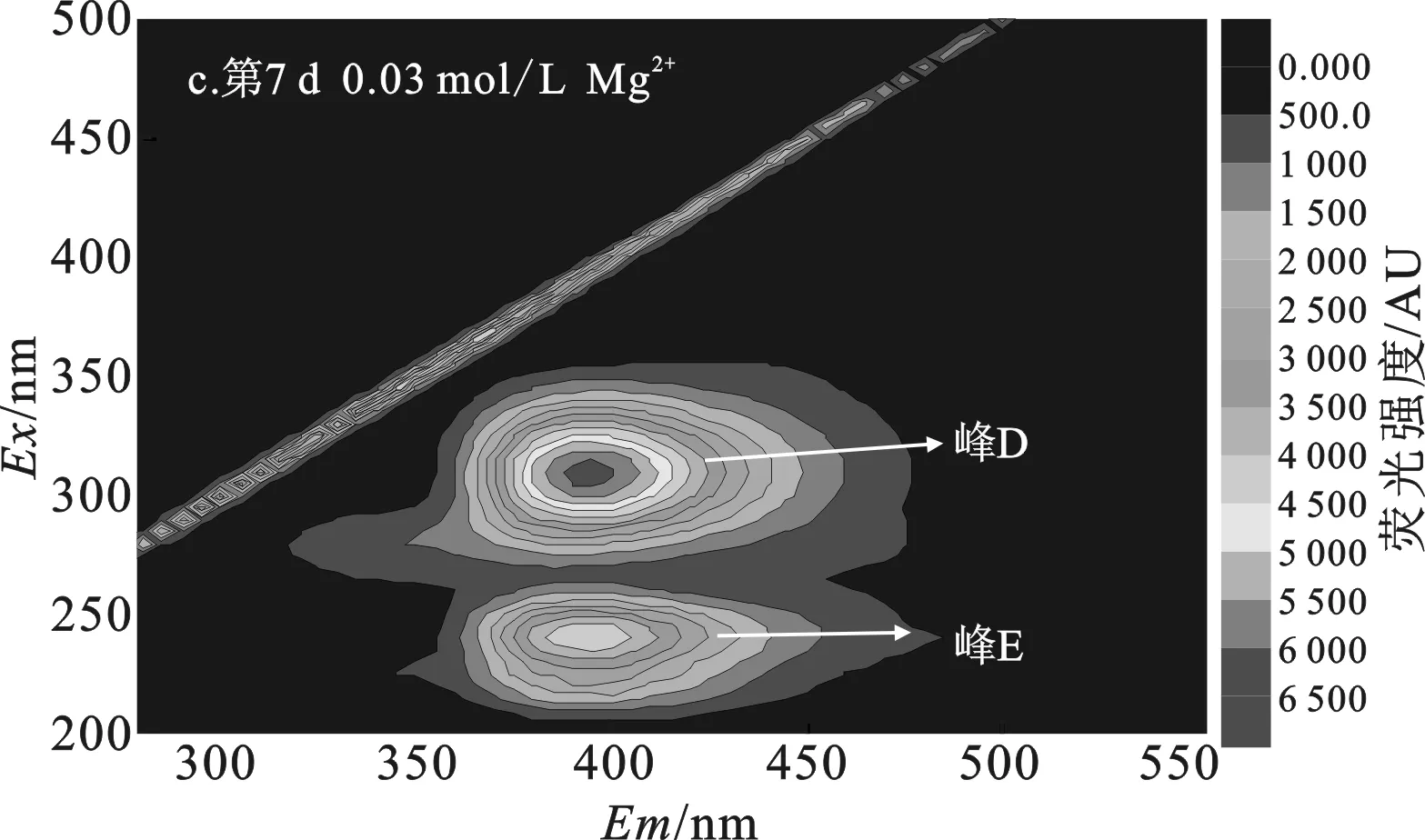
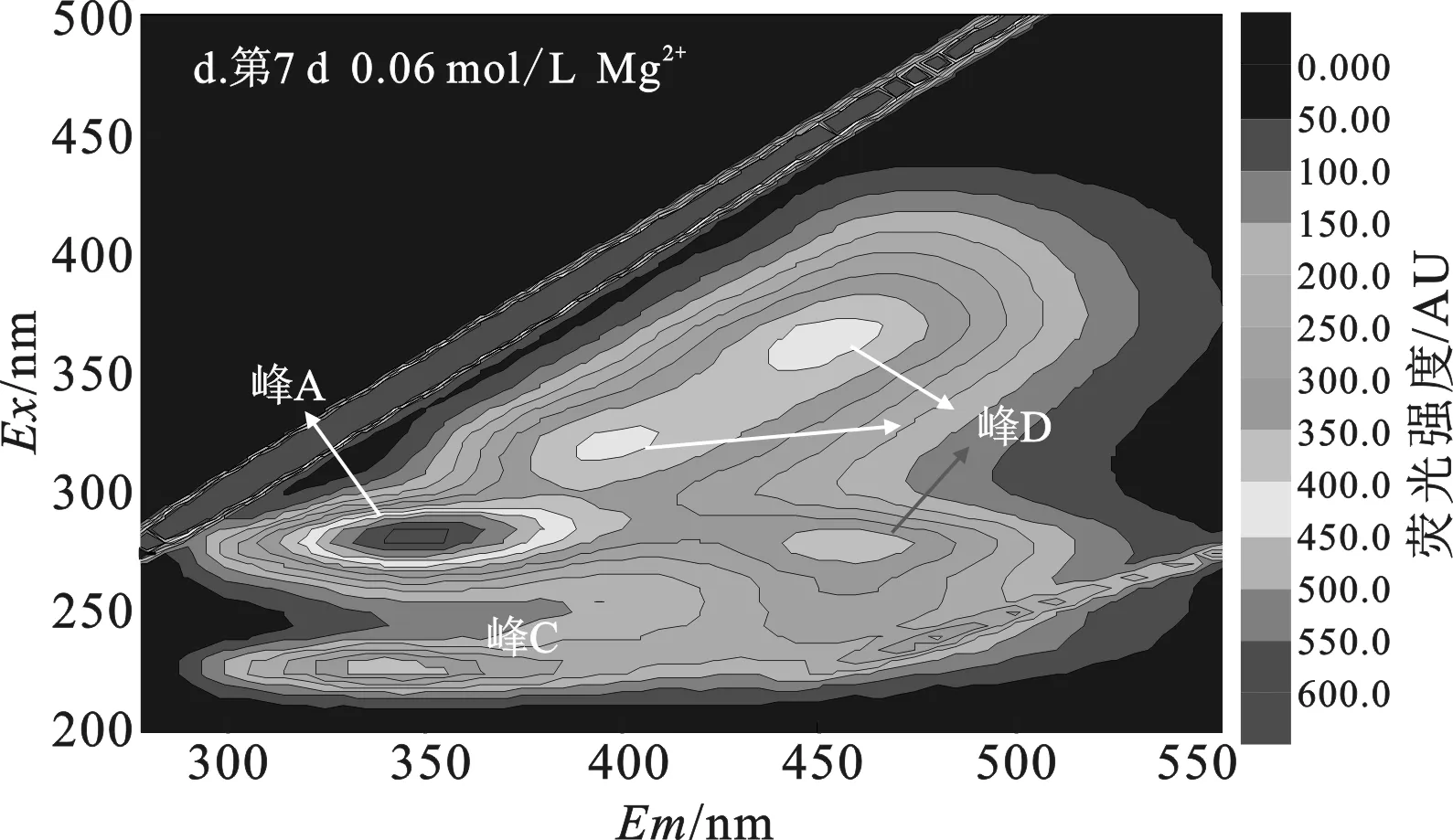
添加0.03 mol/L Mg2+组污泥DOM中(图5c)出现腐殖酸类和富里酸类2个不同类型的荧光峰,其中荧光强度最强的是腐殖酸峰。表明添加0.03 mol/L Mg2+组污泥经过7 d水解,最初灭菌产生的微生物沥出物、芳香性蛋白质I和II已被彻底水解利用,生成了腐殖酸类和富里酸类物质,这与添加0.03 mol/L Ca2+组污泥水解趋势一致。添加0.06 mol/L Mg2+组污泥DOM中(图5d)物质类型与空白组相似,表明添加0.06 mol/L Mg2+并没有促进污泥的有效水解。这也与添加Mg2+组中酶活力小的结果一致。因此,在添加Mg2+对污泥水解影响实验中,相较于添加0.06 mol/L Mg2+组,添加0.03 mol/L Mg2+组有更多污泥DOM被水解菌水解,溶出腐殖酸、富里酸类物质。
由上可知,添加0.03,0.06 mol/L Ca2+和0.03 mol/L Mg2+均能促进微生物水解剩余污泥,但同时也生成了难被生物利用的腐殖酸和富里酸类物质。腐殖酸类物质可与酶活性中心位点结合,从而抑制酶活性[13],可导致酶活力降低,但同时,金属离子又能够通过与腐殖酸结合,屏蔽腐殖酸对酶活性的抑制[14-15]。实验中酶活力变化正是由于污泥水解产酶过程中生成的水解产物与加入的Ca2+、Mg2+的相互影响导致:空白组中第1 d水解酶活力上升最快,而后期水解酶活力下降迅速,污泥上清液中成分也以微生物沥出物、腐殖酸等为主,表明上清液中的腐殖酸等抑制物对水解酶活力有明显抑制作用;加入0.03 mol/L Ca2+后,加入的Ca2+与污泥水解产物中腐殖酸类物质结合,减少了腐殖酸对酶的抑制,水解酶活力升高,高酶活力反过来又促进污泥的水解,为微生物提供更多的有机物,以促进微生物生长代谢及产酶。Mg2+对酶活力没有促进作用,主要原因可能是金属离子与腐殖酸以等价阳离子交换形式结合,从而屏蔽腐殖酸对酶的抑制以对酶活力产生影响,而等价离子交换能力大小与原子序数大小成正比[16],Ca2+原子序数大于Mg2+,因此Ca2+对腐殖酸类的屏蔽效果要优于Mg2+,最终表现为Ca2+对酶活力产生影响,而Mg2+没有,但Mg2+能维持酶活力相对稳定的原因还有待研究。
从不同浓度Ca2+对酶活力影响结果来看,只有0.03 mol/L Ca2+促进酶活力提高,0.06 mol/L Ca2+却抑制了酶活。据Tipping等研究发现,过量金属离子会与必需金属元素竞争酶上的硫化物和氧结合位点,或破坏核酸和蛋白质结构、干扰氧化磷酸化和渗透压平衡等[17]。所以本实验中0.06 mol/L Ca2+虽能促进污泥水解,但是对蛋白酶活力有抑制作用,原因可能是过量的Ca2+与必需金属元素竞争,抑制了微生物的生长代谢,而使微生物产酶效果不佳。
3 结论
(1)以剩余污泥为培养基,加入地衣芽孢杆菌、蜡状芽孢杆菌进行污泥自培养产水解酶,添加0.03 mol/L Ca2+,可使蛋白酶活力第1 d快速升至246.14 U/mL,后持续上升并在第7 d时酶活达最大值340.07 U/mL,蛋白酶活力最大值较空白组增加了53.94%。淀粉酶活力在第1 d快速升至351.02 U/mL后快速下降,第7 d酶活力为70.79 U/mL,淀粉酶活力最大值较空白组增加了51.93%,表明添加0.03 mol/L Ca2+可以提高灭菌污泥自培养产水解酶效果。
(2)添加0.03 mol/L或0.06 mol/L Mg2+,不能提高产水解酶效果,但能维持水解酶活力稳定。
(3)添加合适浓度Ca2+、Mg2+,能强化剩余污泥自培养产酶过程中污泥降解,促进污泥上清液中有机物水解。

