一个辣椒胞质雄性不育SCAR标记的KASP转化及其应用
张 强,张 涛,常晓轲,韩娅楠,程志芳,刘 卫,王 彬,姚秋菊
(河南省农业科学院 园艺研究所,河南 郑州 450002)
辣椒是重要的蔬菜作物,品种类型繁多,适应性广,杂种优势明显。Peterson[1]在引进的印度辣椒品种PI164835中首次发现和报道了辣椒胞质雄性不育(Cytoplasmic male sterility, CMS),即核质互作型雄性不育。利用辣椒CMS是生产杂交种的理想系统,既可以免除人工去雄,节约人力,降低种子成本,提高种子纯度,又可以保护育种单位的知识产权,是辣椒杂种优势利用的重要途径之一。
辣椒胞质雄性不育(CMS)是由细胞质不育基因(S)和细胞核不育基因(rfrf)共同控制的,可以实现三系杂交配套,生产中既能筛选到保持系,又能找到恢复系,从而实现育种和制种的“三系配套”。当细胞质为不育基因(S),细胞核为不育基因(rfrf)即为不育系,植株花粉表现为雄性不育;当细胞质为可育基因(N), 细胞核为不育基因(rfrf)即为保持系,可以保证不育系跟保持系的杂交后代仍为雄性不育;当细胞质为不育基因(S)或可育基因(N),细胞核为恢复基因(RfRf)时即为恢复系,能够使不育系的育性恢复,从而生产出一代杂交商品种。由此可见,辣椒CMS不育基因型只有一种,即S(rfrf),而可育基因型很多,但只有基因型为N(rfrf)的辣椒植株才能作为保持系。因此,选择具有N型细胞质的辣椒植株进行下一步的测交等试验,缩小筛选群体范围,减小工作量,提高选择效率就显得十分有必要。
研究表明,CMS的发生与由线粒体基因的重组而产生的嵌合开放阅读框有很大关系[2-3],根据嵌合基因的阅读框变化开发了一系列与辣椒胞质不育基因相关的分子标记[4-9]。但这些嵌合基因发生的有无并不总是跟辣椒的育性相关联。辣椒胞质雄性不育的育性变化与这些嵌合基因亚化学计量拷贝数密切相关。比如,Min[10]发现,当PCR循环数高于35次时,orf456和Watp6-2也可以在一些辣椒的保持系中少量扩增。针对这一状况,Ji等[11]利用SRAP技术,根据辣椒不育系线粒体基因组上相比保持系和恢复系有一个10 bp的缺失开发了SCAR130标记,相对其他辣椒CMS标记更加可靠和准确,可以准确地鉴定出辣椒细胞质的类型。
近几年来,由LGC公司开发的竞争性等位基因特异PCR(Kompetitive Allele Specific PCR,KASP)新型基因分型技术,通过引物末端碱基的特异匹配来对SNP以及InDel 位点进行精准的双等位基因分型。因其容易实现批量化、自动化、标准化,特别适用于大量群体的高通量检测,成为国际上主流的分子标记检测方法之一。由于具有高度稳定性、准确性、低成本、高通量特点,KASP在水稻、小麦、大豆、花生、棉花和甘蓝等作物的分子标记辅助选择中得到广泛应用[12-21]。但在辣椒作物上还没有看到类似的报道。为了适应后基因组时代分子标记的高通量和快速检测,对SCAR130进行了KASP标记转化,并成功应用于辣椒细胞质类型的检测,为其在辣椒三系杂交育种和制种上的规模化应用奠定基础。
1 材料和方法
1.1 植物材料
辣椒(牛角椒)胞质雄性不育系PC134、保持系PC135由河南省农业科学院园艺研究所茄果类蔬菜研究室经过多代回交选育而成。不育系不育性状稳定,不育株率100%,保持系除了育性外其余等同于不育系。利用PC134为母本,对几个恢复系及它们的杂交后代的细胞质育性检测如表1所示。其他几种需要鉴定细胞质育性的辣椒材料名称及类型如表2所示。上述材料于2017年1月在河南省农业科学院现代农业试验示范基地穴盘育苗。现蕾前定植于联栋塑料大棚内,每份材料取8株,采用2X CTAB法提取其植物基因组DNA,用Nanodrop测量样品DNA浓度,确保样本DNA终质量浓度为80~100 ng/μL。
1.2 KASP引物设计
根据Ji等[11]提供的SCAR130标记在辣椒CMS不育系、保持系的测序结果,针对10 bp的缺失位点设计KASP assay引物,由1条正向通用引物(KASP130F:5′-TTACGGCTCGTTACCGCAGC-3′)和2条反向引物组成(KASP-R1:5′-GAAGGTGACC AAGTTCATGCTCGCTTCACTTCGACGACGC-3′,下划线部分为FAM荧光标签序列;KASP-R2:5′-GAAGG TCGGAGTCAACGGATTCGCTTCACTTCGACGACGCT ATTTACCAA-3′,下划线部分为VIC荧光标签序列)。
1.3 KASP标记试验方法
用于KASP标记扩增的2X Master Mix standard ROX试剂购置于LGC公司。PCR反应利用LGC公司的SNP检测分析平台完成,首先将样本从96孔板中通过Replikator转移至384孔板中,反应体系4 μL,模板DNA 2 μL,Master mix 2 μL,KASP primer Mix Assay 0.07 μL。然后,将加好反应体系的孔板进行封膜,并低速快速离心。离心后在LC480荧光定量PCR仪上进行PCR反应,程序为 94 ℃预变性15 min;94 ℃变性20 s, 61 ℃退火和延伸60 s,10个循环,每个循环降低0.6 ℃;94 ℃变性20 s, 55 ℃退火和延伸60 s, 26~30 个循环。
1.4 KASP标记分析方法
将完成反应的孔板,在酶标仪PHERAstar读板。检测出的细胞质不育(S)样品位于图片的右下方,为蓝色标记;细胞质可育样品(N)位于图片的左上方,为绿色标记。
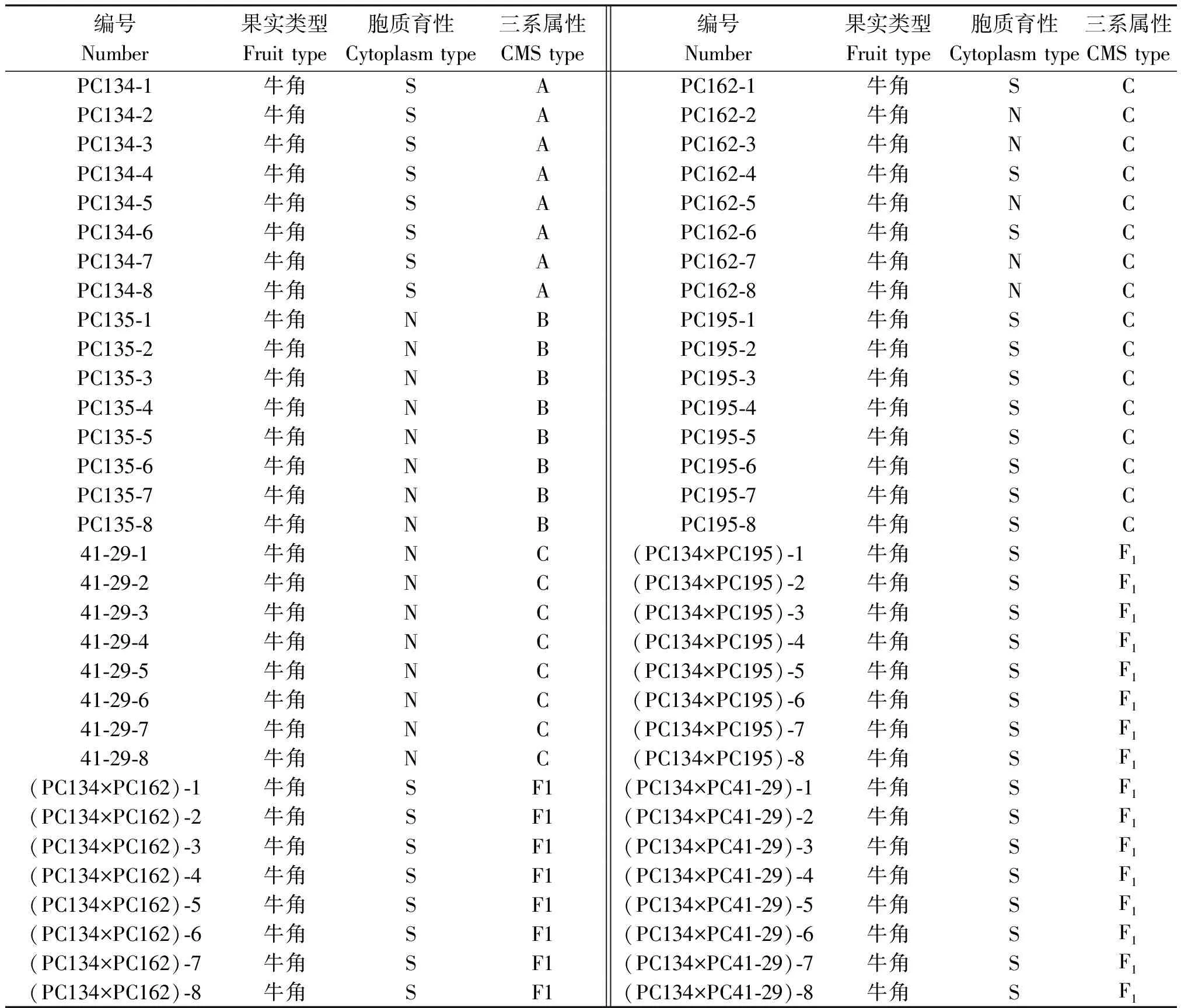
表1 辣椒胞质雄性不育系PC134、保持系PC135、恢复系PC162、PC195、41-29及其杂交后代的细胞质育性检测Tab.1 Detection of cytoplasm type of sterile line PC134, maintainer line PC135,restorer line PC162, PC195,41-29 and their hybridization progenies in pepper CMS
2 结果与分析
2.1 辣椒胞质雄性不育系、保持系、恢复系及其F1杂交种的细胞质育性检测结果
利用LGC公司的SNPline检测平台,针对辣椒胞质雄性不育系PC134、保持系PC135、恢复系PC162、PC195、41-29、F1杂交种及其他类型辣椒的细胞质育性检测结果表明,除少数几份样品未能检测成功外,其余待检测材料的细胞质育性可以清楚地分为两类,不育细胞质(S)偏向X轴,而可育细胞质(N)偏向Y轴。由表1可以看出,不育系PC134及其F1杂交后代的细胞质育性均为不育细胞质(S);恢复系41-29和保持系PC135为可育细胞质(N),与预期试验结果相吻合,这表明SCAR130标记被成功地转化为KASP130标记。恢复系PC162的细胞质育性发生了分离,既有不育细胞质(S),又有可育细胞质(N)。在荧光定量PCR仪LC480上的检测结果与LGC平台的结果相同,从而证明了KASP130标记的可靠性(图1)。
2.2 KASP130标记对其余类型辣椒材料的细胞质育性检测结果
为了检测KASP130标记在其余辣椒类型的适用性,利用LGC公司的SNPline检测系统和平台,对部分朝天椒、艳椒、泰辣、线椒的细胞质育性检测结果表明(表2),KASP130标记同样表现可靠,展示出良好的检测结果,除了朝天椒PC237的细胞质育性分离外,其余材料后代的细胞质育性均表现一致,表现为不育细胞质(S)或可育细胞质(N)。

A.荧光定量PCR仪LC480基因分型结果(荧光散点图);B. LGC公司SNPline平台基因分型结果(荧光散点图)。偏向X轴的蓝色点表示所检测样品为FAM基因型,表示细胞质不育(S);偏向Y轴的绿色点表示所检测样品为VIC基因型,表示细胞质可育(N)。A. Genotyping results (fluorescence scatter plot) in Real time PCR machine LC480; B. Genotyping results (fluorescence scatter plot) in SNPline genotyping platform of LGC. The blue spots towards the X-axis means FAM genotype, indicating sterile type cytoplasm (S); The green spots towards the Y-axis means VIC genotype, indicating fertile type cytoplasm (N).
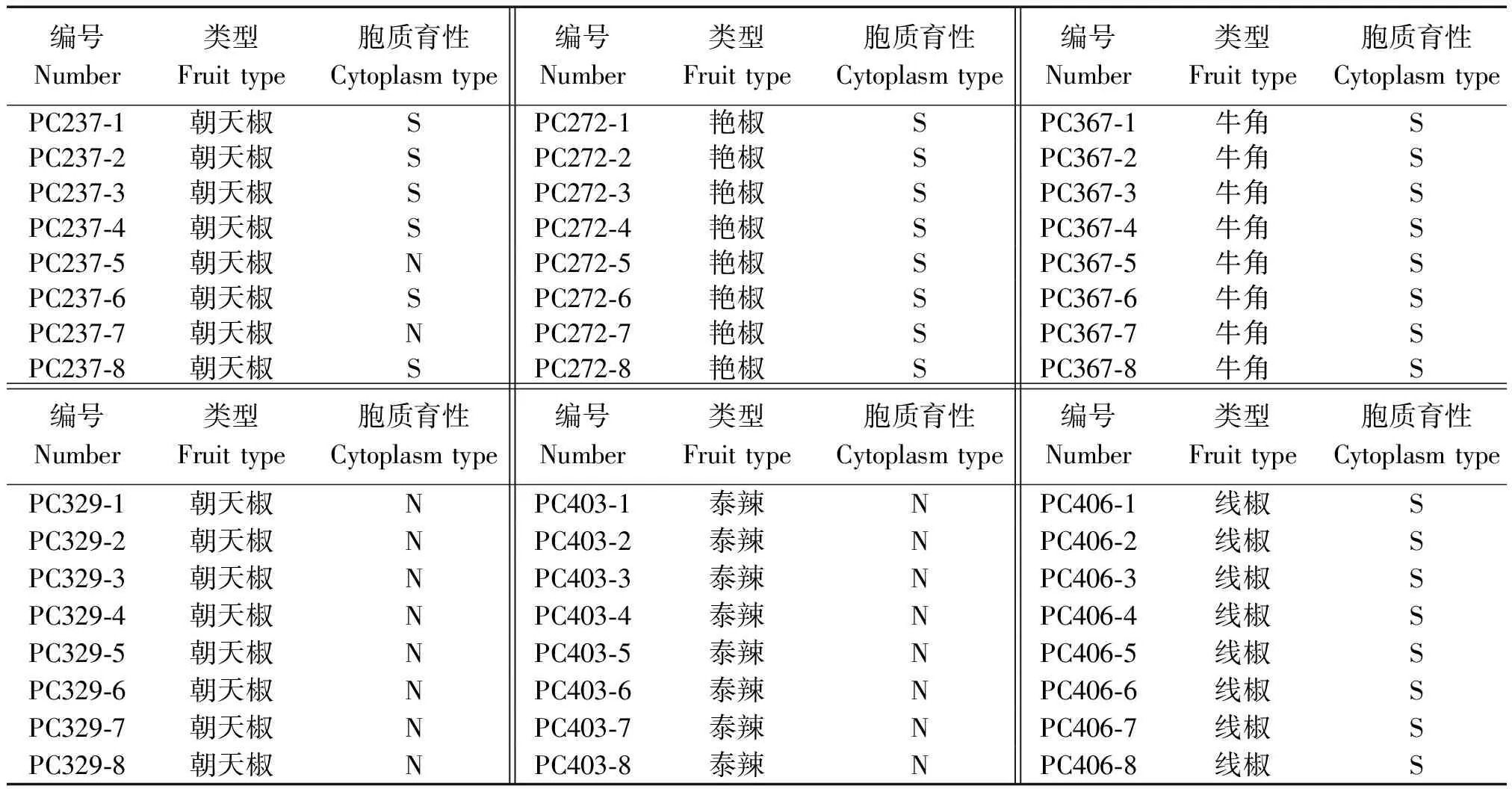
编号Number类型Fruit type胞质育性Cytoplasm type编号Number类型Fruit type胞质育性Cytoplasm type编号Number类型Fruit type胞质育性Cytoplasm typePC237-1朝天椒SPC272-1艳椒SPC367-1牛角SPC237-2朝天椒SPC272-2艳椒SPC367-2牛角SPC237-3朝天椒SPC272-3艳椒SPC367-3牛角SPC237-4朝天椒SPC272-4艳椒SPC367-4牛角SPC237-5朝天椒NPC272-5艳椒SPC367-5牛角SPC237-6朝天椒SPC272-6艳椒SPC367-6牛角SPC237-7朝天椒NPC272-7艳椒SPC367-7牛角SPC237-8朝天椒SPC272-8艳椒SPC367-8牛角S编号Number类型Fruit type胞质育性Cytoplasm type编号Number类型Fruit type胞质育性Cytoplasm type编号Number类型Fruit type胞质育性Cytoplasm typePC329-1朝天椒NPC403-1泰辣NPC406-1线椒SPC329-2朝天椒NPC403-2泰辣NPC406-2线椒SPC329-3朝天椒NPC403-3泰辣NPC406-3线椒SPC329-4朝天椒NPC403-4泰辣NPC406-4线椒SPC329-5朝天椒NPC403-5泰辣NPC406-5线椒SPC329-6朝天椒NPC403-6泰辣NPC406-6线椒SPC329-7朝天椒NPC403-7泰辣NPC406-7线椒SPC329-8朝天椒NPC403-8泰辣NPC406-8线椒S
2.3 KASP130标记在辣椒不育系及相应保持系选育中的实际应用
在进一步的研究中,为了验证KASP130标记在辣椒不育系及其保持系辅助选择中的实际应用效果,选择了发生细胞质育性分离的PC30朝天椒作为研究对象,利用F2分离后代中细胞质育性为N的可育单株与细胞质育性为S的不育单株进行杂交,经过几代的回交转育,最终转育成功,分别获得了几株不育系及其对应的保持系(表3),进一步说明了KASP130标记在不育系及其相应保持系的分子标记辅助选育中具有良好的效果。
3 结论与讨论
辣椒胞质雄性不育CMS作为质核互作型雄性不育系统,由不育系,保持系和恢复系组成,三者缺一不可。明确地知道和鉴定出材料的细胞质类型,在整个辣椒胞质雄性不育三系杂交系统中是非常重要的一环。利用分子标记来鉴定辣椒育种材料的细胞质类型,可以减少工作量,更有目的地配制杂交组合,特别对保持系的选育更有意义。虽然根据辣椒胞质雄性不育系CMS与保持系的线粒体序列的差异开发了一系列与辣椒胞质不育基因相关的分子标记,如Kim等[4-5]开发出与不育基因相关的SCAR标记coxII和 Watp6-2,并分离和克隆了胞质不育嵌合基因orf456[6],随后Gulyas等[7]在辣椒胞质不育系线粒体coxII下游发现1个新的嵌合基因orf507。Jo等[8]根据辣椒线粒体中来源于叶绿体的一个基因片段的缺失设计了1个新的雄性不育相关标记 accD-U。魏兵强等[9]利用RAPD技术筛选得到与 CMS 不育基因连锁的 BH19-S900 标记,并将其转化为共显性的 SCAR 标记。这些标记为不育系的分子标记辅助育种奠定了基础。但由于辣椒基因组的大量复制而存在大量重复序列和遗传背景的不同,这些标记并不能总是准确反映辣椒的育性变化,造成在具体应用上存在一定的局限性。Ji等[11]利用SRAP技术根据辣椒不育系线粒体基因组上相比保持系和恢复系有1个10 bp的缺失开发的SCAR130标记,克服了以往雄性不育分子标记的局限性,扩增稳定,易于使用。

表3 细胞质育性分离朝天椒PC30后代的保持系选育和不育系转育Tab.3 Selection and maintainer line and transformation of sterile line towards fertility segregation progenies of pod pepper PC30
本研究针对SCAR130标记InDel位点设计引物,利用LGC公司KASP高通量SNP检测技术,成功地把SCAR130转化为KASP130标记,该标记与原来的SCAR130标记具有同等的检测效用,但具有KASP标记便于批量化、自动化、标准化的检测特点,特别适用于大量群体的高通量检测,并将其成功运用于辣椒材料不育系及其对应保持系的分子标记辅助选择研究。需要指出的是,本研究并没有像Ji等[11]研究中那样专门分离提取辣椒的线粒体基因组,而是直接用基因组DNA作为模板,但获得了相似的研究结果,这很可能是因为提取的基因组DNA已含有足够的线粒体DNA以供完成试验检测,从而进一步证明了KASP130标记的可靠性和准确性。此外,KASP130分子标记检测结果还表明,在少数几个辣椒材料的自交后代中如牛角椒PC163和朝天椒PC237中出现了细胞质育性分离的现象,既有不育细胞质(S),也有可育细胞质(N),这种现象产生的原因还有待进一步研究,推测可能与辣椒胞质雄性不育系的细胞质来源不同有关。
为了适应后基因组时代分子标记的高通量和快速检测,本研究把细胞质育性标记SCAR130成功地转化为KASP130分子标记,并成功应用于辣椒细胞质类型的检测,为其在辣椒三系杂交育种和制种上的规模化应用奠定了基础,也为今后类似分子标记转化为KASP标记提供了思路借鉴和参考。
致谢:感谢河南省农业科学院经济作物研究所花生研究室的郑铮博士在KASP基因分型中提供的技术指导和帮助。

