经皮微波消融治疗甲状腺良性结节的临床疗效研究
陈吉东,岳林先,熊晏群,顾 毅,陈 琴,吴 昊
1.四川省人民医院 超声医学科(成都 610072);2.四川省人民医院 手术室(成都 610072);3.四川省人民医院 血管甲状腺外科(成都 610072)
甲状腺结节中约90%为良性结节[1],由于颈部不适感及影响美观等原因需要治疗。传统外科手术切除虽是主要方法,但随着人们对外观美要求的提高,微创介入治疗受到越来越多人的青睐,尤其是女性患者[2]。目前临床上已经成功将经皮微波消融术(percutaneous microwave coagulation therapy,PMCT)技术从肝肿瘤拓展到甲状腺良性结节的治疗,且安全有效。常规超声(ultrasound, US)和采色多普勒超声(color doppler ultrasound,CDFI)能显示结节的位置和部分血流灌注信息,但对结节微循环灌注的敏感性和特异性低于增强超声(contrast enhanced ultrasound,CEUS)。CEUS能更好地显示结节治疗前的边界和范围,在消融中和消融后能更好地评估结节是否有残留,以及评估疗效。本文旨在对比分析CEUS和CDFI引导下PMCT治疗甲状腺良性结节的临床疗效与并发症,现报道如下。
1 资料与方法
1.1 临床资料
将2015年3月至 2016年10月在四川省人民医院行PMCT的236例甲状腺良性结节患者(共265枚结节)作为研究对象。CEUS组137名患者,共153枚结节,实性结节105枚,囊实混合性结节48枚;直径(4.1±1.3)cm,年龄(58.1±8.7)岁;CDFI组99名患者,共112枚结节,实性结节78枚,囊实混合性结节34枚;平均直径(3.9±1.2)cm,年龄(56.7±8.9)岁。纳入标准: 1)超声影像TI-RADS 3类结节,提示为良性,并经病理证实;2)患者拒绝或不能耐受外科手术;3)患者拒绝观察;4)患者存在与结节相关的不适症状或影响美观,要求治疗。排除标准: 1)影像提示有恶性可能,并经病理证实;2)巨大胸骨后甲状腺肿或大部分甲状腺结节位于胸骨后方而患者拒绝分次消融者;3)结节对侧声带功能不正常;4)严重凝血机制障碍和严重心肺疾病。消融前常规检查及评估:甲状腺US等影像、细胞学和(或)组织学病理学、甲状腺激素、喉镜检查、血常规、出凝血时间、心电图等检查。患者及家属签署知情同意书。
1.2 仪器与方法
南京康友医疗科技有限公司KY2000系列冷循环微波消融治疗仪,消融针为KY2450A型。意大利百盛公司Mylab Twice型超声诊断仪;穿刺细胞学和组织学分别采用日本TSK的23 G细胞活检针和18 G一次性全自动活检针行活检术。造影剂为Bracco公司的SonoVue。
CEUS组,采用LA522 探头(频率为 3~9 MHz),配备实时造影匹配成像技术,所有病灶造影时均选用相同的甲状腺造影模式。向SonoVue瓶中注入5 mL生理盐水备用,分3次使用,每次静脉推注1.2 mL, 然后立即推注生理盐水10 mL。患者仰卧位,充分暴露颈部。消融前CEUS确定结节的边界和内部活性部分,选择进针点和路径。常规吸氧、消毒、铺巾,局部浸润麻醉。采用小功率(25~30 W)并遵循由深到浅、由难到易的顺序及移动消融技术,直至消融范围覆盖整个结节。消融过程中,不能确定是否完全消融或消融边界不清时,立即推注1.2 mL造影剂,对有强化的部分再次消融;消融结束10 min后再次静推造影剂确认结节无增强,方可结束。
CDFI组,采用与CEUS组同等消融条件。US及CDFI采用LA523线阵探头(频率5~10 MHz),CDFI调节方式:调整取样框大小,以覆盖结节及周边5 mm范围为宜,彩色壁滤波<50 Hz,彩色血流速度为2.5~3.5 cm/s。适当调整血流增益至刚好小血管显现,避免明显外溢。嘱患者保持呼吸平静,储存动态图像。
准确记录两组每次消融的功率和时间。治疗后第3、12、24个月随访,所有病例均行CEUS评估,CEUS显示结节内部及边缘未见造影剂为“完全消融”,反之则为“未完全消融”。第3个月随访若有“未完全消融灶”则为“残留”,需再次治疗,第3个月后CEUS发现结节内部或边缘强化则为“复发”。疗效评估由10年以上工作经验的介入超声医师完成,结节的大小[测量结节的3枚最大直径a、b、c,并通过公式计算结节的体积V=πabc/6[3];CDFI评估结节血流丰富程度,参照Adler分级法[4];CEUS评估造影剂分布情况及增强强度[5]。症状评分采用(0~10)的视觉模拟量表;美观评分(标准:1级:不可触及肿块;2级:可触及但不可见;3级:仅在吞咽时可见;4级:结节轻易可见)由外科医生进行评估分级。结节缩小率=(治疗前体积-最后1次体积)/治疗前体积×100%]。
1.3 统计学方法
所有数据采用SPSS 21.0统计软件进行处理。两组病例的完全消融率、未完全消融率及复发率等计数资料比较采用2检验;两组患者结节体积变化比较采用重复测量数据的方差分析及LSD-t检验;两组患者消融治疗前后症状、美容评分比较采用秩和检验。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 两组患者消融后影像学的变化
治疗3个月后CEUS评估,两组完全消融率和未完全消融率差异均有统计学意义(表1、图1)(P<0.05)。

表1 两组结节消融后3个月CEUS示完全消融情况比较[n(%)]
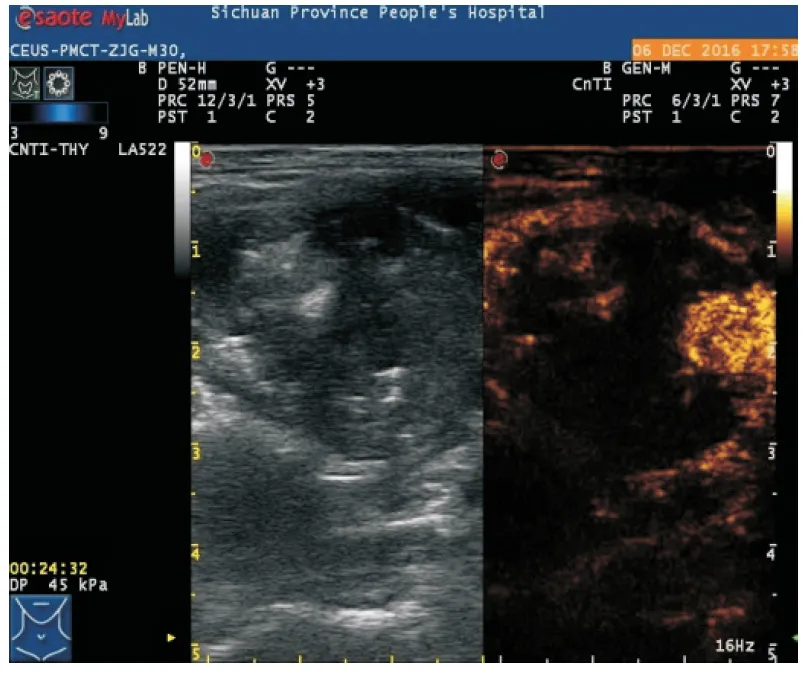
图1 甲状腺结节消融后CEUS声像图
注:消融3个月后,CEUS显示结节边缘可见呈高增强,且有“流动感”,说明有残留
治疗24个月后CEUS评估, CEUS组与CDFI组各有5枚和11枚结节边缘呈等或高增强,均为复发,组间差异有统计学意义(表2、图2)(P<0.05)。
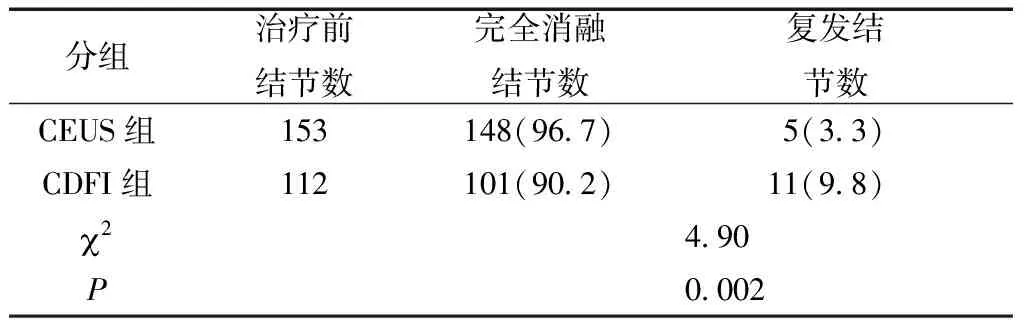
表2 两组结节消融后24个月CEUS示复发率情况比较[n(%)]
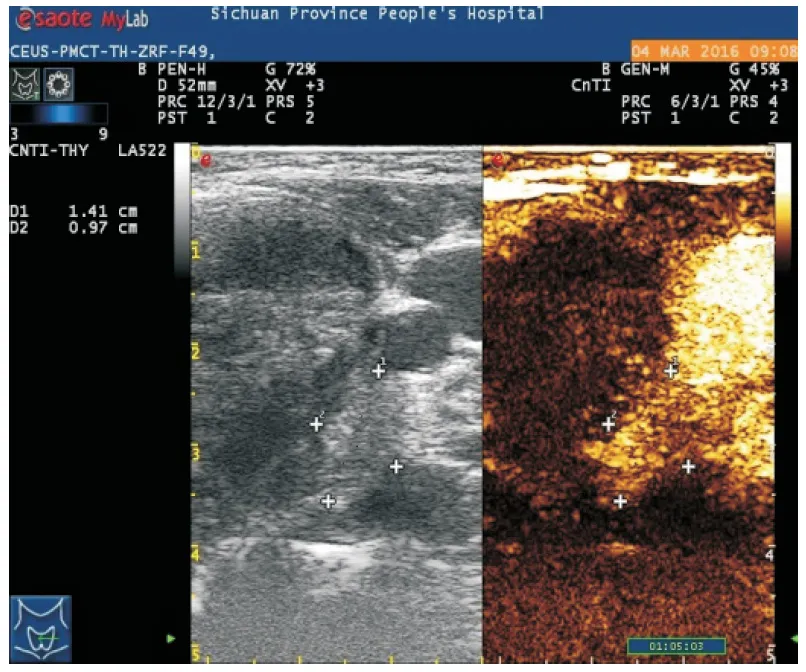
图2 甲状腺左侧叶结节消融后CEUS声像图
注:消融治疗24个月后,CEUS示结节边缘可见 高增强,提示为复发
2.2 两组结节消融后体积变化比较
消融后3、12及24个月两组结节体积均有不同程度缩小,组间比较差异有统计学意义(P<0.05) (表3)。CEUS组VRR分别为36.3%、64.1%和86.7%,高于CDFI组的29.7%、55.2%和78.7%。
2.3 两组患者消融前后症状及美容评分结果
两组消融前后症状及美容评分比较差异均无统计学意义(P>0.05)(表4)。
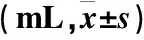
表3 两组结节消融前后体积变化比较
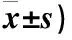
表4 两组患者消融前后症状及美容评分比较(分,
2.4 实验室检查结果
两组间患者年龄、性别、结节大小差异无统计学意义(P>0.05),两组所有病例消融前后甲状腺激素指标无明显变化,组间比较差异无统计学意义(P>0.05)(表5)。
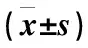
表5 两组结节消融前后甲状腺激素水平比较
2.5 并发症情况
CEUS组消融中自觉轻微疼痛不适共32例,可耐受,消融停止后缓解;消融后声嘶3例,2例1周后声音恢复正常,喉镜显示双侧声带活动度正常,1例2月恢复,喉镜显示为对侧代偿。CDFI组消融中自觉轻微疼痛不适共28例,消融停止后缓解;消融中失声1例,消融后声音嘶哑4例,最多3个月声音恢复,喉镜显示为对侧代偿。两组均无其他严重并发症。CEUS发生并发症概率较CDFI低,差异有统计学意义(2=7.67,P=0.029)。
3 讨论
目前消融技术已广泛使用[6-9],其原理是高温使病灶细胞的蛋白质变性凝固,坏死组织被机体的吞噬细胞吞噬,从而达到消灭结节乃至消失的目的。微波优点是对结节摧毁范围大、耗时短,且治疗甲状腺良性结节疗效显著,王淑荣等[10]PMCT治疗912个结节,术后6个月,实性、混合性及囊性结节容积缩减率分别为(61±50)%、(81±33)%、(89±46)%。本研究两组病例的特点是结节体积较大,血供丰富,故选择PMCT尤为重要。消融后3个月后疗效评估,CEUS完全消融率高于CDFI组。消融后3、12和24个月CEUS组的VRR均高于CDFI组。PMCT治疗甲状腺良性结节疗效好,且不影响甲状腺功能,与霍金龙等[11]研究一致。
3.1 CEUS在消融前评估中的作用
US及CEUS等技术[5,12]对于边界清楚、无微小钙化等结节可基本确定为良性,可辅助细胞学或组织学活检术来提高诊断的准确性。两组病例265枚结节均经上述影像学及病理学证实为良性结节,以免造成误诊。治疗前CEUS评估甲状腺结节情况,血供丰富的区域是消融重点,较CDFI获得更多的微循环灌注信息。SonoVue为第二代造影剂,只在血管内停留不进入胞间隙,能更准确地反映组织的血流灌注状态,能连续、实时、动态地观测病变组织的血流灌注状态,在临床肿瘤的诊断和鉴别诊断中已广泛应用。US引导下的PMCT比其他影像引导应用更广泛,可实时动态观察结节,从不同切面和角度监测。US虽可清楚显示结节及针尖,但不能显示结节内血供状态,若仅使用US引导则会使结节的残留机会大大增加。
3.2 CEUS在消融中的作用
PMCT治疗甲状腺结节的目的是完全灭活结节,但结节边缘残留是复发的重要因素之一。消融时气体干扰,US和CDFI无法清晰显示消融后的几何立体图形,则可能致使消融不彻底。CEUS受气体的干扰相对较小,可清晰显示结节边界或首次消融后坏死范围,判断消融边界是否残留活性组织,避免遗漏。本研究中,消融后10 min分别行CEUS和CDFI评估,CEUS组23枚结节边缘有造影剂增强(图1),即刻针对这些残留部分进行补充治疗;CDFI组有12枚结节边缘有彩色血流信号,也即刻补充治疗,说明CEUS发现微小血管比CDFI更敏感。
3.3 CEUS在消融后疗效评估中的作用
本研究中,3个月后CEUS评估,CEUS组和CDFI组未完全消融率分别为4.6%和12.5%;24个月后,CEUS组和CDFI组复发率分别为率3.3%和9.8%(图2);说明CEUS发现微小血管比CDFI更加敏感,CEUS 的应用弥补了US和CDFI的不足,提高了PMCT的消融率,是更好的评估手段。
3.4 CEUS能有效较少并发症的发生率[13]
并发症发生原因可能包含以下几点:1)固定位置烧灼时间过长。2)显示不清盲目反复多次进针增加损伤的机会。3)由于想达到满意消融效果,同一位置反复烧灼。CEUS引导下能更好显示结节具有活性部分,更加明确、清晰,从而以最少的进针次数达到完全消融的目的,避免多次、反复进针带来的并发症等。避免反复多次对同一部位烧灼,较少碳化范围,有利于结节更好更快被机体吞噬细胞吞噬。CEUS在一定程度上提高了PMCT的安全性和可行性,从而为临床广泛使用。本研究中,CEUS并发症发生率较CDFI组明显减少:CEUS组仅有1例由于消融后周围炎症反应引起喉返神经损伤,消融中无直接损伤喉返神经的病例;而CDFI组有1例消融中直接损伤喉返神经和3例消融后炎性反应引起喉返神经损伤。本研究不足之处在于随访时间较短,未能行多因素分析。
综上所述,CEUS在消融前、消融中和消融后起到了提高完全消融率及较少并发症的作用,具有临床应用价值。