粘红酵母菌剂对花生生长及土壤细菌群落的影响
李 想,巫杨捷,张 健,张梦露,成 硕,马兰青,薛飞燕
(农业农村部华北都市农业重点实验室,北京农学院 生物与资源环境学院,北京 102206)
中国花生种植范围广其年总产达1 500万 t,居世界第一位[1-2]。花生在生长发育过程中,施用微生物肥料可以改善土壤肥力,提高花生产量[3-4]。
微生物菌剂种类繁多、功能多样,在农业生产中应用潜力巨大[5-6]。微生物菌剂进入土壤后与土壤的微生物相互作用,不仅促进农作物生长,也能对土壤微生物群落产生有益影响[7-8],如补充土壤有益微生物[9]、增强植物营养元素吸收[10]、减少土壤有害残余物质[11]。
粘红酵母(Rhodotorulaglutinis)作为一种用于生物防治的拮抗菌,具有拮抗效果好且不产生毒素的特点[12]。课题组前期工作也表明粘红酵母对大豆[13]、蓖麻[14]和油菜[15]等植物生长发育有促进作用,并开展了粘红酵母菌剂作用机理的探索工作。本研究通过Illumina Miseq高通量测序技术,结合相关生物信息学方法,分析土壤细菌16S rDNA基因V3~V4区域,探究施用粘红酵母菌剂对花生种植及土壤细菌群落的影响,为揭示其作用机理提供基础。
1 材料与方法
1.1 材 料
粘红酵母菌种由农业农村部华北都市农业重点实验室保藏,供施要求YPD培养基30 ℃培养至菌体浓度OD600约为0.6。花生种子购买于昌平种子站。
1.2 方 法
1.2.1 花生种植及菌剂施用试验方法 试验地点设在北京农学院大学科技园试验田。花生种植面积为67 m2,种植试验采取模块交叉排列设计如图1,每个模块播种花生36穴,每穴播种经温水浸泡过夜预处理的花生种子1粒。菌剂试验组(MF)在每穴播种后滴加2 mL粘红酵母菌液,空白对照组(CK)滴加2 mL水。花生种子播种21 d后统计出苗率和测量幼苗株高。花生种子播种4个月后采收花生果实并采集土壤样品。
图1 花生种植及菌剂施用设计图Fig.1 Peanut planting and R. glutinis application design
1.2.2 花生农艺性状测量 测量幼苗株高、植株湿重、果实干重及出苗数,通过测量的数据计算出苗率和产量。
1.2.3 土壤细菌群落分析方法 1) 样品采集:花生收获时采集土样,采集时每个模块任选一株花生先去除地表面覆盖物和1~2 cm表土,再采集0~20 cm耕层土,按照MF和CK分别混合,置于4 ℃冰盒保存。2)预处理:称取200 mg的样品,放入灭菌的2 mL离心管中,加入1 mL的70%乙醇,震荡混匀,10 000 r/m室温离心3 min,弃置上层液体。加入1×PBS溶液,震荡混匀,10 000 r/m室温离心3 min,弃置上层液体。将2 mL离心管倒置于吸水纸上1 min,直至没有液体流出。将样品管放入55 ℃烘箱10 min。3)总DNA提取:参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的使用说明书提取土壤样品DNA,琼脂糖凝胶电泳检测DNA完整性。4)PCR扩增:以样品总DNA为模板,设计上下游引物341F-CCCTACACGACGCTCTTCCGATCTGCCT ACGGGNGGCWGCAG和805R-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHV GGGTATCTAATCC进行PCR扩增16S rDNA的V3~V4区,琼脂糖凝胶电泳检测扩增产物。5) DNA纯化回收:PCR扩增产物用0.6倍的磁珠(Agencourt AMPure XP)处理,利用Qubit 2.0 DNA检测试剂盒对回收的DNA精确定量和均一化。6)上机测序及数据分析:委托生工生物工程(上海)股份有限公司完成,测序平台为 Miseq 2×300 bp,测序数据平均2万条;所得数据经质控分析后,通过韦恩图呈现样本OUT(operational taxonomic unit)共有和独有情况;通过PCA图呈现样本属水平上物种结构及丰度;通过与KEGG数据库对比,比较功能基因丰度差异;所用16S细菌古菌核糖体数据库包括RDP数据库(http://rdp.cme.msu.edu/misc/resources.jsp)、Silva数据库(http://www.arb-silva.de/)和NCBI 16S数据库(http://ncbi.nlm.nih.gov/),所用FGR功能基因数据库为RDP整理来源于GenBank(http://fungene.cme.msu.edu/)。
采用SPSS 17.0对试验数据进行统计,t检验进行差异显著性分析。
2 结果与分析
2.1 粘红酵母菌剂对花生种植农艺性状的影响
如图2所示,花生出苗率均在90%以上,施用菌剂可使花生种子出苗率显著提高2.7%(0.05>P>0.01)(图2-A);主茎高度在一定程度上可以反映花生植株个体生育状况,施用菌剂对花生幼苗株高未达到显著影响(P>0.05)(图2-B);施用菌剂对花生植株质量积累无显著影响(P>0.05),但对照组相比采收时每株花生全株湿重可提高30%以上(图2-C);施用菌剂每株花生的果实干重达41 g,与对照组相比显著提高了28%(0.05>P>0.01)(图2-D),花生产量显著提高;采收时对照组的植株枝叶更加繁茂,而菌肥处理组的果实更加丰硕(图2-E)。
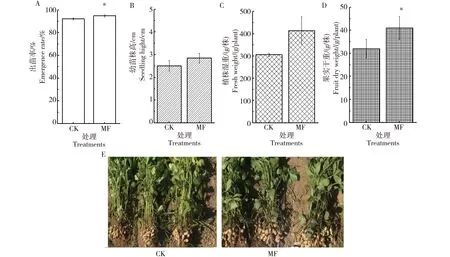
A为种子出苗率,B为幼苗株高,C为植株湿重,D为果实干重,E为采收时的植株与果实;CK为空白对照组,MF为菌剂试验组;*表示存在显著性差异(0.05>P>0.01)Note: A is the seedling emergence rate. B is the plant height. C is the fresh weight of the whole plant. D is the fruit dry weight. E is the plant and peanut fruit at harvest. CK is a blank control group, while MF is R. glutinis application group. “*” indicates a significant difference (0.05>P>0.01)图2 粘红酵母菌剂对花生农艺性状的影响Fig.2 Effect of Rhodotorula glutinis on agronomic traits of peanut
2.2 粘红酵母菌剂对花生土壤细菌群落的影响
MF和CK土壤基因组DNA提取结果经琼脂糖凝胶电泳检测结果如图3-A,完整性均良好。以土壤基因组为模板设计引物进行PCR扩增获得片段长度(包括引物等)如图3-B,条带单一浓度较高。
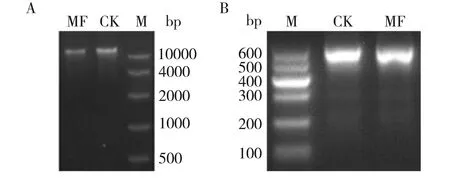
A为土壤样品总DNA检测结果,B为PCR扩增产物检测结果;CK为空白对照组,MF为菌剂试验组,M为标准分子量DNA MarkerNote: A is the total DNA ofsoil samples, while B is the PCR amplification products. CK is a blank control group, while MF is R. glutinis application group. M is the standard molecular weight DNA Marker图3 琼脂糖凝胶检测DNA结果Fig.3 Results of the DNA analysis
MF和CK样品经Illumina MiSeq高通量测序的原始数据通过拼接过滤后获得优质序列分别为55 992条和48 328条,并进行OTU分析、细菌群落组成、代谢功能预测及差异比较,如图4-6。

注: 所用数据为经过质控后的优质序列,序列相似性高于97%定义为一个OUTNote: The qualified sequence with the similarity higher than 97% was defined as an OTU图4 OTU分析Venn图Fig.4 Venn diagram of OTU analysis

注: CK为空白对照组,MF为菌剂试验组;满足相似度大于90%且覆盖率大于90%的序列进行分类,不满足条件的序列归为unclssified;颜色对应不同物种名称,不同色块宽度表示不同物种相对丰度比例,为了展示效果,只显示丰度最高的前50个物种分类信息,丰度低的物种分类合并成Note:CK is a blank control group, while MF is R. glutinis application group. Sequences with both similarity and coverage rate higher than 90% were classified, otherwise were treated as unclssified. Different colors indicated different species names and different width of the corresponding colors indicates the relative abundance. Only the top 50 species with the high abundance were showed while the rest with low abundance were bracketed as other图5 属水平细菌群落组成Fig.5 Genus-level taxonomic composition of the bacterial community
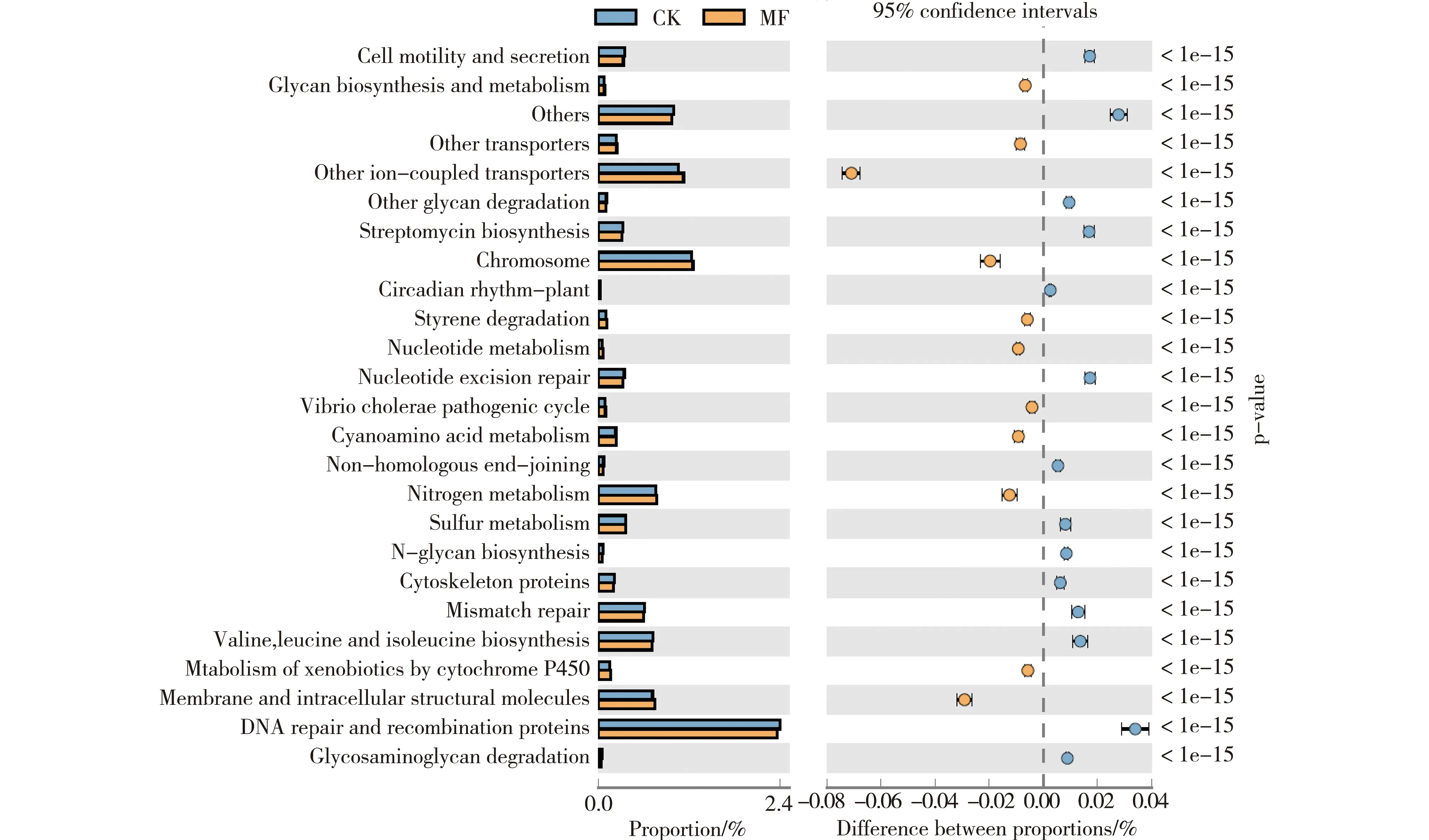
注: CK为空白对照组,MF为菌剂试验组;图左边为不同功能丰度在两个样品组的丰度比例,中间为95%置信度区间内功能丰度差异比例,右边为P值,P值<0.05,表示差异显著Note:CK is a blank control group, while MF is R. glutinis application group. The left side of the figure shows the abundance ratio of the different functional abundances in the two sample groups. The middle is the functional abundance difference ratio in the 95% confidence inter. The right side is the p value. P<0.05 indicating significant difference图6 细菌群落代谢功能预测及差异比较结果Fig.6 Bacterial community metabolic function prediction and comparison of differences
所有样本优质序列进行聚类,并统计分析97%相似水平的OTU。如图4,施肥试验组土壤中共有6 594个OTUs,对照组土壤共有6 011个OTUs,即施肥组土壤样品的细菌种类多于空白对照组。施肥试验组和空白对照组共有OTUs为2 817个,占比(分别42.7%和46.9%)均不足50%,表明施用粘红酵母菌剂对花生土壤细菌群落结构变化影响较大。
为了得到每个OUT对应的物种分类信息,利用blastn将OUT序列与对应数据库进行比对获得比对结果,对比满足相似度大于90%且覆盖率大于90%的序列进行分类,不满足条件的序列归为unclssified。
如图5属水平细菌群落结构分布结果表明,已经明确分类且相对丰度前4位的菌属为Gp6、芽单胞菌属(Gemmatimonas)、鞘氨醇单胞菌属(Sphingomonas)、微小杆菌属(Exiguobacterium),占检测总菌属大于20%。菌剂施用MF组和空白对照CK组在细菌群落组成上有差异, MF组较CK组在气单胞菌属(Aeromonas) 、溶杆菌属(Lysobacter)和藤黄单胞菌(Luteimonas)的丰度方面显著增加;微小杆菌属(Exiguobacterium) 、柠檬酸细菌属(citrobacter)、假单胞菌属(Pseudomonas)和不动细菌属(Acinetobacter)明显增加;Gp6、Subdivision3_genera_incertae_sedis和Gp4明显减少。
基于16S rDNA序列预测土壤细菌群落KEGG Pathway的功能基因,比较MF和CK样品细菌群落代谢功能预测及差异如图6,结果表明两组样品p值最低的25个功能丰度差异极显著,丰度差异比例较大的是离子耦合转运体(other ion-coulped transporters)、细胞膜及胞内结构分子(Membrane and intracellular structural molecules)和DNA修复及重组蛋白功能(DNA repair and recombination proteins)。离子转运体功能的缺失、细胞膜结构改变、DNA修复等将会影响植物生长发育、生理代谢、吸收土壤养分能力、抗逆能力以及对各种遗传变异的应答能力等[16-17]。
3 讨论与结论
施用微生物菌肥可以改善土壤理化状况,增强土地肥力,促进花生对养分的吸收,从而达到提高产量的目的[18]。马文彬等[19]通过施用植物促生菌,对甘草的生长有明显的促进作用。赵柏霞等[20]证明生物菌剂可以促进根系的生长和植株干重的增加。本试验通过添加粘红酵母菌剂,证明粘红酵母对花生的种子出苗率、株高、植株湿重、果实干重及产量均产生了促进作用,植株湿重包括植株质量和果实质量,湿重虽然没有显著提高,但是对花生出芽率、果实干重和产量的影响较为明显,说明粘红酵母菌剂对花生生长和产量存在促进作用。
本试验采用的Illumina Miseq高通量测序技术是目前应用最普遍的技术,与传统琼脂培养基培养、Biolog微平板法和磷脂脂肪酸(PLFA)法[21]相比,具有高通量、高灵敏度、高准确性和低运行成本等特点[22]。微生物群落的丰度与多样性可以维持土壤的健康与质量,多样性减少可能会造成土壤的病害频发[23]。有机肥进入土壤后会对土壤微生物群落结构造成影响,土壤微生物在土壤有机质的降解和土壤养分(C、N、P、S)的循环中发挥着重要作用[24]。土壤微生物的群落结构的变化会影响土壤微生物功能特性的改变[25]。本试验共得到55 992条优质序列,6 594个OTUs,较对照组相比,细菌种类更加丰富。其中芽单胞菌属(Gemmatimonas)出现在有机质含量较高的土壤中[26]。假单胞菌属(Pseudomonas)可以根据自身需要同化土壤中的磷[27]。微小杆菌属(Exiguobacterium)作为氨化菌,可以使土壤中的有机氮降解并提高肥力[28]。芮文鸿等[29]证明Gp6、芽单胞菌属(Gemmatimonas)、鞘氨醇单胞菌属(Sphingomonas)以及假单胞菌属(Pseudomonas)与土壤有机质之间存在一定关联,并对土壤养分有一定影响和调控。
本研究通过传统的花生种植方式,在栽培过程中添加粘红酵母菌剂。结果表明粘红酵母菌剂不仅对花生的农艺性状有促进作用,也可以增加种植土壤的细菌群落结构和多样性。

