雾霾环境下流感病毒感染小鼠致炎模型系统评价
敏娜, 吴振起, 刘光华
环境污染威胁人类的健康,大气污染是环境污染中最重要的组成部分,而大气颗粒物是大气污染的主要组成部分,大气颗粒物对人体具有毒性强、危害大的特性,可导致各个系统发病率的升高,尤其是以PM2.5为主引发的呼吸系统疾病[1]。PM2.5的颗粒面积较大且密度较低,在空气中的浮力较大,因此PM2.5可以长期滞留在空气中。且PM2.5易吸附空气中的重金属、微生物等有毒物质,PM2.5及其吸附的有毒物质可以通过呼吸道途径被人体吸入,因此PM2.5可导致肺炎、慢性阻塞性肺疾病、支气管炎等多种呼吸系统疾病[2]。
流感病毒(influenza virus,IV)是一类具有高发病率和高死亡率的传染性病毒,其所致感染性疾病可引起全球范围内流行。亦为引起人类上呼吸道感染、肺炎等呼吸系统疾病的主要病原之一[3]。当前国内雾霾天气频繁出现,儿童、老年人等弱势群体IV感染率明显升高[4]。IV极易附着于PM2.5等颗粒侵袭人体,造成鼻黏膜损伤。因此本研究通过构建雾霾及IV感染小鼠模型,采用酶联免疫吸附实验(ELISA)方法检测小鼠血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、鼻咽灌洗液中分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)的含量,免疫组织化学SP法及Western-blot法检测小鼠肺中肺表面活性物质相关蛋白A(surfactant-associated protein A,SP-A)的表达,探讨3种造模方式对肺部造成不同程度的损伤,由此来进一步研究其致炎机制。
1 材料与方法
1.1 材料
1.1.1 病毒株 甲型IV A/FM1/47(H1N1)小鼠适应株,病毒株由辽宁中医药大学附属医院提供。
1.1.2 实验动物 4~6周龄SPF级BALB/c小鼠72只,雌雄各半,平均体质量(18±2)g,购自辽宁长生生物技术有限公司[SCXK(辽)2013-0009],在辽宁中医药大学动物实验中心饲养,水和饲料经高温高压消毒后使用。饲养环境:室温20~22 ℃,湿度(50±2)%,12 h/12 h明暗周期,分笼饲养,正常组与感染组小鼠分房饲养。
1.1.3 PM2.5颗粒提取及悬液制备 将附有PM2.5颗粒的玻璃纤维滤膜剪成1 cm×3 cm大小,放入250 mL烧杯;加入无菌超纯水,低温超声1 h×3次,每隔5 min轻轻摇晃烧杯,以混匀悬浮液;将烧杯中的悬浮液倒至已称重的离心管中;然后用超纯水清洗留在烧杯中的膜2~3次,收集悬浮液至同一个离心管中;使用6层纱布过滤悬液,低温冷冻干燥离心管,称重,计算收获颗粒物质量,回收颗粒于-20 ℃冰箱保存。根据实验小鼠的体重称取PM2.5颗粒物,于动物实验前一天用双蒸水配置细颗粒物混悬液,超声振荡混匀,4 ℃冰箱保存备用,使用前再次超声振荡混匀。
1.1.4 实验试剂 ELISA试剂盒购自mlbio;sIgA(货号:ml001917)、TNF-α(货号:ml002095);二氨基联苯胺显色试剂盒购自BOSTER(货号:AR1022);抗体购自BOSTER:SP-A(货号:BA2598),甘油醛-3-磷酸脱氢酶(货号:BA2913);链酶亲和素-碱性磷酸酶(兔IgG,货号:SA1052),免疫印迹试剂盒(兔IgG,货号:EK1002)。
1.1.5 实验仪器 TP1020型自动组织脱水机(LEICA),BX50F4型显微镜(OLYMPUS),RM2135型切片机(LEICA),EG1150型石蜡包埋机(LEICA),酶标仪(Thermo),低温高速离心机(Heraeus),蛋白成像和定量分析系统(Proteinsimple),电泳仪(Bio-Rad),Trans-Blot SD半干转印系统(Bio-Rad)。
1.2 方法
1.2.1 动物分组 将72只BALB/c小鼠按随机数字表法分为正常组、PM2.5感染组、IV感染组和联合感染组,每组18只。对各组小鼠称重并标号,适应性喂养1 d。
1.2.2 模型制备 将正常组小鼠置于温度湿度适宜的无菌空间,然后对其余各组小鼠进行造模处理。造模第1天,将PM2.5感染组、联合感染组放入人工气候培养箱中湿度(80±5)%,温度(22±2)℃ 2 h,取出后用8.9 g/L PM2.5混悬液进行气管滴注(50 μL/只),隔日1次,共3次。操作方法依照文献[5]。造模第7天,IV感染组、联合感染组采用乙醚麻醉,通过鼻腔滴注途径接种甲型IV FM1株,剂量为0.1 mL/只。
1.2.3 标本采集 于造模后第3、7、10天采集标本,每组取6只,称重后,摘除眼球取血,接储存于促凝管中,后放入离心机中以5 000 r/min离心5 min(离心半径9.5 cm),离心后取上层血清,存于EP管中。予小鼠行颈椎脱臼处死,无菌打开胸腔,暴露气管,用5 mL注射器(针头磨钝圆)向下顺插入气管,结扎,抽取1 mL生理盐水向上冲洗鼻咽部,收集从鼻部流出的冲洗液,重复2次,存于EP管中。放入-80 ℃冰箱中冷冻以备检测。
1.2.4 光镜下病理组织学观察 用4%多聚甲醛固定的组织包埋成蜡块,切片机切成薄片约5 μm,苏木精-伊红染色后在光镜下观察肺组织病理学改变。
1.2.5 ELISA法检测小鼠血清TNF-α、鼻咽灌洗液sIgA表达水平 在感染后的第3、7、10天对小鼠进行摘眼球取血,离心后取上清液,置于-80 ℃冰箱冻存备用。按ELISA试剂盒说明书测定小鼠血清中TNF-α和鼻咽灌洗液中sIgA的表达。
1.2.6 免疫组织化学SP法检测小鼠肺组织SP-A的表达 取肺组织石蜡切片,采用SP免疫组织化学法检测目的蛋白的表达,分别滴加一抗(SP-A 1∶200),以磷酸盐缓冲液代替一抗作为阴性对照,二氨基联苯胺显色。采用BI2000医学图像分析系统对阳性结果进行分析,统一参数设定保持基线一致,测定平均光密度值(IOD/area),作半定量分析。
1.2.7 Western Blot法检测小鼠肺组织SP-A蛋白的表达 用总蛋白提取试剂提取总蛋白,离心取上清液,-20 ℃冰箱中保存。采用BCA试剂盒进行蛋白含量测定,用蒸馏水调整到统一浓度,提取液中加入5×十二烷基硫酸钠上样缓冲液,100 ℃变性10 min,蛋白上样每孔含10 μL,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转膜30 min,2%牛血清白蛋白室温封闭2 h。一抗室温孵育2 h,4 ℃过夜,三乙醇胺缓冲盐水溶液+吐温20(TBST)10 min/次洗膜(3次),二抗室温孵育1 h,TBST 10 min/次洗膜(3次)。化学发光,Fluor Chem Q蛋白质印迹,成像系统显色。

2 结果
2.1 肺组织光镜病理组织学观察 正常组小鼠肺泡、肺泡隔及肺泡囊形态较为完整,周围血管未见炎症细胞浸润(图1a,见封三)。PM2.5感染组小鼠可见少量炎性细胞浸润于肺组织,并可见其背膜增厚(图1b,见封三)。IV感染组小鼠肺泡内可见少量炎性细胞,支气管黏膜上皮水肿(图1c,见封三)。联合感染组小鼠肺泡、肺泡囊、肺泡管、肺泡隔等结构消失,肺泡间隔增厚,细支气管壁增厚,大量炎症细胞浸润,肺泡壁毛细血管扩张(图1d,见封三)。
2.2 小鼠血清中TNF-α、鼻咽灌洗液中sIgA含量检测 分别见表1、2。

表1 各组小鼠血清TNF-α含量检测结果
注:与联合感染组比较,aP<0.05。
表1结果表明,小鼠感染后其血清中TNF-α含量均显著升高,并于第7天达到峰值。各感染组各时间点均高于正常组,差异有统计学意义(P<0.05)。第10天IV感染组TNF-α含量显著高于PM2.5感染组,差异有统计学意义(P<0.05),第3,7天两组比较差异无统计学意义(P>0.05)。联合感染组各时间点TNF-α含量显著高于PM2.5感染组和IV感染组,差异有统计学意义(P<0.05)。

表2 各组小鼠鼻咽灌洗液中sIgA含量检测结果
注:与联合感染组比较,aP<0.05。
表2结果表明,小鼠感染后其鼻咽灌洗液中sIgA含量均显著降低,且于第7天降到谷值。各感染组各时间点均低于正常组,差异有统计学意义(P<0.05)。IV感染组sIgA各时间点sIgA含量与PM2.5感染组比较差异无统计学意义(P>0.05)。联合感染组各时间点sIgA含量显著低于PM2.5感染组和IV感染组,差异有统计学意义(P<0.05)。
2.3 免疫组织化学SP法检测肺组织SP-A蛋白的表达 分别见表3和图2(见封三)。

表3 免疫组织化学SP法检测各组小鼠肺组织SP-A蛋白的表达
注:与联合感染组比较,aP<0.05。
表3结果表明,小鼠感染后其肺组织中SP-A蛋白的表达显著降低,并于第7天降到谷值。各感染组各时间点均低于正常组,差异有统计学意义(P<0.05)。IV感染组各时间点SP-A蛋白的表达与PM2.5感染组比较差异无统计学意义(P>0.05)。联合感染组各时间点SP-A蛋白的表达显著低于PM2.5感染组和IV感染组,差异有统计学意义(P<0.05)。
2.4 Western-blot检测SP-A蛋白表达水平 分别见表4和图3。

表4 Western-blot检测各组小鼠肺组织中SP-A蛋白的表达
注:与联合感染组比较,aP<0.05。
表4结果表明,小鼠感染后其肺组织中SP-A蛋白的表达显著降低,并于第7天降到谷值。各感染组各时间点均低于正常组,差异有统计学意义(P<0.05)。IV感染组各时间点SP-A蛋白的表达显著低于PM2.5感染组,差异有统计学意义(P<0.05)。联合感染组各时间点SP-A蛋白的表达显著低于PM2.5感染组和IV感染组,差异有统计学意义(P<0.05)。
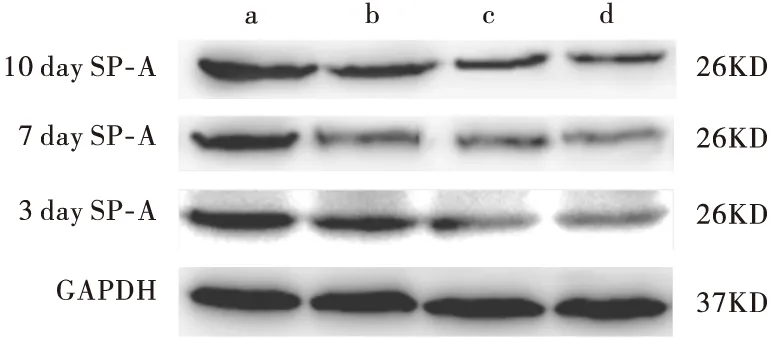
a:正常组,b:PM2.5感染组,c:IV感染组,d:联合感染组
3 讨论
流感是由一种由IV引发的急性呼吸道传染病。其传播途径主要有两种:人与人的接触或人与带有IV的物品接触。有研究表明,近年来IV患病率急剧上升可能与雾霾天气有关[6]。很多季节性的流感的爆发与雾霾天气有着密切的联系[7-8]。空气中的细颗粒物质(PM2.5)对肺组织的损伤可能导致肺部免疫力下降,进而更容易感染IV[9]。王璐璐等[10]通过建立并分析空气中的细颗粒物质对流感传播影响的动力学模型得出结论:空气中的细颗粒物质能加重流感的传播。雾霾是雾与霾的统称,雾霾包括悬浮在近地面空气中的气溶胶系统和空气中的灰尘、硫酸等有机碳氢化合物粒子组成[11]。雾霾的成因是气候条件和人类活动共同作用产生的。雾霾中的细颗粒物质已经成为一个检测空气污染指数的重要指标。研究显示,雾霾可以通过呼吸直接进入人体内部,黏附于人体的呼吸道及肺叶中,从而导致呼吸系统的损伤,进而诱发或加重流感等多种疾病[12]。
如今,雾霾已经成为了一种新的IV传播途径,其对IV传播的快速和广泛性已经受到了很多学者的关注。通过研究IV与雾霾联合作用于肺部具有重要的理论及现实意义。本研究通过比较IV感染和雾霾联合IV感染造模后,各组中肺组织、血清、灌洗液等指标的改变情况,分析雾霾联合IV造模的理论及现实意义。
黏膜免疫系统是机体抵抗IV的第一道防线,它不仅是一道防御的屏障,还参与了机体细胞免疫和体液免疫的过程[13]。sIgA是黏膜表面最重要的抗体,也是作为病毒感染的重要检测指标。大量研究表明,sIgA在IV感染的模型中呈低表达[14-16]。有研究表明,IV感染可加剧肺组织的炎症反应,TNF-α是一种重要的炎症因子,可协同白细胞介素-1作用于肺部炎性细胞因子,并产生多种细胞炎症因子(如白细胞介素-6、白细胞介素-8),从而启动炎症级联反应[17]。当TNF-α表达上调时,可诱发肺部白细胞迁移、肺内皮细胞活化,诱发或加重炎症反应。有研究表明,IV导致肺部病变的部分原因可能是TNF-α过度表达有关[18]。而炎症反应可能是抑制SP表达的重要因素。SP分为SP-A、-B、-C、-D四个成员,其中SP-A是SP中表达量最丰富的蛋白组分,已被证实是对抗呼吸道病原体和过敏原的重要宿主防御成分[19]。有研究表明,SP-A可以黏附IV,并可介导吞噬细胞黏附IV,此外SP-A还可以抑制IV的传染力和复制能力[20-22]。
本研究结果显示,各感染组小鼠鼻咽灌洗液中sIgA含量均下调,其中以PM2.5气管滴注联合IV感染小鼠sIgA含量下调最为显著,此结果初步提示PM2.5气管滴注联合IV感染小鼠的黏膜免疫能力降低。HE染色结果显示,与正常组比较,各感染组的肺组织均有不同程度的破坏,其中以PM2.5气管滴注联合IV感染小鼠中肺泡结构破坏程度最为显著且出现大量炎症细胞浸润,提示PM2.5可能会加剧肺组织的损伤并促进IV的感染,且肺组织损伤与炎症反应程度呈正相关。同时,各感染组小鼠血清中TNF-α的表达均上调,其中以PM2.5气管滴注联合IV感染小鼠血清中TNF-α的表达上调最为显著,于第7天达到峰值。免疫组织化学与Western Blot结果显示,各感染组小鼠肺组织内SP-A蛋白的表达显著下调,且PM2.5气管滴注联合IV感染小鼠效果最为显著。上述结果说明IV感染导致肺组织炎症反应加剧,TNF-α的表达上调,而炎症反应的加剧又抑制了SP-A蛋白的活性,导致机体对抗呼吸道病原体的能力进一步减弱。
综上所述,本试验分别从病理学、分子生物学角度共同说明:在采用PM2.5气管滴注联合IV感染对小鼠进行造模后,其成模的显著性高于单一IV造模。由于雾霾天气导致IV传播速度急剧上涨,所以采用PM2.5气管滴注联合IV感染对小鼠进行造模更具有理论研究价值及现实研究意义。为临床上预防和治疗流感提供了理论依据,其具体的机制有待进一步的研究。

