nAChRs对急性支气管哮喘小鼠肾上腺激素分泌的影响
贺素锦
(中国平煤神马集团职业病防治院 呼吸内科,河南 平顶山467000)
支气管哮喘是由多种细胞和细胞组分参与的以气道慢性炎症为主要病理机制的呼吸道疾患,常表现为咳嗽、反复或持续性喘息、胸闷气急,急性发作时可并发猝死、严重肺部感染、呼吸衰竭等[1,2]。 既往临床研究显示[3,4],气道慢性炎症发生时使支配肾上腺髓质的交感神经兴奋而释放乙酰胆碱(acetylcholine,ACh),肾上腺髓质嗜铬细胞(adrenM medullary chromafiin cells,AMCCs)的烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)被激活,Ca2+经细胞膜上活化的钙离子通道进入细胞内,使细胞内Ca2+浓度升高,促进去甲肾上腺素(noradrenaline,NA)、多巴胺(dopamine,DA)、肾上腺素(adrenaline,Adr)释放。Yu M 等[5]研究发现支气管哮喘患者肾上腺髓质nAChRs构成与健康对照组比较发生显著性变化,他们推测哮喘患者nAChRs的 α3、α4、α7、β4 亚基构成的变化可能与 AMCCs释放Adr有密切关系。为进一步证实Yu M等[5]的推测,本研究对172只小鼠进行体内实验及体外实验,旨在探讨nAChRs对急性支气管哮喘小鼠肾上腺激素分泌的影响,现报告如下。
1 材料与方法
1.1 实验动物与分组 选用购于上海斯莱克实验动物有限责任公司 (许可证号:SO XK(沪)2007-0005)的7周龄健康SPF级C57B/L雄性小鼠172只,单只体质量25~30g。小鼠饲养于动物实验室独立通气笼中,每笼5只,实验室室温维持在25℃,湿度维持在50%,所有小鼠光照12h/d。采用同种无菌饲料对所有小鼠进行投喂,饮水自由,术前禁食12h。采用随机数字表法将172只小鼠分为哮喘组(n=86)与对照组(n=86),两组小鼠一般资料比较差异无统计学意义(P>0.05)。本研究上报动物保护协会及医学伦理委员会并获得批准。
1.2 实验药物与试剂 氢氧化铝凝胶佐剂购于北京来福赛思科技有限公司;卵清白蛋白(OVA)购于上海斯信生物科技有限公司;ELISA试剂盒购于上海恒远生物科技有限公司;双蒸水购于上海乔羽生物科技有限公司;甲基牛扁碱购于上海起发实验试剂有限公司;免疫荧光染色试剂盒购于北京百奥莱博科技有限公司;碳酸盐包被缓冲液购于美国Agdia公司;酶标板购于上海晶安生物科技有限公司;Eppendorf移液枪购于北京卓信伟业科技有限公司;牛血清白蛋白购于上海恒远生物科技有限公司;98%浓硫酸购于上海皖科电子科技有限公司;苏木素购于北京酷来搏科技有限公司;1%盐酸溶液购于上海铭博生物科技有限公司;伊红购于上海远慕生物科技有限公司;梯度酒精购于北京雅康博生物科技有限公司;中性树胶购于成都麦卡希化工有限公司;10%甲醛溶液购于杭州新乔生物科技有限公司;二甲苯购于上海瑞剑生物科技有限公司。
1.3 实验方法与评价指标 体内实验:哮喘组小鼠实验第0、7d腹腔注射200 ul含1 mg氢氧化铝凝胶佐剂及10ug OVA的生理盐水,第14、20d每日给予5%OVA雾化0.5h进行激发以建立哮喘小鼠模型;对照组小鼠用生理盐水替代进行腹腔注射及雾化,其余同哮喘组。第2ld采用小鼠肺功能仪(上海玉研科学仪器有限公司)测定两组小鼠气道反应性,以生理盐水激发的气道阻力(airway resistance,AR)为基础值,以不同浓度ACh激发的AR为激发值,激发值/基础值评价小鼠气道反应性。采集两组小鼠外周静脉血 2ml,3000r/min离心10min,分离血清于-80℃冰箱保存,采用酶联免疫吸附法(enzymelinkedimmunosorbentassay,ELISA)测定血清中OVA特异性的IgE抗体、Adr水平。取两组小鼠右肺组织,用10%甲醛溶液固定,修剪,梯度酒精脱水,二甲苯透明,石蜡包埋成块,切成5μm连续切片,二甲苯脱蜡,梯度酒精脱水,苏木素染色,流水冲洗,1%盐酸溶液分化数秒,流水冲洗,伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察HE染色结果。
体外实验:取两组小鼠肾上腺分离及培养AMCCs,参照Franco A等[6]使用的免疫荧光及电子显微镜(美国Aspex公司)鉴定AMCCs。然后进行以下实验:①AMCCs培养2d后更换新鲜培养基,体积400μl,吹打均匀后取10μl沿盖玻片边缘滴加到细胞计数板上进行细胞计数,然后换成400μl双蒸水到孔板中,-20℃和室温反复冻融3次,收集细胞裂解液于-20℃冰箱保存,采用ELISA测定细胞裂解液中Adr水平;②AMCCs培养2d后用不同浓度 (1、10、100、1 000、10000nmol/L)ACh 刺激 1min,收集细胞上清液于-20℃冰箱保存,采用ELISA测定细胞上清液中Adr水平;③AMCCs培养2d后换液,加入终浓度为10nmol/L的α7nAChR阻断剂甲基牛扁碱 (methyllycaconitine,MLA), 然后用 100 nmol/L的ACh刺激1min,收集细胞上清液于-20℃冰箱保存,采用ELISA测定细胞上清液中Adr水平;④AMCCs培养2d后换液,加入终浓度为30 μmol/L的α7nAChR激动剂PUN-282987直接刺激1min,收集细胞上清液于-20℃冰箱保存,采用ELISA测定细胞上清液中Adr水平;⑤AMCCs培养2d后换液,加入终浓度为10μmol/L的α3β4-nAChR阻断剂α-CTx TxID,然后以100nmol/L的ACh刺激1min,收集细胞上清液于-20℃冰箱保存,采用ELISA测定细胞上清液中Adr水平。
1.4 统计学方法 采用spss22.0软件进行统计分析。计量资料组间比较采用t检验或单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 两组小鼠气道反应性测定结果比较 ACh激发后哮喘组气道反应性显著高于对照组,差异有统计学意义P<0.05。见图1。

图1 两组小鼠气道反应性测定结果比较
2.2 两组小鼠血清中OVA特异性的IgE抗体及Adr水平比较 哮喘组小鼠血清中OVA特异性的IgE抗体水平明显高于对照组,差异有统计学意义(P<0.05);哮喘组小鼠血清中Adr水平与对照组比较,差异无统计学意义P>0.05。见表1。
2.3 两组小鼠HE染色结果比较 哮喘组小鼠支气管壁及肺泡壁明显增厚,支气管及血管周围可见大量炎症细胞浸润;对照组小鼠支气管及血管周围未见明显的炎症细胞浸润,见图2。
表1 两组小鼠血清中OVA特异性的IgE抗体及Adr水平比较(,ug/l)

表1 两组小鼠血清中OVA特异性的IgE抗体及Adr水平比较(,ug/l)
组别 造模数(只) IgE Adr哮喘组对照组Z/t P 86 86/ /10.71±3.88 0.21±0.21-7.968<0.001 2.08±0.68 2.11±0.75 0.275 0.784

图2 两组小鼠HE染色结果×200(A:对照组;B:哮喘组)
2.4 两组小鼠分离培养的AMCCs细胞裂解液中Adr水平比较 哮喘组小鼠分离培养的AMCCs细胞裂解液中Adr水平明显低于对照组,差异有统计学意义P<0.05。见表2。
2.5 两组小鼠在不同浓度ACh刺激后AMCCs细胞上清液中Adr水平比较 不同浓度ACh刺激后,哮喘组小鼠AMCCs细胞上清液中Adr水平与对照组比较差异无统计学意义P>0.05。见图3。
表2 两组小鼠分离培养的AMCCs细胞裂解液中Adr水平比较(,ug/l/1000 个)

表2 两组小鼠分离培养的AMCCs细胞裂解液中Adr水平比较(,ug/l/1000 个)
组别 造模数(只) Adr哮喘组对照组t P 86 86/ /5501.12±793.09 7654.31±987.65 15.764<0.001
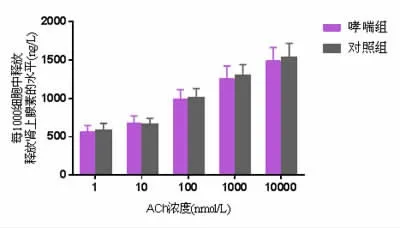
图3 两组小鼠在不同浓度ACh刺激后AMCCs细胞上清液中Adr水平比较
2.6 α7nAChR阻断剂MLA对两组小鼠AMCCs分泌Adr的影响 使用α7nAChR阻断剂MLA后,在受到ACh刺激时哮喘组小鼠AMCCs分泌Adr的能力与对照组比较差异无统计学意义P>0.05。见图4。

图4 α7nAChR阻断剂MLA对两组小鼠AMCCs分泌Adr的影响
2.7 α7nAChR激动剂 PUN-282987对两组小鼠AMCCs分泌Adr的影响 使用α7nAChR激动剂PUN-282987直接刺激时哮喘组小鼠AMCCs分泌Adr的能力与对照组比较差异无统计学意义P>0.05。 见图5。

图5 α7nAChR激动剂PUN-282987对两组小鼠AMCCs分泌Adr的影响
2.8 α3β4-nAChR 阻断剂 α-CTx TxID对两组小鼠AMCCs分泌Adr的影响 使用α3β4-nAChR阻断剂α-CTx TxID后,在受到ACh刺激时两组小鼠AMCCs分泌Adr的能力均显著下降,且哮喘组小鼠AMCCs分泌Adr的能力明显低于对照组,差异有统计学意义P<0.05。见图6。
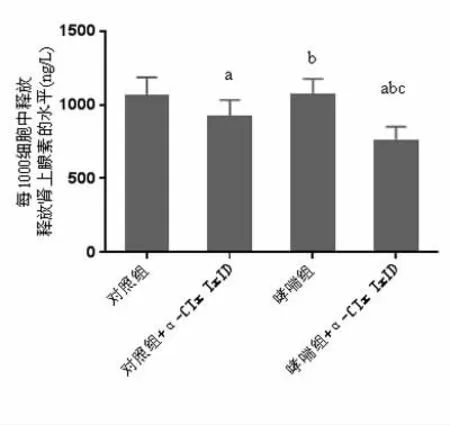
图6 α3β4-nAChR阻断剂α-CTx TxID对两组小鼠AMCCs分泌Adr的影响
3 讨论
引发哮喘的因素很多,呼吸道病毒感染、环境气候改变、气道神经调节失常等可引起机体出现广泛而多变的可逆性气流受限从而引发持续性喘息,常在夜间和/或清晨加重,急性发作时可出现低氧血症、多脏器衰竭甚至死亡,严重影响哮喘患者生命质量。有研究显示发生气道重塑时,支配肾上腺髓质交感神经兴奋而释放ACh,促使AMCCs的nAChRs激活,Ca2+通道活化,细胞内Ca2+浓度升高,继而促进Adr分泌。因此,探讨nAChRs对急性支气管哮喘小鼠Adr分泌的影响,可为支气管哮喘的发病机制及防治靶点的研究提供新的方向。既往研究结果显示,部分哮喘大鼠的AMCCs向神经元转分化,导致Adr合成减少。而Yu M等[5]发现哮喘患者血浆中Adr水平与健康对照者比较无显著性差异,这一研究结果与本研究结果类似。造成这种矛盾现象的机制尚未完全明确,我们推测在哮喘小鼠AMCCs合成Adr减少的情况下,可能有其它代偿机制促进AMCCs分泌Adr,最终维持哮喘发作时患者血浆中Adr水平无明显波动。
相关研究发现[6]哮喘小鼠AMCCs的nAChRs中 α3、α4、α7、β4 亚基 mRNA 表达升高,但具体机制并未阐明。在神经细胞中,ACh是在胆碱乙酰化酶(choline acetylase,chAT)催化作用下合成的。有研究认为[7]哮喘与神经肌肉接头处突触后膜上乙酰胆碱受体(acetylcholine receptor,AChR)被其相应自身抗体损伤显著相关。AChR包括毒蕈碱型受体(M受体)与烟碱型受体(N受体),其中N受体为一类胆碱能受体,N1受体位于交感和副交感神经节神经元的突触后膜,可引起神经元兴奋,N2受体位于骨骼肌终板膜,可引起骨骼肌兴奋[8,9]。烟碱型受体又为离子通道型受体,其信号分子为神经递质,神经递质与受体结合后通道蛋白构象发生变化,细胞膜离子通透性增强,离子通道开启,使细胞外化学信号转换为电信号,进而改变突触后细胞兴奋性[10,11]。除外,每个离子通道型受体由5个亚基组成,α1-10、β1-4、?等为已经确认的亚基,且不同亚基组成生理学特性不同的nAChR,由于α7nAChR通常形成亚基单一的同源五聚体,故在所有亚基中α7nAChR对Ca2+的通透性最高[12]。同时,我们前期研究发现哮喘小鼠α7nAChR mRNA表达水平显著高于 α3nAChR mRNA、α4nAChR mRNA、β4nAChR mRNA,由此我们推测在哮喘小鼠AMCCs合成Adr减少的情况下,α7nAChR可能代偿促进AMCCs分泌Adr,使哮喘患者血浆中Adr维持在正常水平。Wong D F等[13]建立动物模型进行实验发现哮喘小鼠注射α7nAChR激动剂PUN-282987后血清中Adr水平上升,注射α7nAChR阻断剂MLA后血清中Adr水平降低。然而在本研究中,使用α7nAChR阻断剂MLA或α7nAChR激动剂PUN-282987后,哮喘小鼠在受到ACh刺激时AMCCs分泌Adr的能力与对照组比较均无统计学差异,均不能促进AMCCs释放Adr。分析其原因可能是因为,表达α7nAChR的哮喘小鼠AMCCs缺乏苯乙醇胺-N-甲基转移酶(phenylethanolamine Nmethyl transferase,PNMT)而不能合成Adr[14,15]。这一结果也较好地提示了以往实验中给予α7nAChR阻断剂MLA或α7nAChR激动剂PUN-282987所造成的哮喘小鼠血清中Adr水平变化可能为药物的间接作用。相关研究发现哮喘小鼠AMCCs的α3nAChR mRNA、α4nAChR mRNA表达增高,并且考虑到α3nAChR mRNA特异性阻断剂的可获得性,本研究探讨了α3β4-nAChR阻断剂α-CTx TxID对两组小鼠AMCCs分泌Adr的影响,结果显示使用α3β4-nAChR阻断剂α-CTx TxID后,在受到ACh刺激时两组小鼠AMCCs分泌Adr的能力均显著下降,且哮喘组小鼠AMCCs分泌Adr的能力明显低于对照组,提示α3β4-nAChR参与两组小鼠 AMCCs分泌 Adr,且哮喘小鼠α3β4-nAChR表达明显高于健康对照小鼠。我们推测α3β4-nAChR表达增加可能是对AMCCs分泌Adr减少的一种代偿性反应,以便机体在受到外界因素刺激时能更好地释放Adr进行应激调节。
综上,急性支气管哮喘小鼠nAChRs亚基构成的改变参与调控AMCCs分泌肾上腺素。由于本研究造模数较少,且研究时间短,还需扩大样本作进一步研究。

