早期卵巢癌腹腔镜手术的疗效分析
孙丽丽 张月如 沈 健 冯炜炜
上海交通大学医学院附属瑞金医院妇产科,上海 200025
卵巢上皮性癌(卵巢癌)是女性生殖系统三大恶性肿瘤之一,及早进行手术治疗是提高卵巢癌患者生存率的关键[1],目前早期卵巢癌的标准手术方式是进行全面分期手术[2]。腹腔镜手术已在腹腔、盆腔手术以及妇科肿瘤手术中广泛应用[3-7],但腹腔镜再分期手术治疗早期卵巢癌自提出以来,其有效性和安全性一直存在许多争议[8-13]。本研究回顾性分析上海交通大学医学院附属瑞金医院在2014年10 月~2018 年6 月收治的早期卵巢癌经腹腔镜全面分期手术患者的临床资料,探讨腹腔镜在早期卵巢癌全面分期手术中的有效性和安全性,为早期卵巢癌腹腔镜全面分期手术的应用提供临床依据。
1 资料与方法
1.1 一般资料
选取2014 年10 月~2018 年6 月上海交通大学医学院附属瑞金医院收治的早期卵巢癌经腹腔镜全面分期手术患者33 例。术前所有患者均通过超声和肿瘤标志物进行评估,临床上怀疑卵巢恶性肿瘤,则进行MR 或CT 检查,如术前检查及术后病理证实超出Ⅰ~Ⅱ期则予以排除。所有接受手术患者均签署书面知情同意书。
1.2 手术方法
全身麻醉后取膀胱截石位,经阴道置举宫器。脐孔切口置气腹穿刺针,充入CO2建立气腹,气腹压力设定为15mm Hg(1mm Hg=0.133kPa),置入第1 套管(直径12mm),为腹腔镜光源镜;直视下在左、右下腹穿刺放置12mm Trocar 1 枚、5mm Trocar 3 枚,以安置腹腔镜器械。腹腔镜下进行常规探查,取腹水或腹腔冲洗液进行细胞学筛查,取卵巢肿物迅速冰冻切片进行病理学检查。对病理学检查确诊为恶性患者,根据患者有无生育要求,选择不同手术方式。若有生育要求,则行保留生育功能的患侧卵巢切除+盆腔淋巴结清扫+腹主动脉旁淋巴结切除+大网膜切除±阑尾切除+对侧卵巢活检+腹膜多点活检术;若无生育要求,则行全面分期手术,手术范围包括:全子宫切除+双侧附件切除+大网膜切除±阑尾切除+盆腔和腹主动脉旁淋巴结切除+腹膜多点活检术。
1.3 术后化疗
根据美国国立综合癌症网络(NCCN)临床实践指南推荐,除ⅠA 期G1 患者外均应给予术后辅助化疗,因自身情况(如年龄大、基础疾病多、肝肾功能差等)不能耐受化疗或者拒绝化疗者除外,采用紫杉醇+铂类药物(即TC)方案,常规给予3~6个疗程的化疗。
1.4 观察指标
患者统计学资料包括年龄,体重指数(BMI)以及围术期数据(如手术失血量,检索到的淋巴结数量,住院时间等),并记录主要器官损伤,腹腔转移,输血及发热状况等并发症。根据手术和组织病理学,所有患者根据FIGO 2013 标准进行分期。记录病理资料,包括组织学类型,细胞学检查结果以及盆腔和主动脉旁淋巴结的数量。在研究结束时,分析复发模式、无复发生存率和总生存率。
1.5 统计学方法
所有数据均使用SPSS19.0 进行分析。如年龄和体重指数(BMI)等连续变量表示为(),而非连续变量则表示为中位数和范围。累计事件发生率(复发和死亡)通过Kaplan-Meier方法计算。
2 结果
2.1 一般特征
患者平均年龄为(50.3±12.7)岁,平均体重指数为(23.4±3.6)kg/m2。IA期卵巢癌14例(42.4%),ⅠB期2例(6.0%),ⅠC期12例(36.4%),Ⅱ期5例(15.2%)。组织学类型:透明细胞癌10例(30.3%),子宫内膜样腺癌6例(18.2%),浆液性癌8例(24.2%),黏液性癌5例(15.2%),其他类型4例(12.1%)。1级3例(9.1%),2级5例(15.2%),3级6例(18.2%),未分级19例(57.5%)。见表1。

表1 接受腹腔镜分期手术的早期卵巢癌患者特征
2.2 术中情况
该组患者平均肿瘤直径为(6.2±4.9)cm。平均出血量为(153.0±96.8)mL,其中有1 例(3.0%)患者因出血多予术中输血。切除的盆腔和腹主动脉旁淋巴结的中位数分别为30 枚(范围12~55 枚)和4 枚(范围0~15 枚)。其中8 例患者出现术中卵巢肿瘤破裂。所有患者均未转剖腹手术,均未出现脏器损伤。见表2。

表2 术中情况
2.3 术后结果
本组患者术后平均排气时间(2.0±0.8)d,留置导尿时间(2.0±1.2)d,抗生素使用时间(4.7±1.1)d,术后平均住院时间(9.5±4.6)d。6例(18.2%)患者出现术后发热(体温>37.8℃),对症处理后均顺利出院,无其他术后并发症。根据NCCN 临床指南推荐,术后24 例(72.7%)患者需要辅助化疗。见表3。
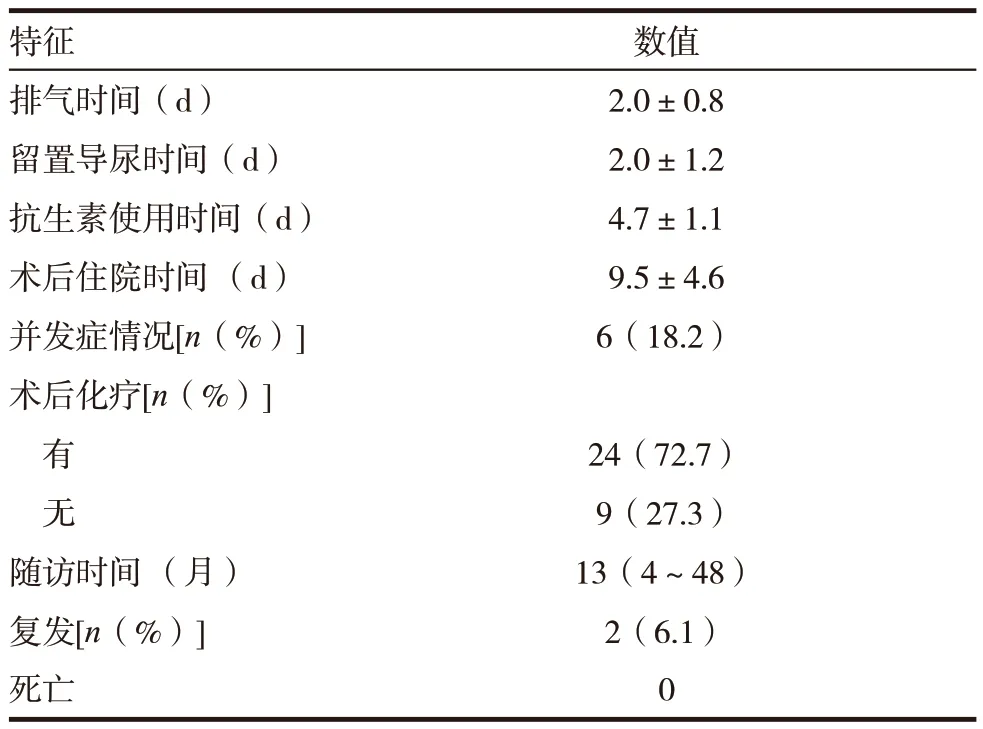
表3 术后结果
2.4 随访
中位随访时间13(4~48)个月,其中2 例(6.1%)患者复发,1 例为术后12 个月复发,另1 例为术后20 个月复发,无复发生存率为93.9%(图1);无患者死亡,总生存率为100%(图2)。

图1 早期卵巢癌患者接受腹腔镜分期手术后无复发生存率曲线

图2 早期卵巢癌患者接受腹腔镜分期手术后的生存率曲线
3 讨论
国内外许多研究都已将腹腔镜技术应用在早期卵巢癌的治疗中,结果显示效果良好。如刘传娜等[14-15]通过对腹腔镜手术患者和开腹手术患者进行对比研究发现腹腔镜手术的患者平均出血量更少,清扫的淋巴结个数更多,且术后胃肠功能的恢复时间更短;此外,还发现腹腔镜组患者术后疼痛程度明显较开腹组轻,同时抗生素的使用时间和患者的住院时间也均较开腹组短。翟振波[16]等发现腹腔镜组患者在术后1 个月和术后6 个月的心理状态及生活质量要明显的好于开腹组。近年来国外发表的关于卵巢癌患者腹腔镜分期手术的研究[17-22],也显示腹腔镜手术时间更短,出血量更少,住院时间更短,术后并发症发生率更低,复发率更低及总生存率升高。表4 对上述发表的关于早期卵巢癌患者腹腔镜分期手术的研究报告做了总结。以上研究表明:对于选择性早期卵巢恶性肿瘤患者,由有经验的妇科肿瘤专家进行腹腔镜分期手术是安全可行的。这主要由于腹腔镜具有镜下放大的作用,对于肿瘤的探查更加清晰;腹腔镜在进行手术时所使用的超声刀等器械具有边手术边止血的功能;同时腹腔镜手术可以明显降低早期卵巢癌患者术后的疼痛感。虽然腹腔镜分期手术相比于剖腹手术具有很多优势,但目前在治疗早期卵巢癌中仍存在很多争议。其中之一就是CO2气腹环境可能会导致卵巢肿瘤细胞的扩散。腹腔镜手术时需要建立CO2气腹环境,但是有研究表明CO2会让肿瘤得到暂时性的生长抑制,但是短暂的生长抑制之后就会快速的生长,同时还可能会导致腹腔镜穿刺部位的转移等情况发生[12,23]。张晓慧等通过体外模拟CO2气腹环境,将人卵巢癌细胞株SKOV3置于不同的CO2气腹环境后,发现抗凋亡因子XIAP和PED/PEA-15 的表达较对照组明显增加,并且与CO2作用时间及压力有关,而抗凋亡因子XIAP 和PED/PEA-15 可抑制细胞凋亡,从而得出CO2气腹环境促进了肿瘤生长。但是,对于腹腔镜的气腹环境也有不同的观点,比如Bourdel 等[24]的研究就指出当CO2为正压的时候,对于肿瘤的生长是有着抑制作用的,同时该研究也指出CO2气腹并不是导致肿瘤扩散的根本原因。目前CO2气腹对卵巢癌生物学行为的影响尚未定性,其机制亦不完全明确,有待学者开展更高质量的基础实验及临床前瞻性研究。

表4 早期卵巢癌患者腹腔镜与剖腹手术结果
腹腔镜手术要求在不影响分期的情况下将肿瘤完整的取出,不能破坏肿瘤的完整性。但是有很多研究都发现腹腔镜在治疗早期卵巢癌的过程中可能会导致肿瘤破裂,术中卵巢肿瘤破裂可导致手术-病理分期上升,特别是早期卵巢癌,一旦破裂可能引起腹腔内种植甚至转移[25-27]。但是否影响患者的预后,学术界一直存在争论,Heitz 等[25]通过对537 例卵巢癌患者病例进行分析后认为,卵巢肿瘤破裂是影响预后的独立因素。而Sjovall 和Minig等[26]的研究发现早期卵巢癌腹腔镜手术中肿瘤包膜完整者与破裂者的生存率差异无统计学意义;另一方面,术前肿瘤破裂和术中破裂比较,生存率有明显差异,从而揭示术中导致肿瘤破裂对患者结局无负面影响。虽然存在争议,手术均应遵守无瘤原则,避免人为造成肿瘤细胞溢出,因此早期卵巢癌的腹腔镜手术应由有经验的妇科肿瘤内镜医师操作。
腹腔镜穿刺部位的肿瘤种植情况在腹腔镜手术中的发生率大约为1%~2%,该并发症是腹腔镜在早期卵巢癌治疗中最大的争议点。患者在具有某些特征时可能更容易发生穿刺部位的肿瘤种植情况,如癌性腹水、晚期卵巢癌或原发性腹膜癌等[28-31]。Zivanovic 等[28]报道1694 例患者中有20 例(1.18%)发生了穿刺部位转移,在20 例患者中,19 例(95%)已有其他部位转移。因此他们认为穿刺部位转移可被视为晚期卵巢癌,而不是腹腔镜手术的并发症。Lee 等[31]对腹腔镜治疗早期卵巢癌的手术进行研究发现,与腹腔镜相关的穿刺部位的肿瘤种植发生率仅有1.2%,同时对腹膜进行缝合可以降低腹腔镜穿刺部位的肿瘤种植发生率。虽然对切口部位转移发生率的担忧仍存在争议,但对于部分早期卵巢癌和无腹膜癌的患者,应该保留卵巢癌的腹腔镜分期手术,同时标本袋应被强调为常规使用。
综上,腹腔镜的使用为医疗人员提供了良好的手术视野,并且通过增加放大率可以检测腹膜、肝脏和膈肌表面的转移灶。此外,与剖腹手术相比,它有助于患者的早期恢复,包括减少术中失血量和缩短住院时间。因此早期卵巢癌的腹腔镜分期具有良好的临床应用价值。通过分析本院案例结合国内外研究报道发现,经培训的妇科肿瘤内镜医师对选定的卵巢癌患者进行腹腔镜手术治疗是可行、安全和有效的。腹腔镜分期手术治疗早期卵巢癌可以替代剖腹手术。但腹腔镜手术对于卵巢癌生物学行为的影响及其远期疗效,尚有待大样本的前瞻性随机对照研究予以证实。

