石墨烯量子点的光热和光动力效应在杀菌中的应用
吴 颖,郭昱良,章泽飞,桂 馨
(同济大学生命科学与技术学院,上海200092)
自从中国科学院黄庆课题组首次发现石墨烯(graphene oxide,GO)具有抗菌作用以来,石墨烯及其衍生物的抗菌研究引起了学者们的广泛关注[1-3].单层石墨烯的厚度仅为0.35 nm,是目前世界上已知最薄的2维材料.巨大的比表面积可以让石墨烯和更多的细菌接触,良好的热/化学稳定性可以使其持续地抑制细菌生长[4-5].
石墨烯量子点(graphene quantum dots,GQDs)可以通过切割大尺寸的石墨烯得到,因此GQDs的粒径更小,从而获得了比石墨烯更大的比表面积,在相同质量下可以装载更多的药物;而且不同于最常见的石墨烯和氧化石墨烯,GQDs不仅能够高效地将光能转换为热能,同时还能产生活性氧(reactive oxygen species,ROS).但是,过量的ROS会破坏细胞膜、蛋白质以及DNA从而杀伤细胞[6-7].可见GQDs无需装载光敏剂即可达到光热和光动力的协同杀伤效果,而这2种效应的协同可以更大程度地杀伤细胞[8-9].因此GQDs将是一种性能优异、应用前景较好的杀菌材料.
本工作将GQDs的光热效应和光动力效应联合,达到协同杀伤细菌的效果,进一步推动GQDs在杀菌领域的研究.
1 材料和方法
1.1 实验材料
蛋白胨、酵母提取粉购自Oxide公司(美国);琼脂购自沃凯化学试剂有限公司(上海);大肠杆菌(Escherichia coli)菌种干粉购自中国工业微生物菌种保藏中心(CICC,上海);石墨粉购自上海南球碳素合作公司(上海);活性氧检测试剂盒购自碧云天生物技术有限公司(江苏);氯化铁、浓氨水、高锰酸钾、浓硫酸、氯化钡、无水乙醇、氯化钠等试剂均购自国药集团上海化学试剂有限公司(上海).
1.2 实验方法
1.2.1 GQDs合成及形貌表征
本工作首先通过改良的Hummers法合成氧化GO[10-11],基本步骤如下:在冰水浴条件下,把1 g石墨粉缓慢加入到搅拌中的25 mL浓硫酸溶液,持续搅拌12 h;维持低温,缓慢加入6 g高锰酸钾,转入40°C油浴中,搅拌30 min;加入20 mL去离子水,将油浴温度提高到90°C,搅拌2 h;加入95 mL去离子水,将油浴温度提高到105°C,搅拌40 min;使用温水将整个体系稀释到160 mL,再加入10 mL 10%的H2O2,趁热过滤,得到滤饼;用5%HCl洗涤滤饼,直至滤液中检测不到SO42-(氯化钡溶液检测);将滤饼从滤纸上取下,超声分散在500 mL去离子水中,得到约2 mg/mL GO水悬液.
取100 mL约0.2 mg/mL GO水悬液,加入2 mL H2O2(30%),80°C油浴下剧烈搅拌,缓慢滴加4 mL氯化铁溶液(2 mg/mL),继续搅拌约4 h直至溶液变为黄亮色;冷却后,装入截留分子量为1 000的透析袋中透析,直至透析外液中检测不到Fe3+(浓氨水检测);之后冷冻干燥得到GQDs粉末;在透射电镜下观察GQDs形貌.
1.2.2 655 nm激光诱导GQDs的光热转换
将制备的GQDs粉末分散在蒸馏水中,得到质量浓度为0.6 mg/mL的GQDs水溶液,取200 μL于透明的玻璃小管中,封口膜密封管口,以低功率密度(0.25 W/cm2)的655 nm的激光束垂直照射玻璃小管中的样品,采用红外热成像仪实时检测样品的温度变化.以200 μL蒸馏水在同样功率激光照射下的升温测试作为对照,每组样品在各时间点进行3次重复实验.
1.2.3 LB培养基的配置
称取氯化钠10 g、酵母提取粉5 g、胰化蛋白胨10 g,溶解于1 000 mL去离子水中,121°C高压灭菌20 min,4°C保存备用.实验中所需的平板固体培养基,需要在上述的培养基配方中加入20 g琼脂粉,高压灭菌后趁热倒至平板,待冷却凝固后于4°C保存备用.
1.2.4 大肠杆菌的培养及菌液的制备
在35 mL预热的液体LB(luria-bertani)培养基中加入少许大肠杆菌干粉粉末,于37°C,220 r/min摇床上培养过夜;待菌液的600 nm吸收值(OD600)为0.5左右时,取0.1 mL菌液加入新鲜的35 mL的LB培养基中,相同条件过夜振荡培养;然后,10 000 g离心10 min,取沉淀,用灭菌的蒸馏水将菌液OD600调整至0.5后备用.大肠杆菌OD600为0.5时的菌体浓度为5×108个/mL.
1.2.5 655 nm激光诱导GQDs产生活性氧
取6 mL上述OD600值为0.5的大肠杆菌水溶液,加入6 μL活性氧检测试剂盒中的探针DCFH-DA,37°C孵育20 min后用灭菌水洗涤3次,得到6 mL装载了探针的大肠杆菌水溶液;将制备的GQDs粉末分散到3 mL大肠杆菌水溶液中,获制3 mL质量浓度为0.6 mg/mL的GQDs和大肠杆菌混合液以及3 mL装载了探针的大肠杆菌水溶液;取200 μL GQDs和大肠杆菌混合液加入到96孔板中,以低功率密度的655 nm的激光束垂直照射样品孔,在不同时间点用酶标仪检测样品的DCF(2,7-dichlorofluorescein)荧光值;以200 μL大肠杆菌水溶液在同样功率激光照射下的DCF荧光值作为对照,每组样品各时间点进行3次重复实验.
1.2.6 GQDs对大肠杆菌生长的影响
将0.1 mL上述OD600值为0.5的大肠杆菌水溶液加入到15 mL培养基中,加入紫外照射灭菌处理后的GQDs,调整其质量浓度为1 mg/mL,在上述条件下进行培养;设置未加GQDs的对照组,培养2 h后,每隔1 h取0.1 mL菌液检测OD600的值用于绘制大肠杆菌的生长曲线,直至菌液的吸收值不再明显增长为止.每组实验重复3次.
1.2.7 655 nm激光诱导GQDs对大肠杆菌的杀伤作用
取0.2 mL的上述活菌液置于2 mL离心管中,分别加入GQDs形成浓度梯度,采用655 nm的近红外激光在管壁正上方5 cm处照射20 min,设置未加GQDs的菌液进行相同激光处理作为对照;照射结束后采用梯度稀释涂板法(103倍、104倍及105倍)对菌液内活菌数目进行记数,并取无GQDs菌液的菌数为标准计算活菌抑制率.每组实验重复3次.
取0.2 mL的上述活菌液置于2 mL的离心管中,加入GQDs使其最终质量浓度为0.6 mg/mL,分别用655 nm近红外激光在管壁正上方处照射不同时间,形成时间梯度;照射结束后使用梯度稀释涂板法(103倍、104倍及105倍)对菌液内活菌数目进行记数,并取未进行激光照射的菌液的菌数为标准计算活菌抑制率.每组实验重复3次.
1.2.8 数据分析
采用IBM SPSS Statistics 22提供的单因素方差分析法分析样本各组间差异性,P<0.05(*)表示具有统计学差异,P<0.01(**)表示具有显著的统计学差异,P<0.001(***)表示具有极显著的统计学差异.
2 实验结果和讨论
如图1所示,本工作的整体实验思路是利用655 nm激光诱导GQDs产生大量的热量和活性氧,达到协同杀伤大肠杆菌的目的.
2.1 GQDs在655 nm激光照射下的光热效应
图2为制备的GQDs的透射电镜照片和粒径分布.结果显示,该GQDs在溶液中的分布均匀,粒径大小主要集中在8~14 nm,说明制备的GQDs是一种可以均匀分散的纳米材料.
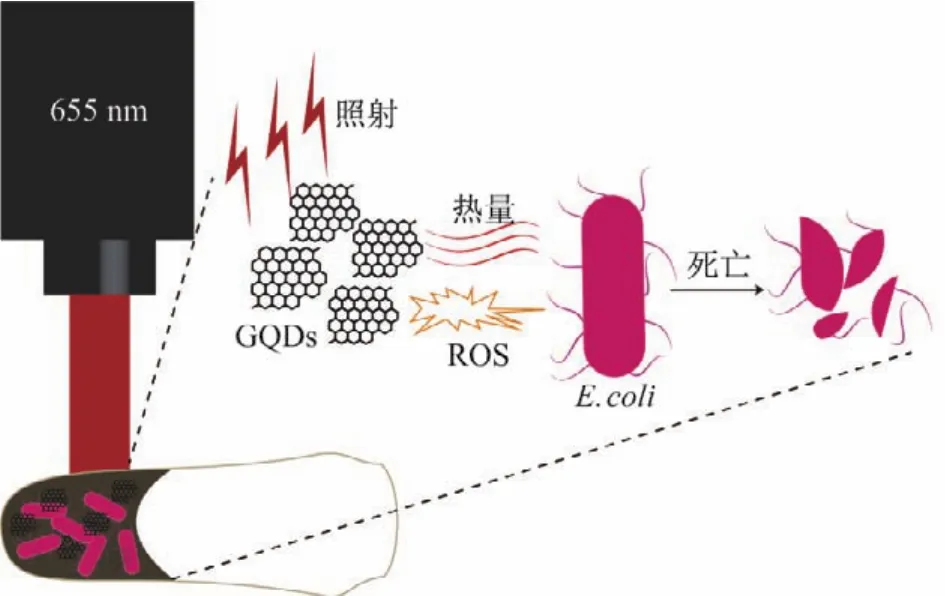
图1 实验示意图Fig.1 Schematic illustration of experiment
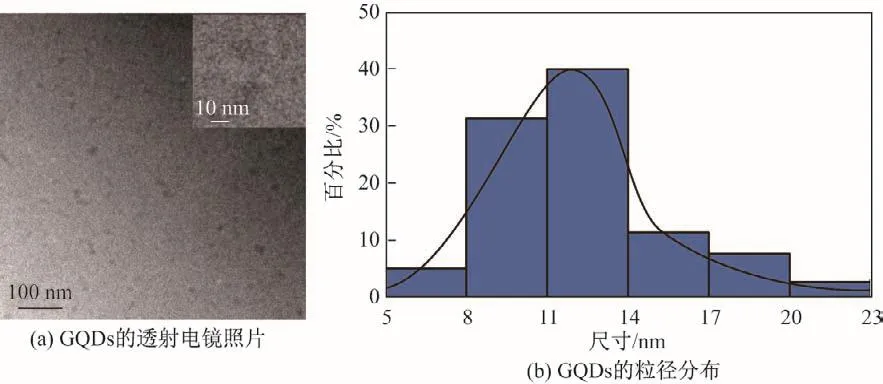
图2 GQDs的表征Fig.2 Characterizations of GQDs
在655 nm激光照射下的GQDs水溶液可以产生大量的热量.图3显示了GQDs水溶液和单纯的蒸馏水在655 nm激光照射下的升温情况.图中红外热成像仪检测到200 μL 0.6 mg/mL的GQDs水溶液在被激光照射0.5 min后,就从最初的25.3±0.3°C上升到了31.8±0.7°C;5 min时,GQDs水溶液的温度已经到达了仪器可检测到的上限50.5°C,平均升温幅度超过25°C.而相同体积的蒸馏水激光照射20 min后,仅上升到了29.0±0.2°C,平均升温幅度仅为4°C左右.由此可见,GQDs是一种高效的光热转化材料.
2.2 GQDs在655 nm激光照射下的光动力效应
在655 nm激光照射下的GQDs可以产生数量可观的活性氧.将GQDs和大肠杆菌水溶液混合,使混合溶液体积为200 uL,GQDs质量浓度为0.6 mg/mL.图4显示了0.6 mg/mL的GQDs经655 nm激光照射不同时间后的活性氧水平.图中,酶标仪检测到在被655 nm激光照射5 min后,相对活性氧水平从最初的2.6±0.9上升到18.5±6.2;随着照射时间的增加,活性氧水平持续上升,照射20 min后达到了95.3±12.2,表明GQDs是一种性能较好的光动力材料.
2.3 GQDs对大肠杆菌生长的影响
GQDs自身对细菌的毒性很低.GQDs经过紫外照射灭菌后,加到大肠杆菌培养液中,并且确保共培养溶液中的GQDs质量浓度为1 mg/mL(见图5),不论是调整期(0~6 h)、对数生长期(8~10 h)还是稳定期(12 h后),大肠杆菌的总体数量以及生长速度和未加GQDs组均无显著差异,其生长曲线基本重叠,说明GQDs是一种生物相容性较好的材料.
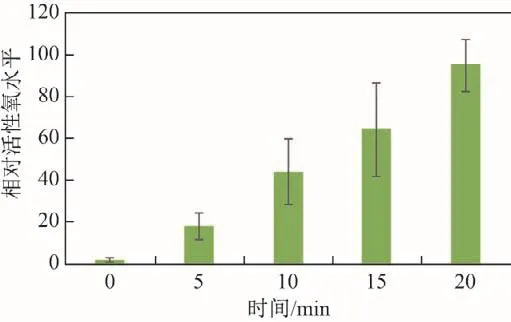
图4 0.6 mg/mL的GQDs经655 nm激光照射不同时间后的ROS水平Fig.4 ROS level of GQDs with a concentration of 0.6 mg/mL under 655 nm laser irradiation at different time point

图5 单独的GQDs对大肠杆菌生长的影响(GQDs质量浓度为1 mg/mL)Fig.5 Effect of GQDs on the growth of Escherichia coli(GQDs concentration:1 mg/mL)
2.4 655 nm激光照射下GQDs对大肠杆菌的杀伤作用
在655 nm激光照射下的GQDs可以有效地杀伤细菌.图6显示了不同质量浓度的GQDs经20 min 655 nm激光照射后的抑菌效果(定性分析).图中,当GQDs质量浓度为0.1 mg/mL时,激光照射20 min后,可以观察到大肠杆菌生长被抑制的趋势;随着质量浓度增大到0.2 mg/mL时,发现大肠杆菌的生长受到了显著的抑制;而质量浓度为0.5 mg/mL时,平板里的大肠杆菌菌落数量仅为2位数.更可喜的是,0.6 mg/mL GQDs在激光照射20 min后可以完全杀灭大肠杆菌,而单独的激光照射对大肠杆菌的生长无明显影响,证明一定质量浓度的GQDs辅以激光照射是一种有潜力的杀菌方法.

图6 不同质量浓度的GQDs经20 min 655 nm激光照射后的抑菌效果(定性分析)Fig.6 Antibacterial effects of GQDs on Escherichia coli with different concentrations under 655 nm laser irradiation for 20 min(qualitative analysis)
接下来的定量检测也证实了GQDs可以有效地杀伤细菌.图7显示了不同质量浓度的GQDs经20 min 655 nm激光照射后的抑菌效果(定量分析).图中,GQDs的质量浓度为0.1 mg/mL时,激光照射20 min后,活菌数量和对照组(未加GQDs组)相比减少了10%;当质量浓度为0.2 mg/mL时,细菌数量和对照组相比减少了25%,2组之间的活菌数有着显著的统计学差异(P<0.05);当质量浓度达到0.3 mg/mL时,实验组的活菌数和对照组相比有着极显著的差异(P<0.001);而当质量浓度为0.6 mg/mL时,活菌数为0.
根据上述实验结果可以发现,激光照射下GQDs杀灭细菌的有效质量浓度为0.6 mg/mL,在此基础上进一步考察GQDs杀灭细菌的有效时间.如图8和9所示,激光照射仅3 min后,活菌数量就已明显减少;照射5 min后,86%的细菌被杀死;照射15 min后,细菌完全被杀灭.可见,激光照射下0.6 mg/mL GQDs杀灭细菌的有效时间为15 min.如果提高GQDs的质量浓度,杀灭细菌的有效时间有希望进一步缩短.可见,在激光照射下的GQDs可以短时、高效、可控地杀灭细菌.
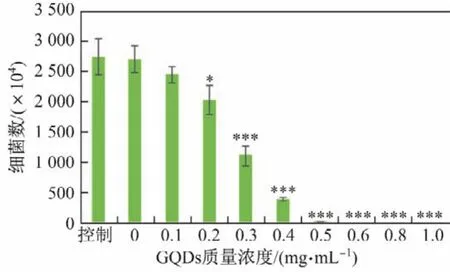
图7 不同质量浓度的GQDs经20 min 655 nm激光照射后的抑菌效果(定量分析)Fig.7 Antibacterial eきciency of GQDs on Escherichia coli with different concentrations under 655 nm laser irradiation for 20 min(quantitative analysis)
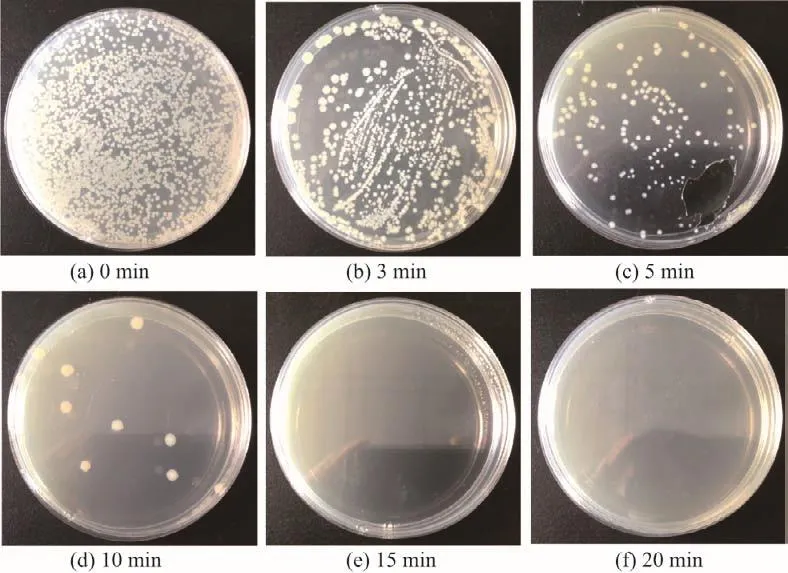
图8 0.6 mg/mL的GQDs经不同时间655 nm激光照射后的抑菌效果(定性分析)Fig.8 Antibacterial effects of GQDs with a concentration of 0.6 mg/mL on Escherichia coli under 655 nm laser irradiation at different time points(qualitative analysis)
3 结束语
综上,本工作首次利用655 nm激光诱导GQDs产生的光热效应和光动力效应用于杀菌的研究.结果表明,在较低的GQDs质量浓度和较短的激光照射条件下,能够高效地抑制细菌生长,如在GQDs质量浓度仅为0.6 mg/mL和激光仅照射15 min的条件下,能够将大肠杆菌完全杀灭,表现出了较好的杀菌性能.本工作的研究结果可以促进GQDs在生物医学领域中的应用以及杀菌新方法的推广.
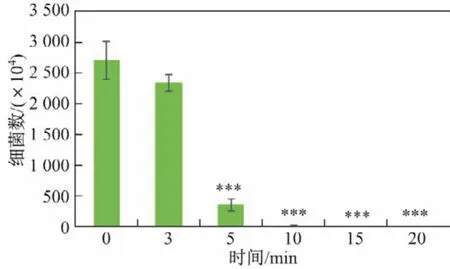
图9 0.6 mg/mL的GQDs经不同时间655 nm激光照射后的抑菌效果(定量分析)Fig.9 Antibacterial effects of GQDs with a concentration of 0.6 mg/mL on Escherichia coli under 655 nm laser irradiation at different time points(quantitative analysis)
致谢感谢同济大学生命科学与技术学院储茂泉教授提供的研究思路和实验条件,并参与论文修改和有意义的讨论.

