鼠李糖乳酸杆菌对河豚肝脏中河豚毒素毒性的影响
丁 婕,王梦梦,汪立平,卢 瑛*
(上海海洋大学食品学院,农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海水产品加工及贮藏工程技术研究中心,上海 201306)
河豚毒素(tetrodotoxin,TTX)最初是从河豚中提取出来的。与许多其他微藻来源的海洋毒素不同,TTX的产生被认为是由假单胞菌属、希瓦氏菌属、交替单胞菌属或弧菌属细菌产生的[1-2]。在刺鲀、鹦哥鱼、甲壳类、宏观藻类以及陆生动物中均发现TTX的存在[3-4]。TTX是世界上最致命的生物毒素之一,0.5 mg TTX即可使人致死[5]。在生理pH值条件下,TTX可特异性与神经细胞膜上的钠通道结合,选择性抑制Na+激活机制。误食河豚者大约在20 min内就会出现神经系统症状,如麻痹症、呼吸系统衰弱、心脏不规律跳动和痉挛,继而导致死亡,且目前没有有效的解救措施[6-8]。
近年来,乳酸菌被证实具有脱除生物毒素的功能。Mari等[9]发现鼠李糖乳杆菌能够脱除麻痹性贝类毒素。2016年,Zhu Yuanting等[10]研究发现6 种乳酸菌对双酚A具有较好的去除能力,其中嗜酸乳杆菌与植物乳杆菌对双酚A的去除能力更稳定。Bovo等[11]发现7 种乳酸菌都能够去除牛奶中的黄曲霉毒素,热灭活处理的乳酸菌去除毒性效果更佳。Nybom等[12]研究发现乳酸菌主要依靠其细胞外定位的细胞包膜蛋白酶参与饮用水中蓝藻素的去除,与乳酸菌的代谢产物无关。由此可见,乳酸菌能够消减生活中的生物毒素。
我国的河豚养殖业始于1990年[7],经过20多年的发展,目前我国在河豚养殖方面取得了显著的成绩。由于河豚体内含有毒素,如果烹饪前操作不当会引起食物中毒。河豚体内的毒素主要存在于肝脏、卵巢鱼皮中,导致即使其肝脏中含有丰富的二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)也只能被当作废弃物处理。EPA和DHA分别被称为“血管清洁剂”和“脑黄金”,具有促进大脑发育、预防心脑血管疾病等多种重要的生理活性[13-14]。我国成人对EPA与DHA的摄入量只为美国医学报道建议值的1/4,主要原因是我国DHA与EPA的来源较少、价格昂贵[15]。卫煜英等[16]报道,河豚肝脏中DHA和EPA分别占脂肪酸总量的33.31%和6.3%,为另外9 种淡水鱼的3~4 倍。但是,由于肝脏是TTX含量最多的组织,所以难以作为DHA和EPA提取的原料。
为了消减河豚组织中的TTX,本实验研究活化与热灭活处理的鼠李糖乳杆菌对TTX的消减能力,分析野生河豚肝脏在鼠李糖乳杆菌发酵过程中EPA和DHA含量的变化趋势,以期为今后河豚内脏组织中TTX的消减以及EPA与DHA的开发与利用提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明小鼠(生产许可证号:SCXK(沪)2018-0004),雄性,体质量19~21 g,购自上海捷思捷实验动物有限责任公司。
鼠李糖乳杆菌由上海海洋大学分子生物学实验室保藏;磁性免疫层析试纸条 上海海洋大学水产品重点实验室;TTX标准品(纯度>99%) 北京盈泽纳新化工技术研究院;野生河豚肝脏 江苏中洋集团股份有限公司;EPA甲酯、DHA甲酯标准品、十九烷酸甲酯内标美国Sigma公司;其他试剂 国药集团化学试剂有限公司;实验用水均为去离子水。
1.2 仪器与设备
Trace1310 ISQ气相色谱-质谱联用仪 美国Thermo Fisher公司;HH-4数显恒温水浴锅 国华电器有限公司;高速冷冻离心机 日本日立公司。
1.3 方法
1.3.1 鼠李糖乳杆菌的活化制备
将冻存于-80 ℃的鼠李糖乳酸杆菌接入MRS液体培养基中,37 ℃培养18 h,连续活化3 代后用于后续实验。
1.3.2 鼠李糖乳杆菌消减TTX
取解冻后的野生河豚肝脏,剪碎置于研钵中研磨至无明显块状颗粒。鼠李糖乳杆菌用灭菌的磷酸盐缓冲液重悬,并将其密度控制在1.0×107CFU/mL。
发酵处理:称取河豚肝脏,按质量比1∶100加入活化的鼠李糖乳酸菌菌落,混合均匀,放入发酵罐中,置于25 ℃恒温箱中,分别于第3、7天取样检测。参照方国锋等[17]的方法对肝脏中TTX进行提取。
消减TTX标准品:重新悬浮后的鼠李糖乳杆菌分成两组,第1组分别直接加入10 μg/mL TTX标准品溶液,第2组于98 ℃水浴锅中加热灭活后分别加入TTX标准品溶液。放置在37 ℃恒温摇床中,设置时间1 h,转速为180 r/min。
1.3.3 TTX的消减效果评价
1.3.3.1 免疫学分析法
磁性免疫层析试纸条能够对TTX进行快速定性检测。取120 μL样品滴加于试纸条的样品垫上,室温放置10 min后观察结果[18]。其原理为竞争模式,对于阴性样品,T线区域有明显的颜色反应,阳性反之。以磁性纳米微球偶联TTX单克隆抗体作为探针来捕捉TTX,以实现对TTX的快速检测。
竞争性酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)根据Kamath等[19]的方法略有改动。完全抗原TTX-牛血清白蛋白(albumin from bovine serum,BSA)用50 mmol/L碳酸盐缓冲液(pH 9.6)稀释至8 μg/mL,4 ℃包被过夜,PBST溶液洗涤。用质量分数5%脱脂奶粉37 ℃封闭2 h,洗涤。将经活化与热灭活处理的鼠李糖乳杆菌脱除TTX后的样品与特异性单克隆抗体等体积混合,37 ℃孵育1.5 h后加入酶标板孵育1 h,洗涤。加入辣根过氧化物酶-羊抗小鼠单克隆抗体(用抗体稀释液稀释2 500 倍体积)37 ℃孵育1 h,洗涤。然后加入邻苯二胺底物显色液,室温反应15 min,最后加入2 mol/L硫酸终止反应,并立即用酶标仪测定490 nm波长处的OD值。以50 mmol/L包被液作为阴性对照,以抗体稀释液稀释的特异性单克隆抗体作为阳性对照,每个样品做4 个平行。样品中TTX的抑制率与消减率分别按照式(1)、(2)计算。

1.3.3.2 小鼠生物法评价
根据GB 5009.206—2016《食品安全国家标准 水产品中河豚毒素的测定》中方法,对小鼠注射1.3.2节用鼠李糖乳杆菌脱除TTX后的样品,观察其致死时间。每只小鼠的注射量为1 mL,每个样品分别注射6 只小鼠,除去因个体差异而未死亡的小鼠,以平均死亡时间作为该样品的致死时间。每个样品做3 次平行。
根据小鼠的死亡时间,参考GB 5009.206—2016,得出每克肝脏中的毒素含量。参考日本谷氏对河豚毒性强弱的分类标准[20]判定毒性。
1.3.4 河豚肝脏中EPA、DHA含量的测定
1.3.4.1 河豚肝脏中EPA与DHA的提取
取80 mg河豚肝脏加入到15 mL离心管中,加入100 μL十九烷酸甲酯内标和2 mL 2%(体积分数,下同)氢氧化钠-甲醇溶液,85 ℃水浴锅中水浴30 min,加入3 mL 14%三氟化硼甲醇溶液,于85 ℃水浴锅中水浴30 min。水浴完成后,待温度降到室温,在离心管中加入1 mL正己烷,振荡萃取2 min,静置1 h,等待分层。取上层清液100 μL,用正己烷定容到1 mL。用0.45 μm滤膜过滤。
1.3.4.2 EPA与DHA含量的气相色谱-质谱检测
参考GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定河豚》中方法。肝脏中DHA与EPA含量检测采用Trace1310 ISQ气相色谱-质谱联用仪。色谱柱:TG-5MS(30 m×0.25 mm,0.25 μm);不分流进样,开阀时间1 min;进样口温度:290 ℃;载气:氦气,流速:1.2 mL/min;采取程序升温方式:80 ℃保持1 min,以10 ℃/min的速率升温至200 ℃,继续以5 ℃/min的速率升温至250 ℃,最后以2 ℃/min的速率升到270 ℃,保持3 min。质谱条件:离子源温度:280 ℃;传输线温度:280 ℃;溶剂延迟时间:5.00 min;扫描范围:30~400 u;电子轰击电离源能量:70 eV。
1.4 数据处理与分析
实验结果采用平均值±标准偏差表示,由SPSS 17.0软件进行分析。
2 结果与分析
2.1 免疫层析分析
2.1.1 河豚肝脏组织中TTX的定性分析结果

图1 试纸条定性检测TTX消减效果Fig. 1 Qualitative detection of TTX reduction using test strip
为了能够快速检测鼠李糖乳杆菌是否具有消减TTX的能力,采用磁性试纸条进行测定,其可在10~15 min内快速判断出TTX是否得到消减。如图1所示,鼠李糖乳杆菌对TTX具有明显的脱除作用,且热灭活处理的鼠李糖乳杆菌效果明显优于活化的鼠李糖乳杆菌。7~9号试纸条的T线较为清晰,而10~12号试纸条的T线模糊。因试纸条以TTX-BSA完全抗原为T线,因此根据免疫层析间接竞争原理可知,T线颜色越深表明样品中的TTX越少。7~9号试纸条的T线颜色明显深于10~12号试纸条,表明7~9号样品中含有的TTX质量浓度低于10~12号样品。4~6号试纸条为鼠李糖乳杆菌发酵后的肝脏样品,试纸条的T线很清晰,与3号试纸条(阴性样品)很接近,说明鼠李糖乳杆菌对肝脏短期的发酵处理可以明显去除TTX。
2.1.2 河豚肝脏组织中TTX的定量分析结果

表1 ELISA方法检测鼠李糖乳杆菌对TTX的消减效果Table 1 TTX reduction of Lactobacillus rhamnosus detected by ELISA
如表1所示,采用活化后的鼠李糖乳杆菌处理TTX标准品1 h,其TTX消减率为70.05%,而热灭活处理的鼠李糖乳杆菌在相同条件下TTX的消减率为82.16%,表明热灭活处理后的鼠李糖乳杆菌对TTX的消减效果更佳。而经鼠李糖乳杆菌发酵处理后的野生河豚肝脏提取液发酵7 d后TTX消减了93%左右。
2.2 小鼠生物法检测TTX脱除效果
由于小鼠生物法具有直观、快速、症状典型、易操作等特点,被国际上广泛用于河豚体内TTX的检测。以TTX标准品质量浓度为自变量,小鼠致死时间倒数为因变量作图,得到TTX标准品质量浓度与小鼠致死时间倒数的线性关系(图2)。
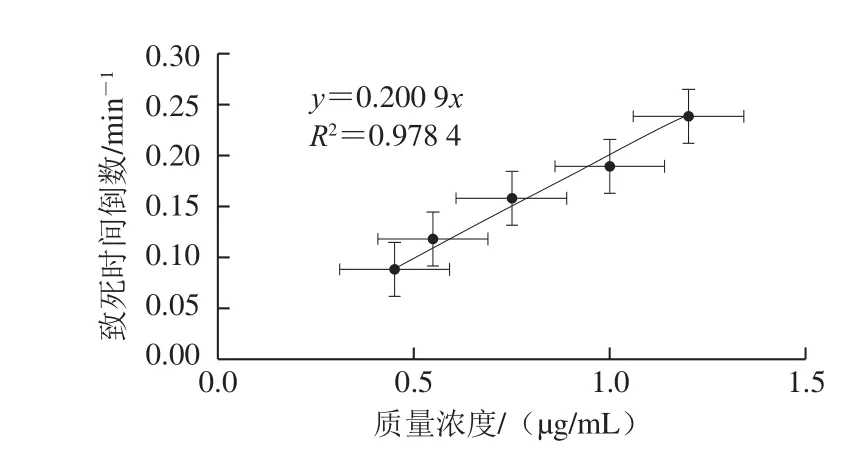
图2 TTX标准品质量浓度-小鼠致死时间倒数关系曲线Fig. 2 Curve for TTX dosage against mean death time of Kunming mice
如表2所示,活化的与热灭活处理的鼠李糖乳杆菌对TTX的脱除较明显。对小鼠注射经活化的鼠李糖乳杆菌处理过的TTX标准品,小鼠的致死时间推迟约6 min,而经热灭活处理的鼠李糖乳杆菌处理的TTX使小鼠出现虚弱现象,但30 min内未死亡。根据TTX标准品质量浓度-小鼠致死时间倒数关系曲线计算得出,经活化的与热灭活处理的鼠李糖乳杆菌脱除后的TTX标准品质量浓度分别为0.70 μg/mL和0.16 μg/mL。对小鼠注射经鼠李糖乳杆菌发酵7 d后的河豚肝脏提取液,小鼠未死亡,并与正常小鼠生理状态相似,表明经鼠李糖乳杆菌发酵7 d后河豚肝脏内的TTX大部分能被除去。
Mari等[9]发现鼠李糖乳杆菌对不同的海洋毒素消减效果不同,且消减效果与毒素自身所带的电荷数成正比,鼠李糖乳杆菌对石房哈毒素(saxitoxin,STX)和neo-STX消减率大约在77.0%~97.2%之间。Rafaat等[21]分别用乳酸菌和双歧杆菌两种菌株消减牛奶中的黄曲霉毒素,仅加入乳酸菌发酵1 d后的牛奶黄曲霉毒素消减率为31.5%~87.8%,而加入双歧杆菌的牛奶发酵1 d后消减率为27.8%~72.8%。经活化与热灭活处理的乳酸菌均能消减毒素,表明其通过结合作用与毒素结合,而不是新陈代谢作用,这与先前特定菌株通过结合去除一系列霉菌毒素和其他底物的报道[22-23]一致。
2.3 鼠李糖乳杆菌发酵处理对河豚肝脏中EPA、DHA含量的影响

表3 发酵不同时间后河豚鱼肝脏中EPA、DHA含量Table 3 EPA and DHA contents in the liver of puffer fish after different fermentation times
如表3所示,经鼠李糖乳杆菌发酵3 d后,河豚肝脏提取液中的EPA与DHA含量分别下降了3.8%和14.4%,发酵7 d后分别下降了11.93%和22.50%,其下降率与发酵的时间成正比。经鼠李糖乳杆菌发酵7 d后河豚肝脏提取液内的毒素含量约为2.7 MU/g,根据日本谷氏对河豚毒性强弱的分类标准[20],肝脏中毒素含量大于10 MU/g为弱毒水平,食用后会危害人类的身体健康。因此,经过鼠李糖乳杆菌发酵7 d的野生河豚肝脏已经达到无毒水平,而EPA和DHA含量依然为常见淡水鱼EPA与DHA含量的两倍左右[16],表明鼠李糖乳杆菌发酵处理后河豚肝脏中的EPA、DHA仍有开发价值。
EPA、DHA主要存在于深海鱼体内,具有降低血脂水平和预防心血管疾病等特殊生理功效[24-25]。张风雷等[26]发现河豚肝脏中均含有EPA和DHA,其中以东方鲀属中含量最为丰富,但是河豚体内的毒素主要存在于肝脏和卵巢中,导致其内脏被丢弃,造成了资源浪费。乔菊[27]、贾晋斌[28]等分别发现酒醅与酒曲可以降解TTX,但是降解效果不显著;Ali等[29]利用双氧水和光催化剂的协同作用对TTX标准品进行降解,效果较好,脱除率达到85%。但是这种方法不适用于对毒素消减后河豚肝脏的再利用。日本居民曾用米糠对河豚鱼的卵巢进行腌渍,历经长达两年的时间才可达到食用的水平[30]。本研究用鼠李糖乳杆菌对河豚鱼肝脏进行发酵处理7 d后,毒素消减率为93.27%,发酵后的肝脏已经无毒性。
3 结 论
通过研究活化与热处理灭活的鼠李糖乳杆菌对野生河豚鱼肝脏中TTX的消减作用,发现加热灭活后的鼠李糖乳杆菌对TTX的消减率高于活化的鼠李糖乳杆菌;此外,经活化的鼠李糖乳杆菌发酵处理7 d后的野生河豚肝脏消减到无毒水平,但是其EPA和DHA含量为常见淡水鱼中EPA与DHA的两倍左右。本研究结果可为今后河豚鱼内脏组织中TTX的毒性消减技术开发以及河豚肝脏组织内EPA与DHA的开发与利用提供依据。

