紫菜酶解产物锌螯合-α-葡萄糖苷酶抑制剂活性肽的研究
胡春芹,龙 婧,周楠迪,田亚平
(1.江南大学,工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
糖尿病是一种由多因素作用引发的高血糖代谢疾病,其基本发病机制主要为胰岛素抵抗、氧化应激作用、β细胞功能受损、细胞因子炎症。糖尿病治疗的作用机制主要是平衡胰岛素的分泌与抵抗作用,维持胰岛β细胞含量稳定;糖分解过程中的关键酶控制也是一种有效途径[1]。α-葡萄糖苷酶主要分布于小肠上皮黏膜上,属于消化酶,在人体消化食物过程中,可降解乳糖、麦芽糖等一系列低聚糖,主要断裂低聚糖非还原端α-1,4糖苷键,产生α-葡萄糖。因此,可以通过具有抑制α-葡萄糖苷酶活性的物质竞争性减缓葡萄糖苷水解酶的催化,使小肠上皮细胞表面的α-葡萄糖苷酶作用降低,进而降低碳水类化合物的吸收利用,有效缓解餐后血糖浓度,从而促进糖尿病的治疗。通过酶解法制备的自然界生物中的α-葡萄糖苷酶抑制剂既遵守安全绿色原则,又避免对人体形成二次伤害,且具有较强的抑制性,因此受到人们的密切关注[2-3]。
此外,锌作为人体必需的矿物金属之一,对机体非常重要。锌的生物功能繁多,包括参与葡萄糖和脂质代谢、细胞增殖、免疫神经系统和胰岛素的合成等。Zn2+还被用作α-葡萄糖苷酶抑制剂研究,作为临床代替治疗Ⅱ型糖尿病的物质[4]。多肽-锌复合物作为一种有机锌化合物,更接近于机体内锌的作用形式,能够达到更好的营养补充效果。而且,多肽-锌以多肽形式被人体所利用,减少与氨基酸吸收之间的竞争力,增强锌的利用,发挥更多的生理作用[5-7]。杨杰等[8]研究发现,从鱼蛋白中提取的小肽与螯合锌后具有抗氧化和补锌双重效果。梅丽萍等[9]在研究临床上检测微量元素对肾病及糖尿病治疗的意义时发现,血糖浓度与锌的含量成反比。PAULE等[10]研究发现向糖尿病小鼠体内注入2种特殊的肽(GHTD氨基化合物和类似物ISF402)与锌配合物,降血糖能力比单独使用胰岛素强。
本研究旨在开发一种新型天然原料酶解活性肽,具备靶酶的抑制活性的同时螯合微量锌,以利于快速吸收的形式为补充锌和治疗糖尿病提供一种更为稳定、安全高效的新途径。
1 材料与方法
1.1 材料
条斑紫菜,购自南通千鹤食品有限公司;中性蛋白酶,购自苏柯汉生物有限公司;碱性蛋白酶,购自广西庞博有限公司;氨肽酶,为实验室自制;α-葡萄糖苷酶,购自源叶生物科技有限公司;4-硝基苯基-D-吡喃葡糖苷(PNPG),购自阿拉丁试剂;氯化锌、磷酸二氢钠、磷酸氢二钠等,购自国药化学试剂有限公司。
722型紫外可见分光光度计、原子吸收分光光度计,购自普析通用仪器有限责任公司;实验室用水均为超纯水。
1.2 试验方法
1.2.1 紫菜蛋白制备α-葡萄糖苷酶抑制多肽工艺流程 参考周锋等[2]和高素蕴等[11]的方法并在其基础上改动。将条斑紫菜烘干、粉碎,取33 g溶于1 L 0.02 mmol/L、pH 8.5的缓冲液中,沸水浴15 min。加入中性蛋白酶(E/S=8×104U/g)、碱性蛋白酶(E/S=8×104U/g)、氨肽酶(E/S=28 U/g),50 ℃下酶解 6 h,煮沸15 min灭酶,9000 r/min离心15 min去沉淀,稀释1.6倍通过10×103的超滤膜,收集透过液,再通过1×103纳滤膜,收集透过液,旋转蒸发仪浓缩、冻干。
1.2.2 糖苷酶抑制剂活性肽-Zn螯合方法 紫菜酶解产物α-葡萄糖苷酶活性多肽、0.5 mmol/L的氯化锌溶液调节pH、温度、时间、质量比,振荡螯合,无水乙醇沉降,离心去上清液,烘干[12]。
1.2.3 不同酶与底物比、不同时间条件下体外模拟胃肠稳定性 体外模拟胃肠消化过程中α-葡萄糖苷酶抑制稳定性的方法参考杜芬等[13]和Cruz-Huerta等[14]的方法并在其基础上略有改动。胃肠消化过程共分为2个阶段:胃消化和十二指肠消化。定量配制1 mg/mL的螯合多肽溶液,并将pH调到2.0(1 mol/L HCl)。37 ℃恒温孵育 15 min,加入不同质量的胃蛋白酶,37℃恒温振荡一定时间,将pH调至7.0(5 mol/L NaOH),终止胃蛋白酶反应。十二指肠消化阶段:将经过胃消化阶段的螯合多肽溶液置于37℃恒温孵育15 min,按照Zn-螯合肽与酶不同质量比加入胰蛋白酶,继续37℃恒温振荡一定时间。置于85℃恒温保温20 min,终止十二指肠消化反应。分别测定胃消化阶段和十二指肠消化阶段α-葡萄糖苷酶抑制活性。
1.3 分析方法
1.3.1 螯合率的测定[15]采用火焰法原子吸收分光光度计测定螯合前后Zn的总量分别为A1、A2,计算公式为:

1.3.2 糖苷酶抑制率的测定 采用4-硝基苯基-D-吡喃葡糖苷(PNPG)法。取3支试管,取一份待测样品加入试管A中,一份0.5 mg/mL α-葡萄糖苷酶混合均匀,37℃水浴保温10 min,再加入一份10 mmol/L PNPG反应1 h后加入一份1 mol/L Nα2CO3终止反应,在405 nm处测定吸光度Ai;试管B中用氯化锌溶液替换PNPG溶液,吸光值为Aj;C管中取一份氯化锌溶液替换待测样品加入离心管中,操作同A试管,吸光值为A0,α-葡萄糖苷酶活性抑制率的测定公式为:

2 结果与讨论
2.1 α-葡萄糖苷酶抑制多肽的制备
紫菜蛋白经酶解、超滤、纳滤等深加工后得到的α-葡萄糖苷酶抑制剂为小分子多肽类,主要集中在130~1000之间。所制备的多肽其质量浓度在1 mg/mL时对0.5 mg/mL的α-葡萄糖苷酶(2×104U/g)的抑制率可以达到68%。张立新等[16]也曾研究报道刺参、海筒螅等海洋无脊椎动物的提取物在1 mg/mL时对α-葡萄糖苷酶抑制率达到68.5%和60.5%,可作为α-葡萄糖苷酶抑制剂提取的原料。
2.2 Zn2+对α-葡萄糖苷酶抑制性
参照杨杨[17]研究高剂量补锌对海马锌含量、BDNF和记忆力的影响时提出,人体补锌量为15 mg/d,低剂量补锌约10 ppm,高剂量补锌约40 ppm,应合适地补锌,避免过量,本实验选择Zn2+的浓度为0.5 mmol/L。测定单独Zn2+溶液对于α-葡萄糖苷酶的影响,如下图1。
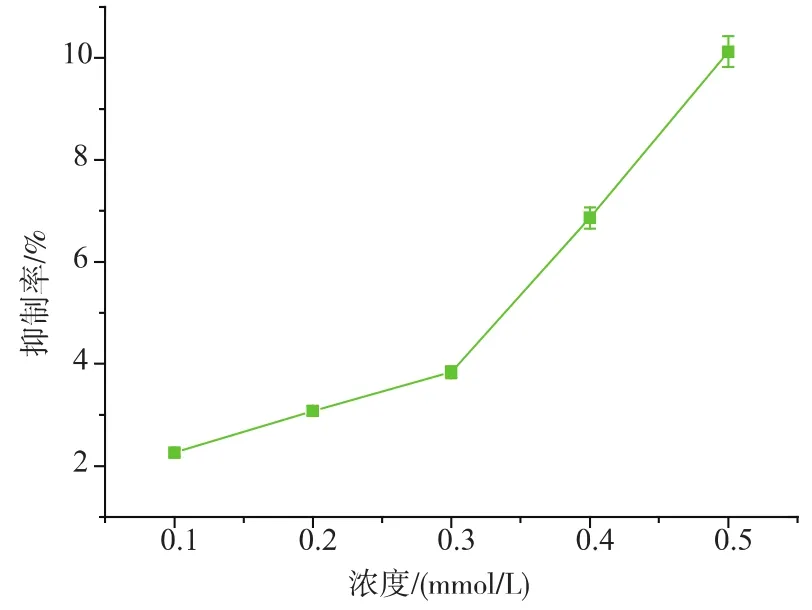
图1 Zn浓度对糖苷酶抑制率的影响Fig.1 Influence of znic concentration on inhibition activity
单独的Zn2+对α-葡萄糖苷酶有一定的抑制作用,且随着浓度的变化有一定的变化。在此浓度范围内,Zn2+对酶有一定的抑制作用,说明Zn可以作为治疗糖尿病的有效物质。
2.3 糖苷酶抑制多肽-Zn螯合工艺制备
糖苷酶抑制剂活性肽-Zn螯合单因素实验:以1 mg/mL螯合多肽对α-葡萄糖苷酶的抑制率和螯合度为指标,确定底物质量浓度、pH、时间、温度对螯合的影响。
2.3.1多肽质量浓度对螯合反应和抑制率的影响配置多肽质量浓度为 2、4、6、8、10 mg/mL, 溶于 0.5 mmol/L,pH 4.5的ZnCl2溶液,37℃,水浴螯合 30 min,结果见图2。
螯合率在一定质量浓度(4 mg/mL)之前呈现平稳趋势,随后呈现一定的下降。说明质量浓度影响螯合反应的进行,质量浓度较低时,Zn2+质量浓度充足,可以最大程度地与多肽溶液螯合,多肽质量浓度达到一定时,Zn2+的量不足以满足螯合的进行,螯合度有所降低。螯合多肽质量浓度在1 mg/mL时对0.5 mg/mL的α-葡萄糖苷酶抑制率在4 mg/mL前随着多肽质量浓度的升高呈现相应的升高,之后也呈现很大幅度降低。说明在一定质量浓度范围内多肽-Zn作为一种有机锌形式可以促进糖苷酶抑制活性。随着螯合度的降低,其抑制活性也相应降低。综合考虑,选择最适的多肽质量浓度为4 mg/mL。
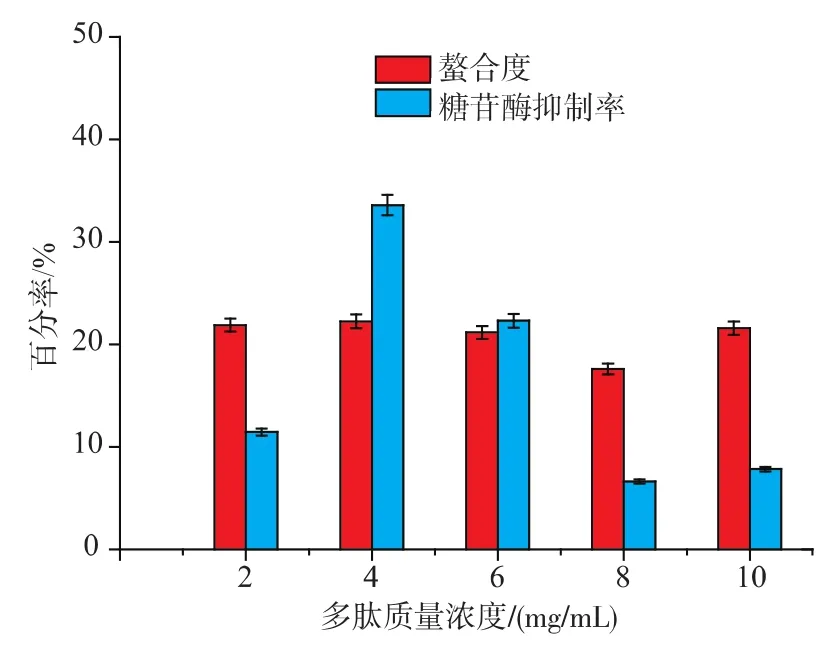
图2 多肽质量浓度对螯合度和抑制活性的影响Fig.2 Influence of peptides concentration on chelation and inhibition activity
2.3.2 pH对螯合反应和抑制率的影响 配置多肽质量浓度为10 mg/mL,pH 分别为 4.0、4.5、5.0、5.5、6, 37 ℃,水浴螯合30 min,结果见图3。

图3 pH对螯合度和抑制活性的影响Fig.3 Influence of pH value on chelation and inhibition activity
pH值在4~5时螯合率快速升高,螯合多肽对α-葡萄糖苷酶的抑制活性相对稳定,pH值5~6时螯合率逐渐下降,对α-葡萄糖苷酶的抑制活性也略降低。说明H+的浓度影响多肽与锌的螯合反应,对于糖苷酶抑制活性的影响在一定pH范围内影响不大。H+大量存在时可能会竞争Zn的供电基团,影响螯合反应的进行。pH到达5时螯合度最大。pH继续增加时螯合率降低,可能是由于体系中OH+离子增加,竞争性结合 Zn2+,形成 Zn(OH)2沉淀。故选择pH 5.0作为螯合的pH。
2.3.3 时间对螯合反应和抑制活性的影响 配置10 mg/mL的多肽溶液,pH 4.5,37℃水浴螯合0.5、1、1.5、2.0、2.5 h,结果见图4。
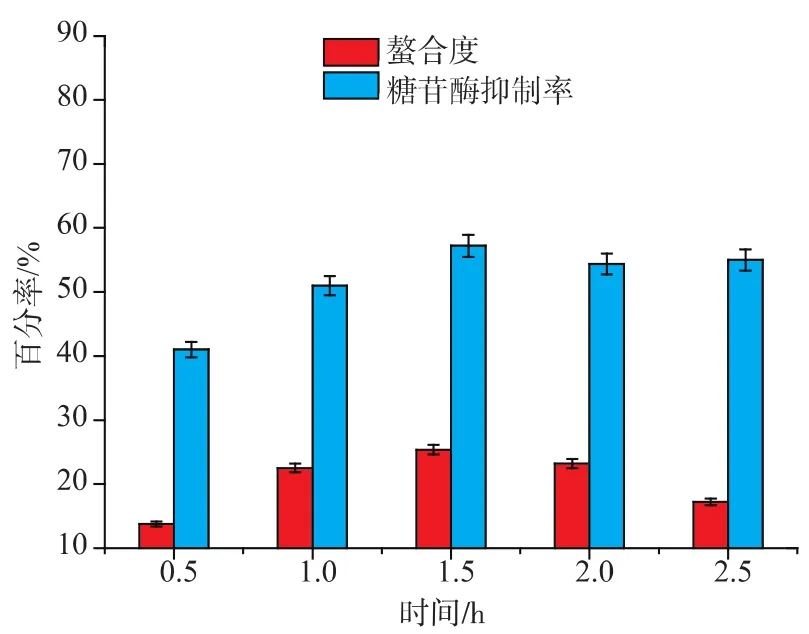
图4 时间对螯合度和抑制活性的影响Fig.4 Influence of Time on chelation and inhibition activity
0.5~1.5 h,螯合率和α-葡萄糖苷酶抑制活性逐渐上升,且在1.5 h时达到最高,1.5 h之后,螯合率和抑制活性均有所降低。说明螯合实验中供电基团和离子是动态运动,并不停反应的,一定时间之后,离子或者供电基团饱和,螯合度不再增加,时间过长,影响螯合溶液中离子或者供电基团的运动,螯合度降低,进而影响α-糖苷酶抑制活性。因此选择时间1.5 h进行螯合。
2.3.4 温度对螯合反应和抑制活性的影响 配置多肽质量浓度10 mg/mL,pH 4.5,分别置于30、37、40、50、60 ℃中水浴螯合 30 min,结果见图5。
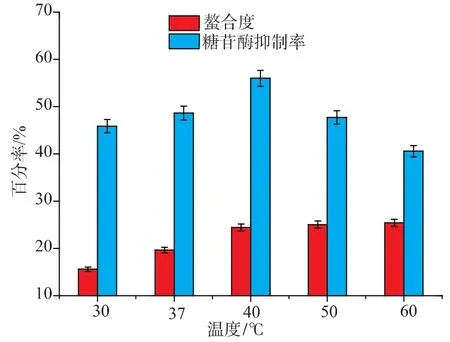
图5 温度对螯合度和抑制活性的影响Fig.5 Influence of Temperatureon chelation and inhibition activity
温度在低于40℃时螯合度逐渐上升,40℃之后,螯合度基本稳定,可能是因为螯合是一个动态过程,温度升高有利于分子运动,促进螯合反应的进行。温度大于40℃时,分子间运动较快,螯合反应不受分子间力的变化而变化;温度低于40℃时α-糖苷酶抑制活性逐渐上升。40℃时抑制活性达到最大,40℃之后,α-糖苷酶抑制活性缓慢降低,说明低温影响α-糖苷酶抑制率活性,温度升高不但可以激活多肽,还能促进螯合进行,发挥更好的抑制活性。温度高于40℃时,影响多肽螯合物的稳定性,进而影响抑制活性。因此,优选温度40℃进行螯合反应。
2.4 螯合反应的正交实验分析
为了进一步优化螯合工艺,选择温度、时间、pH、多肽浓度4个因素进行四因素三水平正交实验,见表1。实验以1 mg/mL螯合肽对α-糖苷酶活性抑制率为指标,进行 L9(34)正交试验,结果见表2。
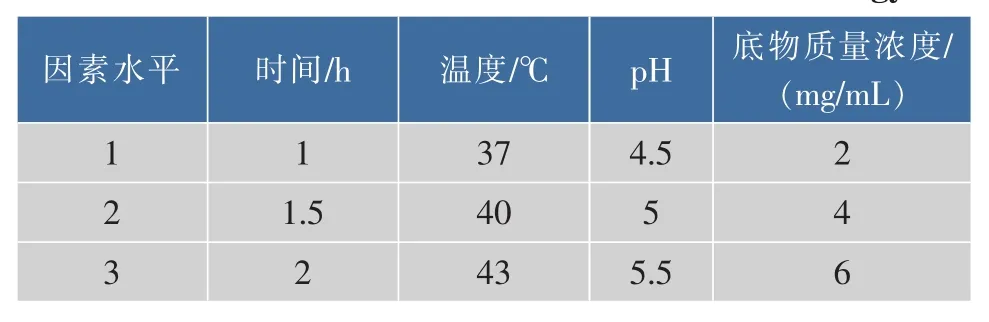
表1 因素水平表Table1 Factors and levels of chelation technology
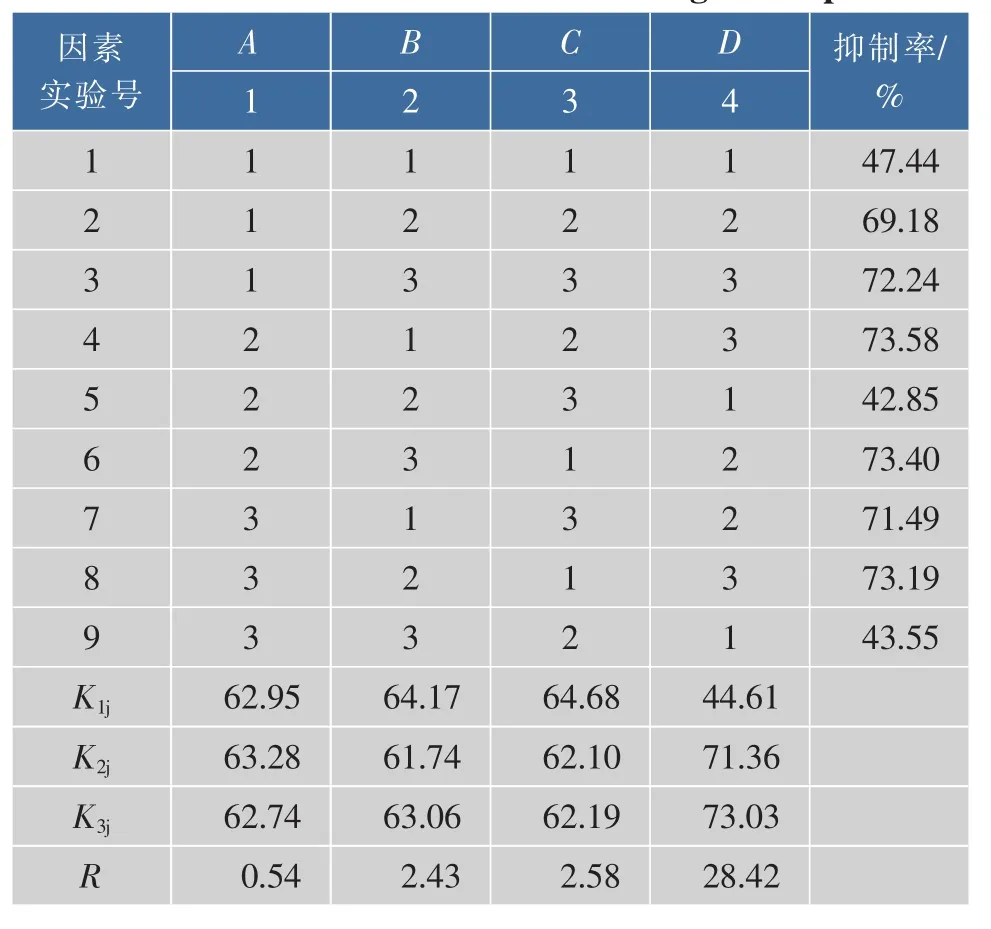
表2 螯合反应正交分析结果Table2 Chelate reaction results of orthogonal experiment
根据表2,对α-葡萄糖苷酶抑制活性影响的显著次序为:D→C→B→A,即底物浓度>pH>温度>时间。α-葡萄糖苷酶抑制活性肽螯合锌的最佳条件为:A2B1C1D3。用最优实验组合再次实验,获得螯合多肽的螯合度为25.6%,1 mg/mL的螯合活性肽对α-葡萄糖苷酶抑制率为79.8%,因此螯合的最佳条件为:1.5 h,pH 4.5,37 ℃,6 mg/mL。
2.5 体外模拟胃肠稳定性
胃肠消化模型主要是针对食品在消化过程中活性变化建立的,反映样品在人体内的消化吸收情况。本实验主要考察样品对胃蛋白酶和胰蛋白酶的耐受性,反映Zn-糖苷酶抑制螯合活性肽在胃消化阶段和十二指肠消化阶段的抑制活性稳定情况。由图6模拟胃液消化过程可知,随着时间和胃蛋白酶量的增加,抑制活性在一定范围内保持稳定,当时间达到1.5 h,胃蛋白酶质量∶活性肽质量达到16时,抑制活性开始降低,但降低的幅度较小,说明糖苷酶抑制-Zn螯合肽在胃消化阶段,具有较强的活性稳定性。刘珊珊等[18]研究酪蛋白抗氧化肽的胃肠消化稳定性发现经过胃蛋白酶消化后,抗氧化活性出现显著降低。CHEN等[19]研究发现蛋清蛋白肽在经过胃肠消化阶段后ACE抑制活性降低。糖苷酶抑制-Zn螯合肽经过肠道消化阶段稳定性见图7。
十二指肠消化阶段,活性多肽的抑制率基本保持稳定,抑制活性不随时间和胰蛋白酶的质量增加而降低,说明其对胰蛋白酶的耐受性也较好,α-葡萄糖苷酶抑制-Zn螯合活性肽在模拟胃肠消化过程中都能够很好地保持α-葡萄糖苷酶的抑制活性,发挥正常的生物活性,并且可以作为功能成分提高矿物质的吸收。
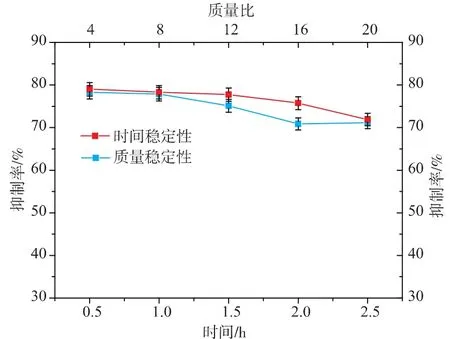
图6 糖苷酶抑制-Zn螯合肽在模拟肠消化阶段的稳定性Fig.6 Stability of the chelate complex of Zn-peptide in the simulated gastric phase

图7 糖苷酶抑制-Zn螯合肽在模拟肠消化阶段的稳定性Fig.7 Stability of the chelate complex of Zn-peptide in the simulated intestinal phase
这些特性表征和其为一群分子量比较低,且有特定氨基酸序列的小肽组成有密切关系。
3 结 语
本实验以紫菜为原料酶解制备的α-葡萄糖苷酶抑制活性肽与锌螯合的最佳螯合条件为:时间1.5 h,pH 4.5,温度 37 ℃,质量浓度 6 mg/mL,螯合度为25.6%。得到的锌螯合肽对0.5 mg/mL的α-葡萄糖苷酶抑制活性达到约79.8%,比未螯合的多肽α-葡萄糖苷酶抑制活性提高了17.35%倍,且模拟体外胃肠消化时抑制活性稳定性较好,说明锌螯合肽可以作为一种潜在的预防和治疗糖尿病的保健食品。

