水煎液成分的表面增强拉曼散射光谱检测
洪全兴, 周嘉惠, 李 洁, 王晓阳, 张中萍, 俞 允, 魏国强, 林 多, 陈伟炜, 黄 浩
(1. 福建中医药大学中西医结合学院, 福建 福州 350122; 2. 福州大学科技处, 福建 福州 350108; 3. 南京军区福州总医院医学影像科, 福建 福州 350025; 4. 福建中医药大学附属第三人民医院, 福建 福州 350122)
0 引言
茵陈蒿汤[1]在临床上广泛用于肝炎治疗, 现有的化学成分检测方法[2](如色谱法)耗时持久. 拉曼技术具有便捷、 无损等优点[3], 已被用于检测水煎液化学成分[4-5], 但液体的强荧光背景很容易覆盖拉曼信号. 表面增强拉曼散射(surface-enhanced Raman scattering, SERS)技术可淬灭荧光[6], 增强拉曼信号, 实现高灵敏度的测量, 特别适合检测水煎液[7].
本研究利用SERS技术结合多元统计算法, 包括主成分分析(principal component analysis, PCA)、 线性判别分析(linear discriminant analysis, LDA)和支持向量机(support vector machine, SVM), 检测判别两种不同配比的茵陈蒿汤水煎液, 进而探索一种能快速检测分析水煎液化学成分的方法, 该研究有助于水煎液质量控制和制剂生产的规范化.
1 材料与方法
1.1 水煎液制备
水煎液通过合理配比, 能使不同配方成分相互增强或制约, 达到增加疗效及减少毒性的目的, 因此不同配比水煎液的具体疗效存在差异. 本研究中水煎液Ⅰ依据茵陈蒿汤原方[8], 取茵陈18 g、 栀子12 g及大黄6 g加入1 000 mL水中, 煎煮2 h后过滤并收集滤液, 加热浓缩至100 mL后冷却至室温. 水煎液Ⅱ为临床常用配比, 取茵陈18 g、 栀子15 g及大黄6 g, 制成水煎液. 与水煎液Ⅰ相比, 适当增加了栀子用量, 由于栀子的主要化学成分栀子苷具有护肝、 利胆、 降压功效, 因此可增强清热利湿、 泻火除烦、 凉血解毒的疗效[9].
1.2 SERS检测
1.2.1水煎液最佳SERS检测条件的确定
首先比较不同粒径银纳米粒子的水煎液SERS增强效果. 根据Leopold的方法[10], 制备三种粒径的银纳米粒子, 如图1所示. 其中. 图1(a)的银纳米粒子粒径为(24±5) nm, 图1(b)粒径为(40±6) nm, 图1(c)粒径为(87±11)nm.

图1 不同粒径银胶的透射电镜图Fig.1 TEM micrograph of Ag colloids with different particle sizes

图2 不同粒径大小的银胶作用下的水煎液SERS光谱Fig.2 SERS spectra of decoction under the action of Ag colloids with different particle sizes
取10 μL水煎液分别与三种银胶等体积混匀后滴加于载玻片上检测SERS光谱. 785 nm半导体激光器输出功率200 mW; 测量范围500~1 700 cm-1, 采用莱卡50×镜头(数值孔径为0.75)采集散射信号, 光斑直径约10 μm, 光谱分辨率为2 cm-1, 积分时间10 s. 每种样品均随机位置检测3条谱线, 并计算平均谱作为该样品的SERS光谱, 所得谱线如图2所示. 粒径40 nm的银纳米粒子与水煎液混合后的SERS光谱具有最佳的拉曼峰强度及信噪比, 故后续研究将采用该粒径的纳米粒子.
其次探究银胶和水煎液不同体积比混合后的SERS检测效果(如图3所示). 从图3可见, 水煎液与银胶等体积混合后检测获取的SERS光谱信噪比最好, 故后续研究均采用10 μL水煎液与银胶等体积混合.
SERS增强效果的实现需满足一个前提条件, 就是检测样本要有效地附着在拉曼信号增强基底表面. 水煎液的拉曼信号增强主要是由激发光子与银纳米粒子表面的电子产生共振所引起的. 银纳米粒子表面的自由电子在入射光作用下产生运动, 形成表面等离子激元共振, 此时在银粒子表面形成巨大的局域电磁场, 从而显著增强附着在银纳米粒子表面的水煎液分子的拉曼信号.

图3 银胶与水煎液不同体积比混合后的SERS光谱Fig.3 SERS spectra of decoction mixed with different volume of Ag colloids
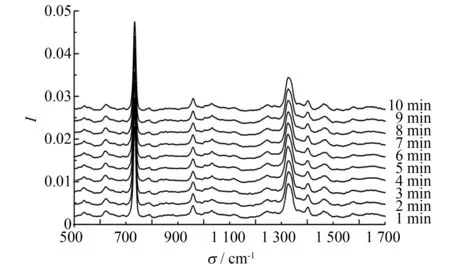
图4 同一水煎液样本不同时间检测获取的SERS光谱Fig.4 Time-resolved SERS spectra recorded at 1 min intervals at a same decoction sample
进一步分析水煎液SERS检测的重复性及稳定性. 取10 μL水煎液与等体积银胶混匀后滴加于载玻片上, 以1 min为间隔, 先后检测样本10个不同位置的SERS光谱, 所得谱线如图4所示. 从图4可以看出, 由于检测过程中样本处于液态, 故所得谱线的重复性及稳定性较好.
1.2.2两种水煎液SERS检测分析
水煎液Ⅰ和水煎液Ⅱ分别取10 μL与银胶等体积混匀后滴加于载玻片上检测SERS光谱. 检测条件如前所述. 两种水煎液均检测50个样品, 每个样品均随机位置检测3条谱线, 并计算平均谱作为该样品的SERS光谱.
1.3 数据分析
首先对原始数据进行荧光背景扣除、 归一化等处理[11], 随后将光谱数据导入SPSS 15.0(SPSS Inc., Chicago)进行PCA处理, 进而获取具有显著性差异(P<0.05)的主成分[12]. 再进一步通过LDA和SVM算法对获取的主成分进行判别分析, 其中LDA选择留一交叉验证法(leave-one-out cross-validation method); 而SVM的核函数为高斯径向基函数(Gaussian radial basis function)[12].
2 结果与讨论
两种水煎液的SERS光谱对比如图5所示. 水煎液Ⅰ和Ⅱ的具体SERS光谱峰位置及其初步归属如表1[6-7]所示 . 两种水煎液SERS谱峰极为相似, 表明两种水煎液所包含的生化物质成分基本相同. 两种水煎液的SERS光谱强度差异如图5 差谱曲线所示, 即便是水煎液Ⅰ和Ⅱ的SERS光谱中均出现的拉曼峰, 其峰强度也不一致. 两种水煎液的SERS光谱如图6所示, 其中623、 734、 961及1 331 cm-1等拉曼峰的强度都存在显著性差异(P< 0.05). 这一结果表明, 两种水煎液中相同化学成分的具体含量也有所区别. 此外, 水煎液Ⅰ和Ⅱ所用药物种类相同, 只是药物用量存在差异, 但是测得的拉曼峰位也存在区别. 如654和1 517 cm-1拉曼峰只存在于水煎液Ⅰ的SERS光谱中, 而1 002 cm-1峰只存在于水煎液Ⅱ的SERS光谱中. 这可能是由于药物在煎煮过程中所含化学成分发生反应, 因药物配比不同, 故反应生成的复合物中成分含量及种类存在细微区别, 而高灵敏度的SERS光谱可检测到这些差异.

图5 水煎液SERS光谱Fig.5 SERS spectra of decoction
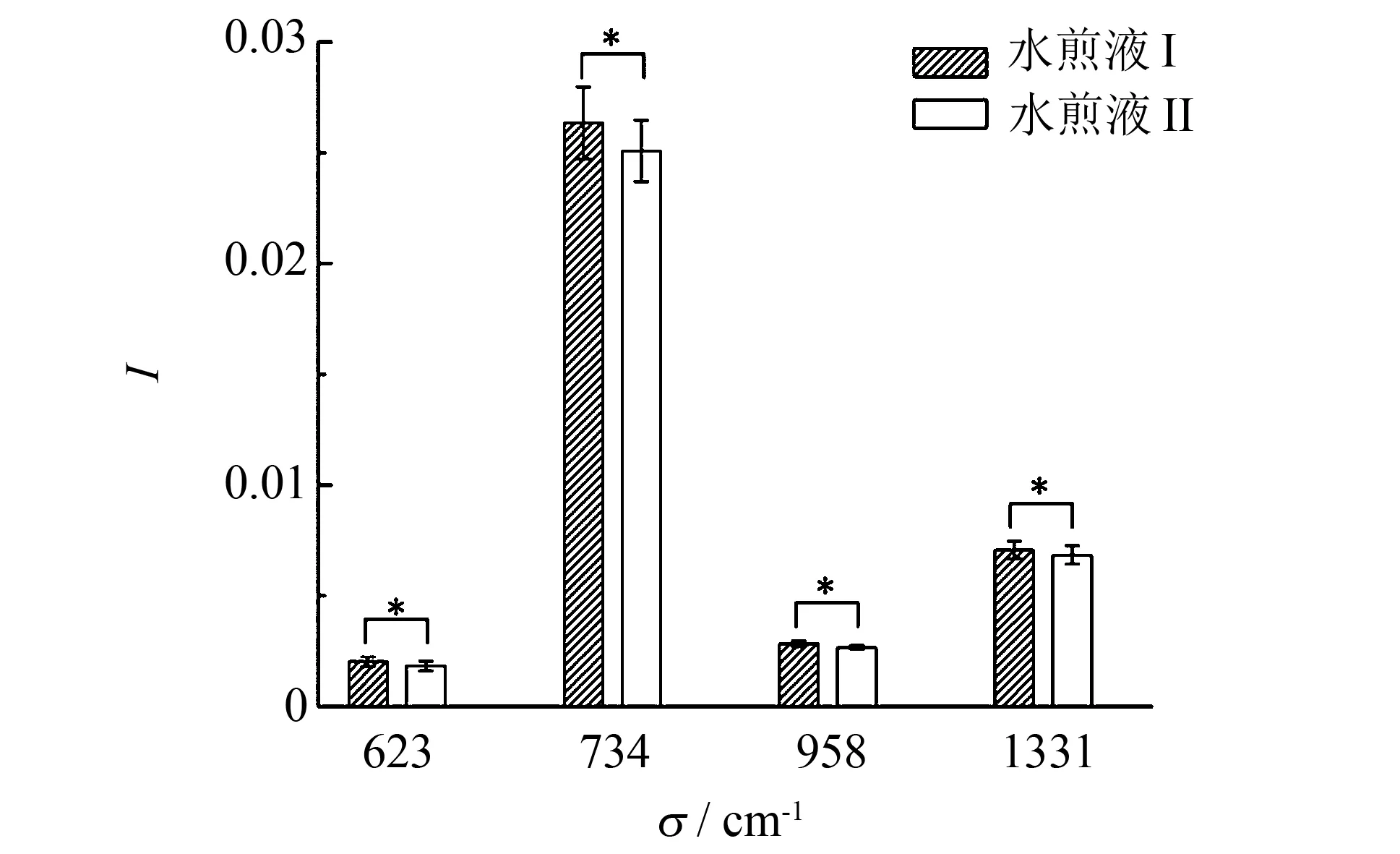
图6 两种水煎液的SERS谱峰强度柱状图(*代表P<0.05)Fig.6 Histogram displaying the prominent differences of SERS peak intensities for two kinds of decoction (*P<0.05)

表1 水煎液SERS光谱的谱峰及归属[6-7]

图7 水煎液SERS光谱主成分的三维分布图Fig.7 A three-dimensional mapping of the principal components for the decoction
PCA算法可针对全部SERS光谱进行分析[13-14]. 对经PCA后提取的主成分进行t检验, 可得出主成分1、 2、 3最具有诊断意义[15]. 三个主成分的光谱贡献率分别为49.82%、 22.16%以及13.65%, 累计贡献率达85.63%. 利用主成分1、 2、 3绘制的三维散点图如图7所示. 图7中, 代表水煎液Ⅰ和水煎液Ⅱ的数据点分布在三维图中可较好地区分. 进一步利用LDA及SVM建立判别模型用于区分两种水煎液, 所得结果如表2所示, 判别区分的灵敏度、 特异性、 正确率均为100%. 该结果表明, PCA算法提取主成分后再结合LDA以及SVM可有效地区分水煎液Ⅰ和Ⅱ的SERS光谱.

表2 LDA及SVM判别区分水煎液
3 结语
采用SERS技术检测分析茵陈蒿汤水煎液化学成分. SERS技术结合PCA、 LDA和SVM可有效区分两种水煎液, 判别正确率为100%. 该研究表明SERS技术可实现对水煎液化学成分的快速检测与鉴别, 可用于水煎液的品质监督与管控.

