机械敏感通道蛋白的研究进展
李 娟, 陈 珊, 李婧影, 杨黄浩
(1. 福州大学化学学院, 食品安全与生物分析教育部重点实验室, 福建 福州 350108; 2. 福州大学生物科学与工程学院, 福建 福州 350108)
0 引言
所有生物体-无论是单细胞细菌还是多细胞的动植物-在正常生长、 发育和维持健康的过程中, 都必定会对来自外部环境(如剪切力、 重力、 触碰)以及自身内部(包括渗透压和膜形变)的机械力产生感知和响应[1]. 生物体对机械力的感知参与了许多生理过程, 例如触觉、 肌肉运动知觉、 听觉、 痛觉, 许多细胞功能也与机械力相关, 包括基因表达、 流体稳态和小泡运输等[2]. 机械敏感通道蛋白是细胞产生对机械力感知和响应的分子基础. 这类蛋白嵌于细胞膜上, 可在毫秒内将机械刺激(例如细胞膜的张力和卷曲力)转化为电信号或生化信号, 从而引发对细胞过程的调节, 使细胞产生适应性反应. 因此, 机械敏感通道蛋白介导的机械力传导过程是迄今已知的生物体内最快速的传导体系. Guharay等[3]在1984年利用贴片钳技术在鸡胚胎的骨骼肌细胞里发现了机械敏感通道蛋白. 1994年, 来源于大肠杆菌的大电导机械敏感性离子通道(mechanosensitive channel of large conductance, MscL)成为了首个被克隆出来的机械敏感通道蛋白, 随后MscL的结构和机械响应机制也得到了充分的解析, 蛋白结构与细胞膜脂质特性之间的关系也因此被证明[4]. 迄今为止, MscL是被研究得最为透彻的一类机械敏感通道蛋白. 1998年克隆得到了第一个哺乳动物的机械敏感通道蛋白[5]. 在最近的20年里, 这类机械敏感通道蛋白逐渐成为生物力学研究领域的关注点. 研究者通过破译生物体基因组发现了多个具有机械敏感潜力的蛋白, 它们具有不同的功能和门控机制, 人们对其结构功能和作用机理的研究也仍在继续.
1 机械敏感通道蛋白分类
近年来, 被鉴定的真核机械敏感通道蛋白主要有退化蛋白/上皮钠离子通道(degenerin/epithelial sodium channel, DEG/ENaC)、 瞬态受体电位(transient receptor potential, TRP)通道、 双孔钾通道(two-pore-domain potassium channel, K2P)以及最新发现的Piezo蛋白.
1.1 退化蛋白/上皮钠离子通道(DEG/ENaC)
已发现DEG/ENaC家族通道蛋白共有5个成员(见图1), 最早被发现的是线虫退化蛋白MEC-4和DEG-1及哺乳动物上皮钠离子通道ENaC, 此外还包括哺乳动物酸敏感离子通道ASICs、 果蝇钠离子通道和软体动物中肽激活的钠离子通道(FMRF amide-activated Na+channel, FaNaC)[6]. 这类通道蛋白能够选择性地通过钠离子且可被阿米洛利阻断, 又因细胞外pH值下降而激活. DEG/ENaC通道蛋白家族具有相同的结构, 包括2个跨膜结构域、 1个富含半胱氨酸的胞外环以及位于胞内的N端和C端(见图2)[7]. DEG/ENaC家族通道蛋白在多种器官和组织内表达, 能够响应多种刺激, 包括机械力、 胞外低pH值环境以及FMRF酰胺四肽.

图1 DEG/ENaC通道蛋白家族类型[6]Fig.1 Type of DEG/ENaC channels family

图2 DEG/ENaC通道蛋白家族结构[7]Fig.2 Structure of DEG/ENaC channels family
1.2 瞬态受体电位(TRP)通道
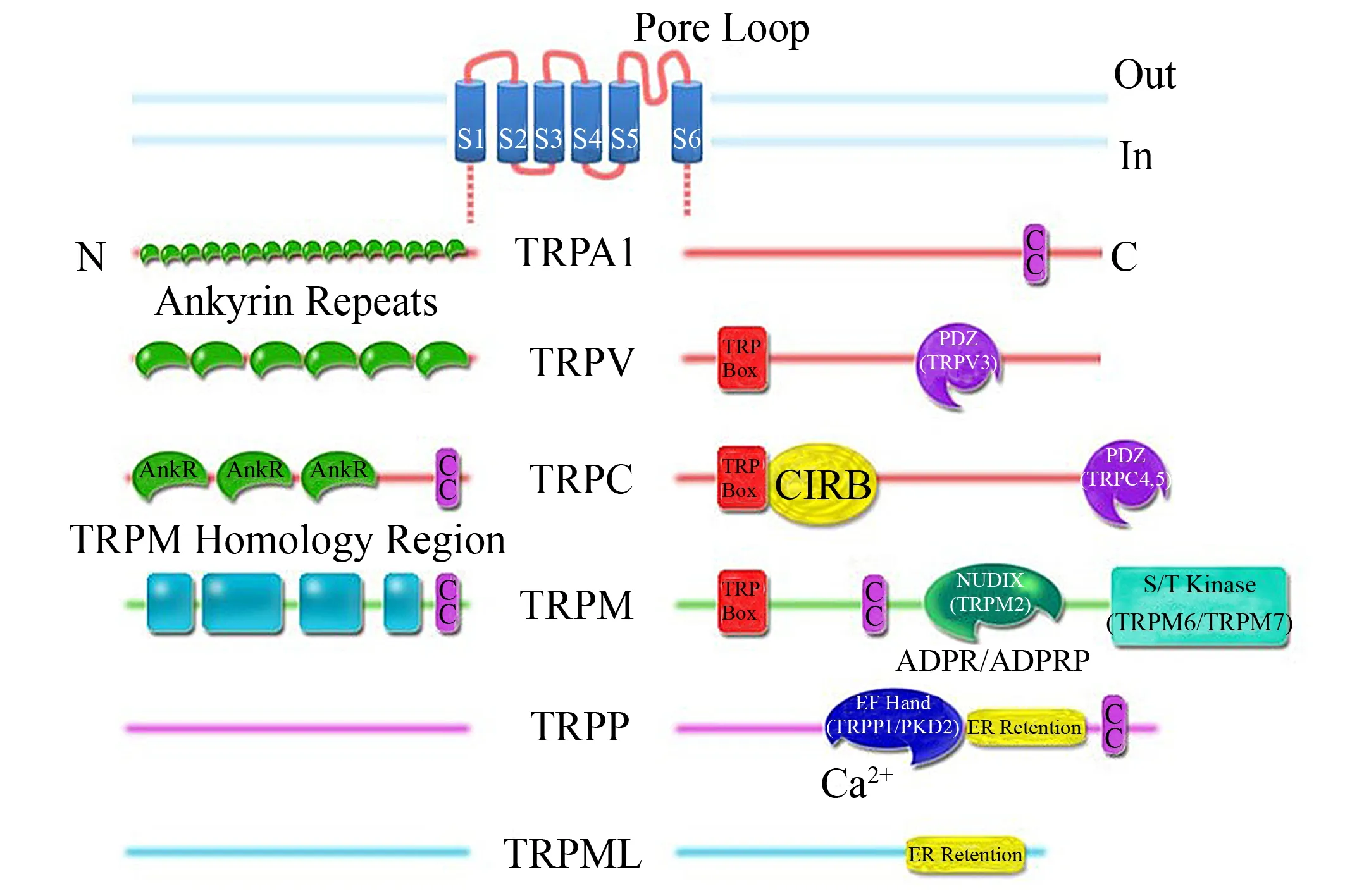
图3 TRP通道蛋白类型和结构[9]Fig.3 Type and structure of TRP channels family
TRP通道首次发现于1975年, Minke等[8]在果蝇的视觉传导系统中发现了trp基因, 可使光感受器具有钙离子依赖的光适应性; 而该基因突变后, 光感受器只能产生瞬时的感受电位, TRP通道因此而得名[8]. 大多数TRP通道蛋白对钙离子具有选择通透性, 这使得其他阳离子无法通过. TRP家族的通道蛋白由4个TRP亚基组成同源或异源四聚体. 动物体内的TRP蛋白根据序列的类似度可以分为7个亚类: TRPC、 TRPV、 TRPM、 TRPA、 TRPN、 TRPP和TRPML, 而酵母的TRPY蛋白由于亲缘关系最远构成了第8个亚类[9], 如图3所示. TRP家族的通道蛋白具有类似的结构, 都是由6个跨膜区以及位于胞内的N端和C端构成, 其中TRPP可能是个例外, 它多了一个跨膜区和一个位于胞外N端. 许多TRP蛋白在其氨基端有多个锚蛋白结构域(TRPM、 TRPP、 TRPML和TRPY除外). TRP通道蛋白广泛存在于各种器官中, 大量研究表明, 多种形式的机械刺激可以激活或者调控某些TRP通道蛋白[10].
1.3 双孔钾通道(K2P)
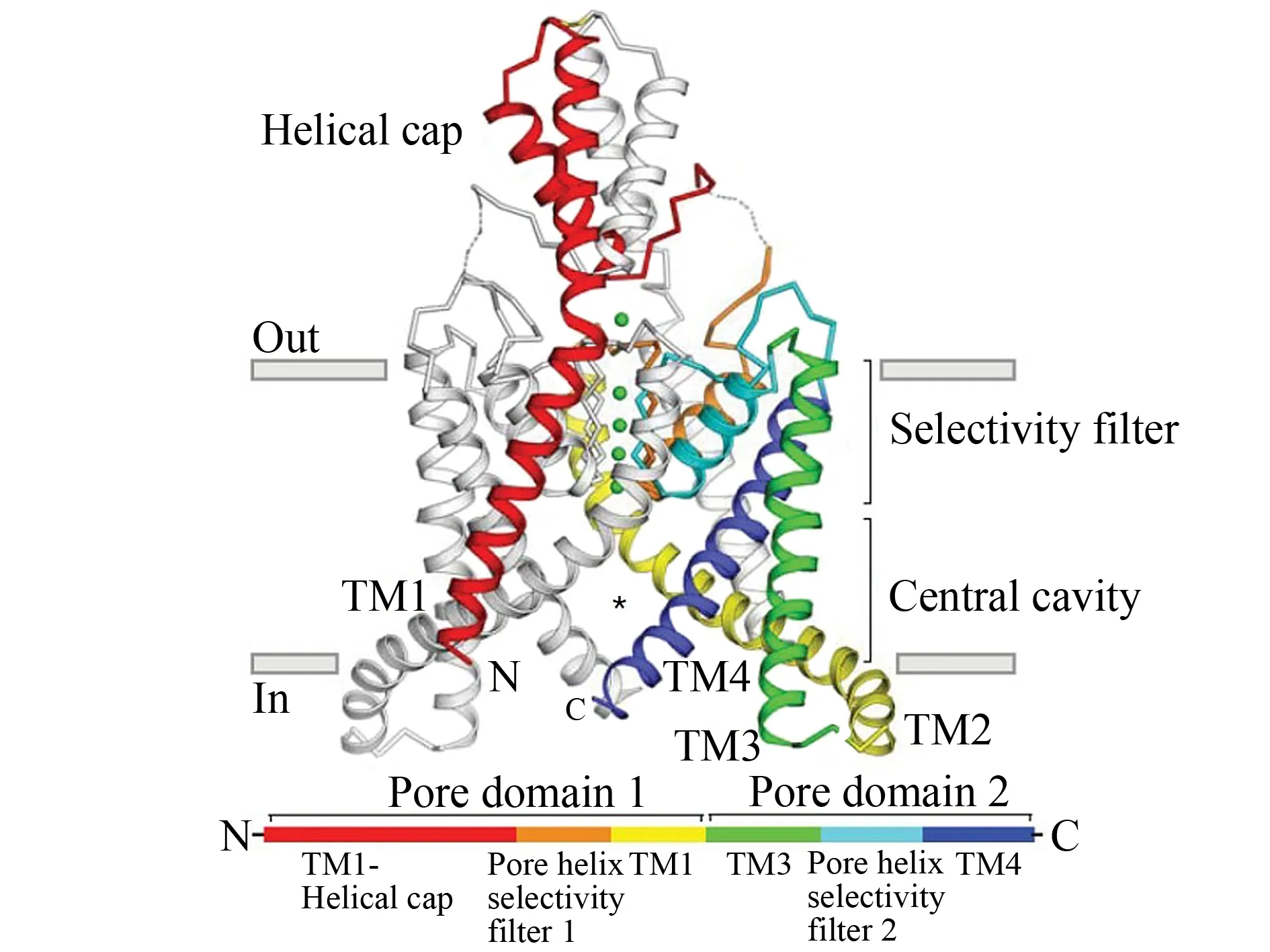
图4 K2p通道蛋白结构[12]Fig.4 Structure of K2p channels
钾离子通道是细胞内钾离子外流的离子通道, 会引起外向或内向电流, 广泛分布于骨骼肌、 神经系统、 心脏、 血管等细胞内, 是目前发现的亚型最多、 功能最复杂的一类离子通道. 其中, K2P通道蛋白是细胞钾离子通道蛋白家族中的一个重要类型[11]. K2P通道蛋白由同源或异源二聚的亚基构成, 每个亚基含有4个跨膜片段、 两个孔道结构域和胞内的N端和C端(见图4). K2P通道家族内的序列同源性很低, 只有孔道结构域具有最高的保守度. 研究发现, 3种K2P通道在体外具有机械门控的性质: TWIK相关钾离子通道(TWIK-related K+channel 1, TREK-1)、 TREK-2和TWIK相关花生四烯酸受激钾离子通道(TWIK-related arachidonic acid-stimulated K+channel, TRAAK). 异源表达的TREK-1可以对完整细胞以及离体斑块的膜拉伸产生响应, 证明了机械力可以控制该通道. 类似的机械刺激也能够激活异源表达TREK-2和TRAAK通道. 它们对机械力的感应范围很广、 响应阈值很低(0.5~12 mN·m-1), 感受到的机械力越强, 通道打开的可能性也越高[12]. 此外, TREK-1和TREK-2也能够对细胞膜去极化过程、 胞质pH值降低、 温度升高以及加入的挥发性麻醉剂、 多不饱和脂肪酸和磷脂产生响应. 异源表达的TRAAK同样能被除挥发性麻醉剂和酸性环境之外的其他刺激激活. 此外, K2P通道蛋白对心率失常、 细胞凋亡、 脑缺血保护、 动脉张力调节等病理过程有非常重要的影响.
1.4 Piezo蛋白
2010年, Coste等[13]在小鼠神经母细胞瘤里发现Piezo1、Piezo2两个基因(来源于希腊语“piezein”, 意为压力)对机械力门控非选择性阳离子电流的产生至关重要[13]. 随后证实了Piezo通道蛋白是一类新型的机械敏感通道蛋白, 广泛存在于肾脏、 膀胱、 结肠、 血管、 肺、 神经节等多种组织, 可以非选择性地通过二价离子Ca2+、 Mg2+、 Mn2+、 Ba2+及一价碱性离子K+、 Na+等(见图5)[14]. Piezo机械敏感通道蛋白家族有两个结构与基因相似的蛋白Piezo1和Piezo2, 它们由约2 500个氨基酸组成, 包含24~36个跨膜区, 可以算是人类已知的跨膜区最多的蛋白, 且与其他目前已知的机械敏感通道蛋白或者电压敏感通道蛋白没有同源性[15]. 一系列研究结果表明, Piezo1蛋白在细胞对力学刺激的感应方面具有重要作用. Piezo2蛋白主要存在于神经元中, 在敲除Piezo2相关基因后, 神经细胞失去了对刺激的反应能力. 在人体中,Piezo1和Piezo2的基因编码区突变会引起遗传性干瘪红细胞增多症和远端关节弯曲综合症等遗传性疾病, 证明该蛋白在人体生理功能中的重要性以及与疾病的相关性, 因此具有作为重要药物靶点的潜在前景[16].
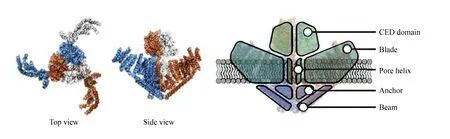
图5 Piezo通道蛋白结构[14]Fig.5 Structure of Piezo channels
1.5 其他机械敏感通道蛋白
除了上述几类机械敏感通道蛋白之外, 一些电压门控或者配体门控的通道蛋白, 如Shaker-IR钾离子通道蛋白、 N型钙离子通道蛋白、 NMDA受体通道蛋白、 钙离子依赖BK通道蛋白(BKCa)和G-蛋白偶联受体(G protein-coupled receptors, GCPR)等都展现出一定的机械敏感性, 但与其生理功能没有直接关系[17-18].
2 机械刺激类型
为了更好地阐明机械敏感通道蛋白的作用机理和功能, 研究者通过构建机械刺激模型可以实现对细胞的通道蛋白施加不同类型刺激以达到研究目的. 目前用于刺激机械敏感通道蛋白的机械力主要包括拉伸力、 流体剪切力、 压应力和超声刺激等.
2.1 拉伸力
许多研究表明, 对细胞施加拉伸力能通过细胞膜产生的张力激活多种机械敏感通道蛋白: K2p通道蛋白家族的TREK-1和TRAAK均对细胞膜拉伸力产生响应[19]; Loukin等[20]发现TRPV4能被由细胞膜凸起产生的拉伸力激活. Li等[21]利用细胞牵张拉伸刺激系统对软骨细胞施加拉伸力, 引起Ca2+内流和内质网应激反应, 进而导致软骨细胞的凋亡; 而Piezo1蛋白的抑制剂GsMTx4能有效地抑制这一过程, 证明了Piezo1参与骨性关节炎的软骨细胞晚期凋亡过程.
2.2 剪切力
剪切力是流体在细胞上流动产生的摩擦力, 例如动脉和静脉内的内皮细胞感知血液流动的力量. Cinar等[22]采用微流控系统作为流体剪切力的产生装置, 通过控制通道的宽度来调节剪切力的大小, 揭示正常红细胞表面的Piezo1通道蛋白参与了由剪切力介导的Ca2+内流和ATP释放的过程. Soffe等[23]的研究结果表明, 向稳定表达TRPV4的HEK293细胞施加剪切力能激活TRPV4通道, 并导致细胞内Ca2+水平升高. 此外, 也有研究表明TRPP1通道蛋白表达于血管内皮细胞的纤毛上, 当血流产生的流体剪切力作用于细胞时, 纤毛作为上皮细胞剪切力传感器发生弯曲, 进而通过TRPP1通道蛋白介导细胞内Ca2+浓度升高和NO合成过程[24].
2.3 压应力
基于原子力显微镜(AFM)系统对细胞产生的压应力也能激活机械敏感通道蛋白. Lee等[25]报道了利用原子力显微镜悬臂对软骨细胞精确施加压应力, 能激活Piezo1/2, 引发Ca2+内流, 而加入Piezo1/2的多肽抑制剂GsMTx4或特异性siRNA能够抑制Ca2+的内流过程. 近来的研究进一步发现, 细胞外基质(extracellular matrix, ECM)蛋白使Piezo1蛋白对机械力更加敏感. 在没有ECM蛋白存在的情况下, Piezo1蛋白对由AFM悬臂产生的推动细胞膜的机械力相对不敏感; 在悬臂的末端修饰上包裹ECM蛋白的珠子之后, 能促进其和细胞的相互作用, 在细胞间形成机械联结网络, 使拉动细胞膜的力量能更有效地激活Piezo1通道蛋白[26].
2.4 超声
超声是一种非侵入式的刺激方式, 可以无损伤地穿透大脑和其他组织内部, 具有较高的时空分辨率. 2015年, Ibsen等[27]鉴定了一种能够响应超声波的机械敏感蛋白TRP-4, 并将其表达在线虫的神经元上, 实现超声波介导的感觉神经元的功能调控. 随后的研究发现, 将K2P家族的TREK-1、 TREK-2和TRAAK表达于卵母细胞中, 也能够响应超声刺激[28]. 2018年, Pan等[29]利用超声技术激活T细胞表面的机械敏感离子通道蛋白Piezo1, 诱发下游的基因转录过程, 用于嵌合抗原受体T细胞免疫治疗. Ye等[30]的近期研究表明, 超声能精确控制神经元的兴奋性, 他们将来自细菌的机械敏感性通道蛋白MscL通过病毒感染的方式表达在大鼠神经元中, 利用超声刺激激活MscL, 成功地赋予大鼠神经元超声敏感性.
3 机械敏感通道蛋白的生理功能及其与疾病的关系
3.1 心血管系统
机械敏感通道蛋白被认为是导致心脏肥大的重要因素之一, 并与多种形式的心力衰竭相关. 由于心室心肌细胞的机械变形与某些TRPCs通道蛋白的调节性表达有关, 可能改变心室肌细胞对钙离子的调控, 使得TRPC通道蛋白成为关注的热点. 因此, 由机械敏感通道蛋白为分子基础构成的心脏机械传导对患病的和正常的心脏都具有重要的影响[31]. Yao课题组近期的研究证明了TRPC5通道的拉伸激活性及其在低渗透和动脉压力感受器机械补偿激活的全细胞离子电流中的作用[32]. 此外, 在患有慢性心力衰竭的动物中, 主动脉压力感受器终末与细胞体的βENaC和γENaC蛋白的表达量降低, 导致了主动脉压力感受器敏感性下降. 因而, 压力感受器有可能成为降低慢性心力衰竭死亡率的有效治疗靶点[33]. 机械敏感通道蛋白还与另一种常见的心脏功能缺陷-房颤有关. TASK-1通道蛋白在心房肌细胞上有大量表达, 并且近期研究发现, 在心脏发生房颤过程中TASK-1蛋白的重构参与了心房电重构. 在鼠的房颤和心脏衰竭的模型中发现TASK-1在心房细胞上的失调证明了机械敏感通道蛋白与心率失调发病机制有关, 也为相关药物的研发提供了依据[34].
3.2 神经系统
ASIC是DEG/ENaC家族的一个成员蛋白, 在哺乳动物的中枢和外周神经系统里至少有7个亚型的ASIC通道蛋白高表达. 相关基因的突变会引起肌肉、 皮肤以及胃肠道中神经机械传导功能的丧失, 因此ASIC通道蛋白有助于在不同类型的感官神经中的机械传导发挥正常功能, 从而支配所有外围组织和器官[35]. 研究者在大鼠的视网膜神经节细胞中发现了TRPV4通道蛋白的表达, 实验证明TRPV4引发的钙内流可能与高眼压所致的神经节细胞凋亡有关[36]. 另外, Piezo2蛋白的突变与远端关节挛缩5(distal arthrogryposis type 5, DA5)有关, DA5是一种以严重关节挛缩为特征的先天性疾病. 由于在肌肉和关节的细胞中没有发现Piezo2蛋白的表达, 研究者认为DA5可能是由外周敏感神经元中Piezo2蛋白的过度活跃导致的[37].
3.3 肿瘤
机械敏感通道蛋白在肿瘤发生发展过程中的作用主要是与肿瘤转移和血管生成等过程有关. Schreibmayer课题组首次证实了恶性人类乳腺上皮细胞中机械敏感通道蛋白的存在, 并推断这些机械敏感通道蛋白是以Piezo1蛋白为主[38]; 同时, 恶性乳腺上皮细胞MCF-7比非癌变的MCF-10A细胞对机械刺激更为敏感[39]. 而这一现象在其他组织的癌症细胞中并非完全相同. 例如, 在肺癌细胞里Piezo1的表达量是明显低于正常肺上皮细胞的[40]. 通过基因敲除肺上皮细胞的Piezo1基因, 能够降低细胞黏附、 促进细胞迁移, 并且在胃癌细胞也观察到了Piezo1蛋白表达降低的现象[41]. 除了Piezo蛋白之外, TRPV4和P2X7机械敏感通道蛋白在肿瘤转移中也发挥了重要作用, 促进了肿瘤新生血管生成、 跨内皮迁移并且提高了肿瘤细胞运动性; 但与之相悖的, 它们也与依赖于激活水平的癌细胞死亡有关, 这也说明了机械敏感通道蛋白在细胞中具有非常复杂的功能性[42]. 因此, 对机械敏感通道蛋白在肿瘤发展过程中的作用进行透彻地解析将有助于开发新的针对肿瘤转移的治疗药物.
4 结语
机械敏感通道蛋白在生物体的触觉、 听觉、 本体感知等感觉生成过程中起到了重要的作用, 同时, 也参与了心血管、 神经、 消化系统等多种组织器官对压力、 流体剪切力等机械刺激的感知过程, 是许多疾病产生和发展的分子基础. 然而, 各种机械敏感通道蛋白在不同生理或病理过程中发挥的作用和机制不尽相同, 其分子作用机制尚不明确. 因此, 研究机械敏感通道蛋白在生理过程中的作用, 将为相关疾病的治疗以及药物靶点的开发提供新的研究方向和重要的理论支持.

