铜绿微囊藻衰亡过程中产甲烷动态及关键影响因子
刘艺,许浩廉,毛羽丰,李宏,艾海男,何强
(重庆大学 三峡库区生态环境教育部重点实验室,重庆 400045)
湖泊生态系统是内陆水域中CH4产生的源头之一,其CH4释放量占到自然源CH4释放总量的16%~24%[1-3]。尤其在初级生产力较高的富营养化湖泊中,CH4和CO2的释放量会显著增加[4-5],可见,水华藻类衰亡对湖泊碳素释放的贡献不可忽视。
目前,对于水华藻类衰亡的研究主要集中在藻类衰亡对水环境的影响[6-8],以及由此带来的对沉积物物质释放[9]和水生植物生理生态[10-11]的影响。实际上,藻类衰亡在改变水环境条件的同时,势必会影响其中的碳代谢过程。West等[12]对比了黑暗密闭条件下斜生栅藻和枫叶对温带湖泊产CH4的影响,得出藻源有机质(AOM)比陆源有机质对水生系统产CH4的促进作用更为显著。Grasset等[13]研究了黑暗密闭条件下蓝绿藻和3种植物叶片对淡水沉积物产CH4和CO2的影响,发现蓝绿藻对产CH4和CO2的促进作用最强。以上研究均在黑暗密闭的条件下进行,为了更客观地反映藻类自然衰亡过程,Lenhart等[14]通过室内试验模拟了自然光照下赫氏颗石藻的衰亡,得到赫氏颗石藻碳素对CH4产生有贡献作用。Liang等[15]通过室内试验发现,在自然条件下丝状藻衰亡能显著促进CH4的释放。以上研究虽然模拟了藻类的自然衰亡,但较多地注重碳素释放的结果,对于水华藻类衰亡各阶段碳素释放的特点,藻华堆积区藻快速衰亡和自然衰亡过程下CH4产生量的差异,以及环境因子和AOM各组分对产CH4的贡献还鲜有报道。
以铜绿微囊藻为研究对象,通过室内模拟试验,研究高密度铜绿微囊藻自然衰亡和快速衰亡过程中产CH4过程,以及影响CH4和CO2释放的主导环境因子,以期进一步认识铜绿微囊藻水华对湖泊碳行为的影响。
1 材料与方法
1.1 实验材料
试验原水采集于重庆大学民主湖(29°34′00″N,106°27′57″E),经0.22 μm滤膜减压过滤,以去除原水中自带的藻类。在原水采集点采集深度小于10 cm的表层沉积物,混合均匀。
试验所用铜绿微囊藻(FACHB-905)购于中国科学院武汉水生生物研究所。用BG-11培养基对藻种进行扩大培养,培养至稳定生长期的藻离心后用15 mg/L的NaHCO3溶液洗涤,加入滤后原水配成藻类干密度为0.70 g/L的新鲜藻液[6]。采用细胞破碎仪(JY92-IID,新芝)对新鲜藻液进行超声破碎处理,以模拟藻华堆积区藻的快速衰亡过程,超声在冰浴中进行,避免超声使蛋白等物质变性[16]。
1.2 实验装置及处理
藻类衰亡试验在500 mL血清瓶中进行,如图1所示。每瓶由200 mL沉积物、300 mL藻液或滤后原水、125 mL顶空组成。试验设置3组处理:新鲜藻组,模拟藻华的自然衰亡(含300 mL新鲜藻液);破碎藻组,模拟藻华的快速衰亡(含300 mL破碎藻液)、对照组(含300 mL滤后原水),各处理设置3个重复。
血清瓶瓶口用无菌培养透气膜密封,沉积物四周用黑色遮光纸覆盖,避免光照的影响[17],放置在恒温光照培养箱中,保持温度(25±1.5)℃,最高光照度4 000 lx,光暗比12 h∶12 h。体系稳定1 d后开始试验。
试验持续41 d,每隔3~5 d测定上覆水pH、氧化还原电位(ORP)、溶解氧(DO)、叶绿素a(Chl-a),同时测定当天CH4和CO2的释放通量。在第1、7、21、41 d测定DOC和溶解性有机质的三维荧光光谱(EEM)。
1.3 指标及测试方法
1.3.1 水环境指标的测定 pH值用pH计(SevenCompact,METTLER)测定,ORP用ORP复合电极(LE501,METTLER)测定,DO用便携式溶解氧仪(HQ40d,HACH)测定。Chl-a采用丙酮提取法[18]测定。水样经滤膜过滤,用总有机碳分析仪(LiquiTOC-II,ELEMENTAR)测定DOC含量。EEM采用荧光分光光度计(F-7000,HITACHI)测定,用荧光区域积分法(FIR)[19]进行定量分析。
1.3.2 CH4和CO2的采集和测定 CH4和CO2气体的采集和测定参考浮箱法[20],用装有三通阀的瓶盖密封瓶口,用注射器通过三通阀抽取30 mL气体储存于采样袋中,间隔1 h后再次采气,CH4和CO2气体的浓度用气相色谱仪(GC1690,杭州捷岛)进行分析。气体释放通量F(μmolC/(m2·h)按式(1)计算。
(1)
式中:C0为初次采样的气体浓度,μmolC/L;Ct为t时刻采样的气体浓度,μmolC/L;V为血清瓶顶空体积,L;Vs为气体采样体积,L;T为采样的时间间隔h;A为水-气界面的表面积,m2。
1.4 数据分析
水环境指标和气体指标之间的相关性用皮尔逊(Pearson)相关系数法进行分析,各处理组指标的显著性差异用单因素方差分析(one-way ANOVA)检验。Chl-a衰减常数采用一阶指数衰减模型[21]进行拟合。
2 结果与讨论
2.1 铜绿微囊藻衰亡中水环境参数的变化
2.1.1 Chl-a的变化 Chl-a浓度是藻类生长和衰亡的标志[9]。如图2所示,加入藻液后,新鲜藻组和破碎藻组的Chl-a浓度分别达到了8.59 mg/L和7.88 mg/L,远高于蓝藻水华暴发的阈值浓度[22],模拟了高浓度铜绿微囊藻水华暴发的情况。反应前4 d,加藻组的Chl-a降低速率最大,表明藻类在前4 d衰亡速度最快。反应13 d后,加藻组的Chl-a浓度与对照组一样维持在较低值,此时藻类基本完全衰亡。
新鲜藻组的Chl-a衰减常数为0.36 d-1,破碎藻组为0.83 d-1,表明经过超声处理后,快速衰亡的速率提高为自然衰亡的2倍以上。

图2 铜绿微囊藻衰亡过程中Chl-a的变化Fig.2 Variations in Chl-a during the decay of
2.1.2 ORP的变化 如图3(a)所示,对照组的ORP在整个试验中变化不大,维持在(134±34)mV。试验第1 d,新鲜藻组和破碎藻组的ORP迅速下降到5 mV和-280 mV。第4~10 d,加藻组的ORP呈下降趋势,在第10 d分别达到极低值-183 mV和-190 mV。第10~21 d,ORP开始回升,并在第31 d后回升到与对照组相当的水平。
破碎藻组在第1 d的ORP显著低于新鲜藻组,藻快速衰亡释放出还原态物质可能是破碎藻组初始ORP极低的原因[10]。试验前21 d,新鲜藻组的ORP始终高于破碎藻组,可能是新鲜藻组在缓慢衰亡过程中,存活的藻细胞光合作用释放出O2,部分补偿了DO消耗导致的ORP下降。
2.1.3 DO的变化 如图3(b)所示,对照组的DO在整个试验中维持在(6.57±1.03)mg/L的好氧状态。试验第4~21 d,加藻组的DO均维持在1 mg/L以下的缺氧状态,显著低于对照组。尚丽霞等[8]在研究蓝藻分解中发现,高浓度藻液在12 h内就能由好氧转化为厌氧(DO<0.5 mg/L)状态。吴婷婷等[10]在蓝藻堆积衰亡中也观察到1 d内DO快速降低到缺氧状态的现象。表明高浓度铜绿微囊藻衰亡会快速消耗水中DO,致使水体由好氧转变为缺氧状态。第21 d后,由于AOM的消耗,DO开始回升,并在31 d后上升到与对照组相当的水平。
与破碎藻组相比,新鲜藻组的DO在第1 d达到16.93 mg/L的超饱和状态,与罗宜富等[23]在调研阿哈水库藻类大量繁殖期水相DO浓度相似。试验4~13 d,加藻组的DO均较低(DO<0.52 mg/L)且相差不大。
2.1.4 pH的变化 如图3(c)所示,试验中对照组的pH维持在7.78±0.34的中性值附近。加藻后第 1 d,新鲜藻组的pH上升至10.16,破碎藻组pH略微升高为8.13。破碎藻组引起pH升高是由于铜绿微囊藻分解的AOM是弱碱性物质[24],而新鲜藻组初始pH显著高于破碎藻组则是大量新鲜铜绿微囊藻光合作用吸收CO2释放O2导致的[23]。第4 d后,微生物分解AOM产生了大量有机酸[10],加藻组的pH均逐渐降低。13 d后由于AOM的减少和CO2的扩散消耗,pH逐渐回升,并在31 d后上升到与对照组相当的水平。

图3 铜绿微囊藻衰亡过程中ORP、DO和pH的变化Fig.3 Variations in ORP, DO and pH during the decay
在铜绿微囊藻衰亡过程中,ORP、DO、pH的变化趋势表现出了时间上的一致性,结合Chl-a的变化,可将衰亡划定为4个时期:第1~4 d是鲜藻组和破碎藻组各指标差异最大的时期,为快速衰亡期;第4~13 d是加藻组与对照组各指标差异最大的时期,且3种水环境指标均随时间降低,为缓慢衰亡期;第13~31 d加藻组与对照组差异仍然显著,但3种指标随时间而逐渐回升,为完全衰亡前期;第31~41 d加藻组的3种指标恢复到与对照组相当的水平,为完全衰亡后期。
2.2 铜绿微囊藻衰亡中有机质的变化
破碎藻组DOC初始和峰值浓度均显著高于新鲜藻组,表明藻类快速衰亡促使AOM更快地释放到水中[26]。第41 d,新鲜藻组的DOC最终降解量(47.29 mg/L)与破碎藻组(47.77 mg/L)相当。

图4 铜绿微囊藻衰亡过程中上覆水DOC浓度的变化Fig.4 Variations in DOC concentration of overlying water during the decay of Microcystis
用特定区域标准化的百分荧光响应(Pi,n)衡量DOC成分的相对变化,如图5所示。对照组的初始DOC成分以类富里酸(区域Ⅲ)和类腐殖酸(区域Ⅴ)为主,表明天然水体的腐殖化程度较高。与对照组相比,加藻组的初始芳香蛋白类物质(区域Ⅰ、Ⅱ)和溶解性微生物代谢产物(区域Ⅳ)占比明显较高,表明铜绿微囊藻衰亡释放到水体中的AOM主要是芳香蛋白类物质,包括酶、藻青蛋白、氨基酸等[27]。随着AOM的溶出,加藻组的芳香蛋白类物质和溶解性微生物代谢产物的占比不断增加,在第7 d达到最大值。第7 d后,对照组和加藻组的芳香蛋白类物质、溶解性微生物代谢产物的占比逐渐减少,类富里酸和类腐殖酸的占比逐渐增大,表明铜绿微囊藻衰亡释放的不稳定性蛋白类物质逐渐被分解转化为富里酸和腐殖酸等强稳定性有机物[24, 28-29]。
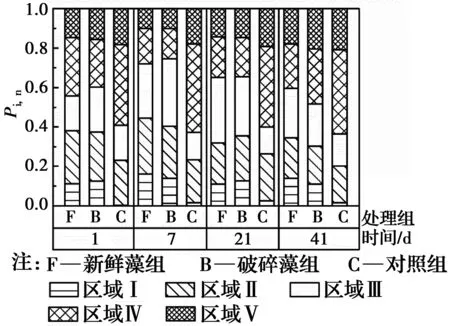
图5 铜绿微囊藻衰亡过程中DOC特定区域百分荧光响应(Pi,n)的变化Fig.5 Variations in the percent fluorescence response (Pi,n) in a specific region of DOC during the decay of
2.3 铜绿微囊藻衰亡中CH4和CO2气体的变化
2.3.1 CH4释放通量和累积释放量 如图6(a)所示,试验中对照组CH4释放通量较低(0.211±0.313)μmolC/(dm2·d)。第1~4 d,加藻组的CH4释放通量相比对照组有少量增加,但差异不明显。从第7 d开始,新鲜藻组和破碎藻组的CH4释放通量快速增加,并在第13 d达到最大,分别为13.699 μmolC/(dm2·d)和43.626 μmolC/(dm2·d)。第13 d后,加藻组的CH4释放通量逐渐降低,并在第31 d降低到与对照组相当的水平。
从图6(b)的CH4累积释放量来看,新鲜藻组和破碎藻组的CH4累积释放量分别为对照组的22.80倍37.72倍,表明高密度铜绿微囊藻衰亡显著促进了系统CH4的释放。
2.3.2 CO2释放通量和累积释放量 与CH4释放通量不同,对照组在试验过程中存在明显的CO2释放量(5.229±4.983)μmolC/(dm2·d)。第1~4 d,2个处理组的CO2释放通量均较低且无显著差异。从第7 d开始,CO2释放通量均迅速增加,对照组在第13 d达到最大释放通量16.295 μmolC/(dm2·d)。新鲜藻组和破碎藻组分别在第10 d和第13 d达到最大释放通量,分别为98.686 μmolC/(dm2·d)和60.184 μmolC/(dm2·d),显著高于对照组。第13 d后,3个处理组的CO2释放通量迅速降低,并在第31 d后降低到各自的最低值附近。
如图6(d)所示,新鲜藻组和破碎藻组的CO2累积释放量分别为对照组的5.36倍和4.03倍,表明高密度铜绿微囊藻衰亡在促进CH4释放的同时,也促进了CO2的生成和释放。
风影是充满内疚的,他不能给她床笫之欢,对一个女人来说,私处没有被磨擦刺激,得不到满足总是致命的伤。他的话语又不多,而她总是喋喋不休,没有人听她说话,没有可以倾诉的对象,她就自言自语。应当说,她是一个充满了生命激情的女子,身体里面仿佛有永远也用不完的力量,像一棵枝繁叶茂的生机勃勃的花树,而他呢,一阵风就会将他飘走,宛若一片落叶。有时候,他弱不禁风,有时候,他虚无缥缈,亦真亦幻,甚至她还怀疑他这种人的存在,是不是一种真实。
产气和水环境因子的变化遵循着相似的时间模式,根据CH4和CO2释放通量的变化,可将产气划分为4个时期:第1~4 d几乎没有气体产生为产气适应期;第4~13 d为产气上升期;第13~31 d为产气下降期;第31~41 d气体产生强度降低到较低的状态,为产气末期。
2.3.3 自然和快速衰亡中气体释放的差异 如图6(f)所示,加藻组的总C释放量显著高于对照组,但两加藻组之间差异不大,与两组第41 d的DOC降解量相当的结果一致,表明藻华堆积区藻的快速衰亡对碳素的总矿化效应几乎没有影响。
虽然加藻组在总C累积释放量上差异不大,但在气体释放的相对比例上存在显著差异。破碎藻组释放的气体中CH4的占比明显高于新鲜藻组,总C中27.49%是以CH4的形式释放的,而新鲜藻组释放的总C中CH4仅占14.74%。表明高密度铜绿微囊藻衰亡的不同过程可导致碳素归趋的差异。
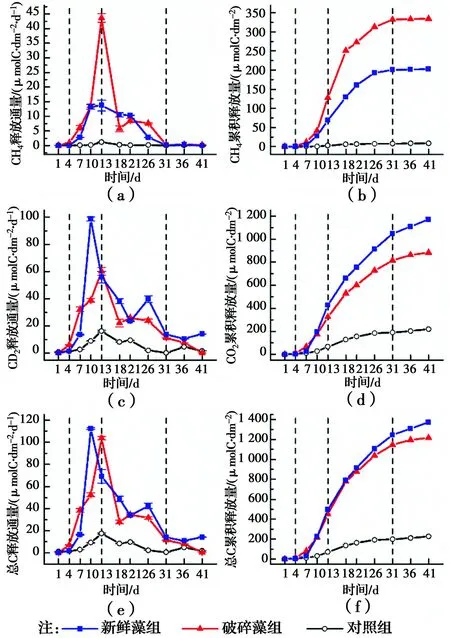
图6 铜绿微囊藻衰亡过程中CH4和CO2释放通量和累积释放量的变化Fig.6 Variations in release fluxes and cumulative release of CH4 and CO2 during the decay of Microcystis
作为生态系统呼吸作用的两种产物,CH4和CO2之间的关系表现为,一方面CO2是还原CO2产甲烷途径的底物,也是乙酸途径和严格甲基营养型途径产甲烷过程中的副产物[30];另一方面,甲烷氧化菌可以利用CH4作为碳源,将CH4氧化为CO2。DO通常被认为是调控CH4在生态系统总呼吸作用中占比的主要因素[31]。但在第13 d,即破碎藻组的CH4释放通量与新鲜藻组差异最大时,DO不存在显著性差异(p=0.148),原因可能是在缺氧或厌氧环境下,DO仪往往无法发挥其作用[32]。与之相反,ORP在此时的差异显著(p=0.005),说明在高密度铜绿微囊藻衰亡过程中,ORP在调节CH4和CO2的分配上可能起到重要作用。
自然衰亡和快速衰亡下,CH4和CO2气体占比不同还可能是前期塑造的细菌群落差异造成的。Shi等[6]研究了水华蓝藻长期作用下水相细菌群落的动力学,发现蓝藻衰亡的不同阶段细菌种群结构有明显差异,在功能层面表现为与甲烷代谢有关的菌种在衰亡中逐渐增加。Schwarz等[33]基于加藻后沉积物的16s rRNA的研究发现,加入藻源碳的处理组在培养6 d后细菌群落就出现了显著变化,其中,乙酸利用型产甲烷菌在加藻6 d后就有了增长,说明微生物群落对AOM可产生快速响应。由此推测,藻华堆积区藻的快速衰亡使大量AOM在试验第1 d就释放出来,导致加藻组在快速衰亡期水环境因子出现显著差异,前期的环境差异使破碎藻组可能积累了较多的产甲烷菌,从而在产气时期释放出更多的CH4。
2.4 影响碳素释放的主导环境因子
环境因子和气体释放通量的Pearson相关性如表1所示,除Chl-a与气体释放没有显著的相关性外,ORP、DO、pH、DOC均是显著影响CH4和CO2释放通量的关键环境因子。
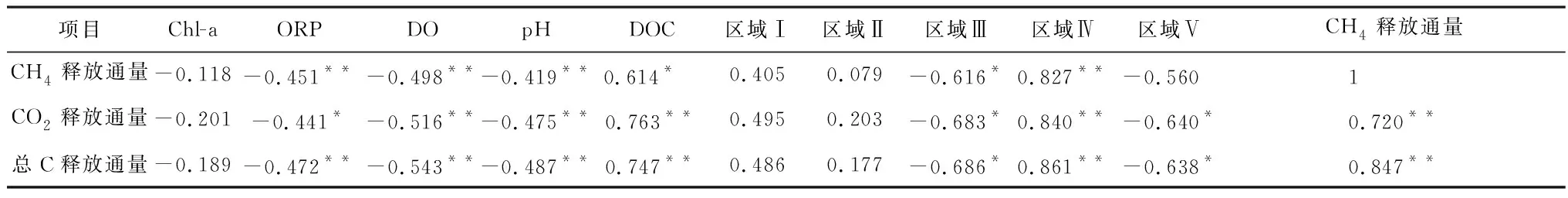
表1 环境因子和气体释放通量的相关性分析Table 1 Correlation analysis of environmental factors and gas release fluxes
注:*代表相关性在0.05水平上显著;**代表相关性在0.01水平上显著。
Chl-a与CH4和CO2的释放通量没有显著相关性,原因是气体释放的峰值强度往往出现在藻类衰亡释放出AOM之后[15],而此时Chl-a已经降到低值。
O2是还原产能最高的末端电子受体[31],因此,DO与CH4释放通量的相关性比ORP更大。产甲烷代谢中的辅酶因子和酶具有氧敏感性[36],O2的存在会对该类酶产生抑制作用,从而抑制CH4的产生。Borrel等[36]指出,O2浓度超过10 ppm甲烷产生会被完全抑制,而唐千等[2]研究表明,一般情况下O2浓度高于0.7 mg/L产甲烷菌活性就会被完全抑制,这与试验中新鲜藻组在第26 d时DO突然升高对应其CH4释放通量突然降低是一致的。此外,DO还会促进好氧甲烷氧化过程,使生成的CH4被氧化为H2O和CO2。在富营养化严重的河流中,高浓度藻类衰亡在短时间内就能将水体由好氧状态转化为缺氧状态[8, 10],从而促进CH4的产生。
pH对CO2释放通量的相关系数大于CH4。一方面,在产气上升期,水体处于厌氧状态,AOM被微生物厌氧分解为小分子有机酸[10],致使pH降低的同时为CH4和CO2的产生提供了底物。另一方面,当温度一定时,pH与水体二氧化碳分压(pCO2)存在指数函数关系[37],而水相pCO2又与水气界面CO2通量存在函数关系(F=k(Csur-Ceq))[38],因此,pH在一定程度上直接反映了CO2释放通量的大小。
DOC与CH4和CO2释放通量均有较显著的相关性(p<0.05)。Liang等[15]在丝状藻衰亡产气试验中也发现DOC与CH4释放通量之间有很强的相关性(r2=0.70,p<0.000 1)。Stanley等[31]在综合全球河流的数据后,也得到DOC与CH4浓度有显著线性相关性(r2=0.19,p<0.001)的结论。AOM为水生生态系统中微生物的呼吸和代谢提供了足够的底物,促进了CH4和CO2的释放。尽管加入的AOM可能对沉积物中有机质的矿化产生正向激发作用,但Grasset等[13]通过δ13C同位素分析表明,比起AOM作为底物对CH4的贡献,沉积物的正向激发可以忽略不计。此外,CH4和CO2的释放通量与区域I、II和IV的占比成正相关,表明在AOM组分中,芳香蛋白类物质和溶解性微生物代谢产物易被微生物分解,对气体的产生具有促进作用。其中,溶解性微生物代谢产物对两种气体释放的促进作用最大。相反,CO2和CH4的释放通量与区域III和V的占比成负相关,一方面因为类富里酸和类腐殖酸成分通常被认为是顽固性组分,较难被微生物利用[24];另一方面部分腐殖酸还会对CH4的产生有抑制作用[39]。
铜绿微囊藻衰亡中,DOC与CH4和CO2释放通量的相关性最大,结合藻类衰亡过程中环境因子的变化,可以推测出铜绿微囊藻衰亡促进碳素释放的机理:高密度铜绿微囊藻在衰亡中释放出大量新鲜有机物,这些有机物中的不稳定组分为微生物提供了底物,促进其分解代谢释放出CH4和CO2。尤其对于CH4的产生而言,释放出的有机物不仅提供了分解底物,还通过增加水中还原物质含量和促进需氧型微生物代谢的途径降低ORP和DO,为CH4的产生创造了合适的厌氧环境。
3 结论
1)高密度铜绿微囊藻自然衰亡和快速衰亡中Chl-a、水环境因子和产气的变化遵循着相似的时间模式。藻的衰亡可划分为:快速衰亡期(1~4 d)、缓慢衰亡期(4~13 d)、完全衰亡前期(13~31 d)、完全衰亡后期(31~41 d),产气阶段与之对应。
2)AOM的输入可增加试验体系的CH4产量。铜绿微囊藻自然衰亡和快速衰亡下CH4累积释放量分别为对照组的22.80、37.72倍,CO2的累积释放量分别为对照组的5.36、4.03倍。
3)铜绿微囊藻自然衰亡和快速衰亡过程中总C释放量无明显差异,但快速衰亡下AOM的迅速释放显著改变了藻源碳素的归趋。表现为快速衰亡下释放的气体组分中CH4的占比是自然衰亡下的1.86倍,且总C中27.49%是以CH4的形式释放的,而自然衰亡释放的总C中CH4仅占14.74%。
4)铜绿微囊藻的衰亡显著增加了水体中的藻源碳素,提升了微生物产CH4和CO2代谢的底物,并为产CH4微生物创造了合适的厌氧环境,使得DOC成为影响CH4和CO2释放的主导环境因子。在DOC组分中,芳香蛋白类物质和溶解性微生物代谢产物是CH4和CO2产生的主要底物来源。

