结构脂肪乳对肝癌术后肝功能、免疫功能及肝再生相关因子的影响
石文征 宋京海 牛小娟 李 喆 韦军民
肝细胞癌是常见的恶性肿瘤之一,最新研究数据表明,每年全球新发肝癌病例超过84.1万,死亡人数超过78.1万。由肝癌导致的死亡在男性和女性癌症患者中分别位居第3位和第7位[1]。我国肝癌患者多继发于乙型肝炎肝硬化,术前多合并不同程度的肝功能异常,术后肝脏再生受到多重困扰。且肝癌患者免疫功能下降,术后处于应激反应和免疫抑制状态,影响患者预后。肝切除术后患者存在各种代谢障碍,术后给予适当的营养支持有重要意义;脂肪乳是肠外营养 (parenteral nutrition, PN) 的重要组成部分,非蛋白质提供热量时,降低葡萄糖用量,增加脂肪乳供能,可以提高患者体内氨基酸的利用率,改善氮平衡[2]。结构脂肪乳由于其结构特征,水解匀速,不容易在血浆中蓄积,对减轻患者肝脏负担、促进肝细胞修复、控制体内炎症环境、增强机体免疫有一定优势[3]。肝脏是具有强大再生能力的器官,其再生机制十分复杂,已有的动物实验研究表明,白细胞介素-6 (interleukin-6, IL-6)、肝细胞生长因子(hepatocyte growth factor, HGF) 及其受体C-met在肝再生的过程中起重要作用[4,5]。探寻肝癌患者围手术期更加合理的营养支持方案,对于加速残肝再生,促进肝功能的恢复具有重要意义。
资料与方法
1.资料:选取北京医院2015年12月~2017年12月进行肝切除手术的肝癌患者60例。纳入标准:①年龄18~80岁,临床诊断原发性肝癌,肝功能Child-Pugh分级A~B级;②无明显的器官衰竭;③无甲状腺功能亢进、糖尿病等代谢性疾病,无严重感染、免疫缺陷病;④研究期间未接受放、化疗及免疫治疗。排除标准:严重的肝脏、肾脏功能异常、器官衰竭及其他代谢性疾病、有PN禁忌证、再次手术。所有患者采用数字表法随机进入STG组(n=30)和MCT/LCT组(n=30)。
2.方法:(1)营养支持方案:所有患者均在输注治疗前留置经外周静脉置入的中心静脉导管 (peripherally inserted central venous catheters, PICC),由此静脉通道进行肠外营养支持。肠外营养中的氮:0.15g/(kg·d)由复方氨基酸注射液提供 (8%乐凡命,华瑞制药有限公司);总非蛋白质热量(由葡萄糖与脂肪乳提供):83.68kJ/(kg·d),脂肪:1.0g/(kg·d),由STG(20%力文,华瑞制药有限公司)和MCT/LCT(20%力保肪宁,贝朗制药有限公司)提供,脂肪乳剂各5ml的折算热量,分别为41.0kJ (9.80kcal)和40.8kJ(9.75kcal)。糖脂的热量比例约为1∶1,非蛋白质热量与氮比值为131∶1。(2)输注方式:将葡萄糖、脂肪乳、氨基酸等营养素由中心超净配液室混合配制成“全合一”(total nutrient admixture, TNA) 营养液后通过PICC进行输注。输注时间每天12~16h,匀速,术后第1天起连续输注5天。(3)检测指标及方法:术前、术后第3、7天清晨分别抽取外周静脉血检测:①谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、总胆红素(TBIL)、谷氨酰转肽酶 (GGT)、血糖(GLU)(采用全自动生化仪测定,Beckman AU5400);②血浆IL-6、HGF及C-met(采用酶联免疫法测定,应用ELISA试剂盒,上海浩本生物科技有限公司);③T淋巴细胞亚群CD3+、CD4+、 CD8+百分比 (CD3+%、CD4+%、CD8+%)、CD4+/CD8+(采用FACSCalibur流式细胞仪,美国BD公司;使用美国BD公司淋巴细胞亚群检测试剂盒)。

结 果
1.一般资料:本研究符合纳入标准的患者60例,其中男性41例,女性19例,平均年龄60±10岁,分为观察组(STG组,n=30)和对照组(MCT/LCT组,n=30)。手术由同一团队完成,术式均选择开腹肝切除手术,术后病理证实均为肝细胞癌,其中右半肝部分切除术33例,左肝半部分切除26例,尾状叶切除1例。两组间年龄、体重指数(body mass index,BMI)、术中出血量比较,差异无统计学意义(P>0.05),详见表1。
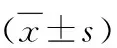
表1 两组一般资料比较
2.两组术前术后TBIL、AST、ALT、GGT、GLU水平的变化:术前两组间TBIL、AST、ALT、GGT、GLU水平比较,差异无统计学意义。两组术后第3天TBIL、AST、ALT、GGT、GLU水平均有不同程度升高,其中STG组AST、ALT水平在术后第7天明显低于MCT/LCT组 (P<0.05),TBIL水平在术后第3天明显低于MCT/LCT组 (P<0.05),详见表2。
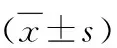
表2 两组术前术后TBIL、AST、ALT、GGT、GLU变化
3.两组术前术后外周血T淋巴细胞亚群CD3+、CD4+、CD8+淋巴细胞百分比、CD4+/CD8+比较:术前两组间CD3+%、CD4+%、CD8+%、CD4+/CD8+水平比较,差异无统计学意义。STG组CD3+%、CD4+%水平在术后第3天、第7天明显高于MCT/LCT组 (P<0.05),CD4+/CD8+水平在术后第7天明显高于MCT/LCT组 (P<0.05),详见表3。
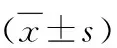
表3 两组术前术后T淋巴细胞亚群的变化
4.两组术前术后HGF、C-met、IL-6变化:术前两组间IL-6、HGF、C-met水平比较,差异无统计学意义。术后第3天、第7天两组IL-6、HGF、C-met水平均有不同程度升高。STG组HGF水平在术后第3天、第7天明显高于MCT/LCT组 (P<0.05),详见表4。
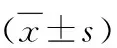
表4 两组术前术后HGF、C-met、IL-6变化
讨 论
我国是肝细胞癌 (hepatocellular carcinoma, HCC) 高发国家,近年来我国肝癌的发生率和病死率呈上升趋势[6]。全球肿瘤流行病统计数据(GLOBOCAN, 2012年)显示,我国肝癌发生率高达29/10万,病死率高达28.1/10万[7]。Hari等[8]对1745例早期肝癌的患者进行的队列研究表明,肝切除患者的中位生存期为40个月,进行射频消融术患者的中位生存期为27个月,非手术患者的中位生存期仅11个月,可见手术治疗能够显著改善早期肝癌患者生存。
肝癌患者常出现食欲减退和进食不足,营养不良发生率高达45%,使得肝切除术后并发症发生率增高,影响患者预后[9]。如何合理进行围术期的营养支持对肝癌手术患者尤为重要。合理的营养支持可以减轻患者术后的负氮平衡,维持重要脏器功能,减少手术并发症从而改善预后。传统的长链脂肪乳富含ω-6多不饱和脂肪酸,存在促炎症、抑制免疫的风险。而物理混合的中长链脂肪乳的不均衡代谢导致的甘油三酯等物质蓄积会加重肝脏和肾脏负担。结构脂肪乳水解匀速,对肝、肾功能影响小,有利于改善蛋白质代谢、促进肝功能的恢复、改善患者机体免疫系统功能[10~12]。本研究表明术后两组AST、ALT、GGT、GLU均有不同程度升高,其中STG组AST、ALT在术后第7天明显低于MCT/LCT组 (P<0.05),这与其他研究结果一致,提示STG对肝切除术后肝功能的恢复优于MCT/LCT[3]。STG组术后第3天及第7天TBIL低于MCT/LCT组,提示STG可能较好地在肝脏中耐受,这也与以往的研究结果相一致[2,13]。
T淋巴细胞是细胞免疫反应中的主要细胞,其亚群中CD3+T淋巴细胞代表细胞免疫的总体水平,CD3+T淋巴细胞减少提示机体的免疫功能减弱。机体的免疫平衡主要由T淋巴细胞亚群CD4+T淋巴细胞和CD8+T淋巴细胞相互影响来维持。CD4+/CD8+比值是反应机体细胞免疫功能的敏感指标,比值下降提示机体细胞免疫功能减弱[14]。本研究结果表明,STG组术后第3天、第7天CD3+%、CD4+%水平明显高于MCT/LCT组 (P<0.05),术后第7天CD4+/CD8+明显高于MCT/LCT组 (P<0.05),提示STG有助于肝切除术后患者机体免疫调控及免疫功能的恢复。这与其他关于结构脂肪乳对外科患者术后细胞免疫功能的影响的研究结果一致[11, 12]。曹亚琴等[15]对恶性梗阻性黄疸患者进行的STG与MCT/LCT对比研究亦得出了相似的结论。Tumanov等通过动物实验研究发现缺乏T细胞的小鼠行部分肝切除术后肝再生能力下降,认为T细胞产生的表面淋巴毒素β对肝再生是至关重要的。缺乏该种淋巴毒素β的小鼠在部分肝切除术后肝脏的损伤加重、剩余肝脏启动DNA合成的能力下降。而淋巴毒素β受体的激动剂能通过增加IL-6的产生、减轻肝损伤以及增加DNA的合成促进肝再生。
肝脏的再生机制复杂,已有的研究将肝再生分为3个阶段,即起始阶段、增殖阶段、终止阶段。其中IL-6是调节肝再生起始阶段的重要细胞因子,研究表明IL-6主要通过核因子-κB (nuclear factor-κB, NF-κB) 信号通路、非受体酪氨酸激酶/信号转导子和转录激活子 (janus kinase signal transducer and activator of transcription, JAK-STAT) 信号通路途径等激活相关增殖基因表达促进肝再生。HGF是一种间质细胞合成的促进肝再生的重要调控因子。在肝再生的增殖阶段 HGF与其受体C-met受体结合,通过促分裂素原活化蛋白激酶 (mitogen-activated protein kinase, MAPK) 等通路促进肝细胞的增殖[4, 5]。动物实验已经证实硬化肝再生与上述细胞因子和生长因子密切相关,但对于人类肝切除后的肝再生尚缺乏相关的临床研究,对于肝再生与脂肪乳关系的研究亦较少。
本研究结果表明两组术后IL-6、HGF、C-met指标均有不同程度升高。STG组术后第3天、第7天HGF明显高于MCT/LCT组 (P<0.05)。提示STG输注或许有助于提高肝切除术后HGF水平,从而可能有助于促进残肝再生,加速肝功能的恢复。两组间C-met以及IL-6的水平比较,差异无统计学意义。HGF对肝再生的调控机制复杂,有研究表明,肝切除术后余肝的HGF活性明显降低,这与其激活物 (HGF-activator, HGFA) 的表达下降以及该激活物的脾源性抑制物 (HGFA-inhibitor-1,2, HAI-1,2) 的表达上升有关[16]。因此,本研究中STG对肝再生的促进作用尚需进一步研究证实。
本研究样本量相对较少,对肝再生的监测缺乏更直接的证据,可能影响结果的准确性。有待于扩大样本量并监测术后肝脏体积等变化,进一步研究探索结构脂肪乳对肝再生的影响。

