microRNA-132通过调节VEGF通路抑制缺血性脑血管病患者血管生成的机制研究
李 巍 高 洋 赵永刚 刘 欣 孙显辉 吕 彦 张景华
缺血性脑血管病具有高发生率、高致残率及高病死率的特点,是指中枢神经系统局灶性缺血所致的神经功能障碍[1]。我国每年约有200万缺血性脑血管病患者发病,其中60%左右留有不同程度的残疾[2]。该疾病的病理特征主要表现为颈动脉壁的逐渐变化和动脉的慢性退化,使得动脉变细,导致整个动脉失去弹性。该疾病的形成是一个复杂的过程,其病因包括饮酒、血液黏滞度升高、高血压、年龄、吸烟、血糖、高血脂等,相关的学说主要有氧化应激反应学说、感染学说、脂质浸润学说、炎症学说等[3,4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知的最重要的血管生成刺激因子,是在牛垂体形状细胞体外细胞培养分离并纯化的糖蛋白,能够增强内皮细胞具有的分裂增生能力,还可以提升毛细血管通透性。其也可参与正常组织形态的维持和保证细胞排列结构的稳定,可保证细胞层的通透屏障功能[5]。中枢神经细胞、神经细胞可在一些内源性因子的刺激下合成、分泌VEGF,特别是中枢神经系统受到侵犯后,机体的炎性反应与免疫反应也可诱导VEGF水平升高[6]。微小RNA(microRNA,miRNA)作为一类新型基因调控分子,与缺血性脑血管病的发生、发展密切相关。miRNA可影响血管内皮细胞的功能,参与血管平滑肌细胞的迁移和增殖。miRNA-132是激活突触活性和可塑性的分子,在缺血性脑血管病患者中呈现低表达状况[7]。miRNA-132表达下降可使得内皮细胞增殖及迁移能力均受到抑制,进而导致血管出血、破裂,诱发心脑血管疾病的发生[8]。本研究具体探讨了microRNA-132通过调节VEGF通路抑制缺血性脑血管病患者血管生成的机制,从而揭示miRNA-132在缺血性脑血管病中的分子作用机制,现报道如下。
材料与方法
1.材料与试剂:人脐静脉内皮细胞来源于中国医学科学院的细胞储藏中心,培养基为含10%胎牛血清的RPMI1640培养液,培养条件为37℃、5% CO2;miRNA-132模拟物(5′-UAACAGUCUACAGCCAUGGUCGACCAUGGCUGUAGACUGUUAUU-3′)和miRNA-132对照模拟物(5′-CGACCAUGGCUGUAGACUGUUA-3′)购自美国Ambion 公司;胎牛血清(FBS)、胰蛋白酶、转染试剂脂质体Lipofectamine2000试剂购自美国Invitrogen公司;兔抗人β-actin单克隆抗体购自英国Abcam公司;兔抗人HIF-1α、VEGF单克隆抗体购自美国Santa Cruz公司;总RNA抽提试剂盒、Total RNA Kit 购自美国Omega公司。
2.细胞分组与转染:人脐静脉内皮细胞维持对数生长,转染前1天将处于对数生长期的细胞分别接种至6孔板中,将其分为空白组、阴性组与实验组,每组设3个重复。待细胞汇合度达60%左右时,空白组不进行转染。阴性组与实验组经Lipofectamine2000转染对照模拟物及miRNA-132模拟物,转染后6h换液。
3.MTT法检测细胞增殖:细胞转染后24h与36h,接种到96孔板中,根据合适的铺板细胞数,每孔约100μl细胞悬液,培养2h,加入10μl MTT试剂,再培养4h后测定每孔的450nm吸光度,参比波长600~650nm,计算细胞增殖指数。
4.流式细胞术检测细胞凋亡:细胞转染后24h与36h,接种到6孔板,细胞贴壁后用PBS洗涤2 次,加入100μl Binding buffer 和FITC标记的Annexin-V(20μg/ml)10μl,室温避光30min,再加入PI(50μg/ml)5μl,避光反应5min后,加入400μl Binding buffer,立即用FACScan进行流式细胞术定量检测,记录细胞凋亡指数。
5.real-time PCR检测RNA表达:本研究的miRNA-132及U6特异性扩增引物来源于ABI相关试剂盒,根据Genebank查到人HIF-1α、VEGF的mRNA序列。细胞转染后24h与36h收集细胞,提取总RNA,采用两步法real-time PCR:预变性95℃,15s;变性95℃、5s,退火延伸60℃、30s,共进行45个循环,数值分析采用2-△△CT分析法。
6.Western blot法检测蛋白表达:细胞转染后24h与36h收集细胞,裂解并提取细胞总蛋白,以BCA法检测蛋白浓度,每孔上样20μg蛋白,进行SDS-PAGE胶分离,转膜后封闭过夜,用TBST溶液先快速洗涤3次,孵育一抗过夜;TBST溶液洗涤3次,孵育二抗室温1h;TBST溶液洗涤3次,将ECL 试剂盒中A 液和B 液按1∶1 体积比例混合于EP管中,均匀覆盖于膜的表面,避光室温放置2min,然后进行曝光分析。

结 果
1.RNA表达比较:转染后24h与36h,实验组的miRNA-132表达水平显著高于阴性组与空白组(P<0.05),HIF-1α、VEGF RNA表达水平显著低于阴性组与空白组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),详见表1。
2.细胞增殖指数比较:转染后24h与36h,实验组的细胞增殖指数都显著低于阴性组与空白组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),详见表2。
3.细胞凋亡指数比较:转染后24h与36h,实验组的细胞凋亡指数都显著高于阴性组与空白组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),详见表3。
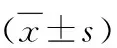
表1 3组转染后不同时间点的RNA表达比较
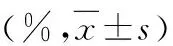
表2 3组转染后不同时间点的细胞增殖指数比较
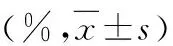
表3 3组转染后不同时间点的细胞凋亡指数比较
4.HIF-1α、VEGF蛋白表达比较:转染后24h与36h,实验组的HIF-1α、VEGF蛋白相对表达量显著低于阴性组与对照组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),详见图1。

图1 3组细胞 HIF-1α、VEGF蛋白表达比较A. 24h; B. 36h
讨 论
缺血性脑血管病在临床上比较常见,该疾病的发生机制尚不十分明确,涉及到血流动力学改变、微血栓等学说[9]。现代研究显示缺血性脑血管病的病因是血液系统与脑组织之间的直接屏障——脑血管内皮细胞被严重损伤,特别是损伤引起白细胞和内皮细胞持续性释放可溶性黏附分子以及各种细胞因子,促使单核细胞黏附于血管内皮细胞,转变为巨噬细胞,导致疾病的发生与恶化[10]。
VEGF广泛存在于机体内,主要在血管内皮细胞中表达[11]。VEGF能促进血管内皮细胞增殖,参与血管的生成,增加血管的通透性,在缺血性脑损伤时具有一定的脑保护作用[12]。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是哺乳动物和人体内的核转录因子,HIF-1α在肿瘤细胞中可获得大量表达,可以激活PI3K/AKT/FRAP途径,从而调节细胞增殖与凋亡[13]。miRNA-132在慢性角膜炎组织中高表达,通过作用于VEGF,参与病毒感染恢复期血管修复过程,anti-miRNA-132可以减少角膜血管新生,降低角膜炎损伤[14]。本研究转染后24h与36h,实验组的miRNA-132表达水平显著高于阴性组与空白组(P<0.05),HIF-1α、VEGF RNA与蛋白表达水平显著低于阴性组与空白组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),表明过表达miRNA-132能够抑制HIF-1α、VEGF的表达。当前也有研究显示miR-132通过调控SIRT1信号突进,抑制有利于细胞修复的脂类物质的合成,促进血管内皮细胞的炎症过程,抵制血管内皮细胞增殖、迁移的修复过程,从而使内皮细胞活性减低[15]。
现代研究表明,miRNA与疾病发生和发展关系密切,特异的miRNA表达谱可作为疾病预防和诊断的标志物[16~18]。miRNA-126通过加强内皮细胞的修复,发挥了抗动脉粥样硬化的作用,也可能通过直接抑制VEGF通路的负性调节因子来调节内皮细胞对VEGF的应答,从而促进冠状动脉粥样硬化[19,20]。HIF-1由α亚单位和β亚单位组成,α亚单位受氧调控,具有特异性,对HIF-1活性有着决定性作用。本研究显示转染后24h与36h,实验组的细胞凋亡指数都显著高于阴性组与空白组(P<0.05),细胞增殖指数都显著高于阴性组与空白组(P<0.05),阴性组与空白组比较,差异无统计学意义(P>0.05),表明过表达miR-132能抑制内皮细胞的增殖与促进其凋亡。在未来的深入研究中,还需通过验证miRNA-132下游靶基因,继续阐明miRNA-132参与人脐静脉内皮细胞增殖与凋亡的分子机制,为开发新的缺血性脑血管病治疗手段和方法提供重要的理论基础和实验依据。
综上所述,miRNA-132可通过抑制HIF-1α、VEGF的表达,抑制人脐静脉内皮细胞增殖,促进其凋亡,从而发挥抑制缺血性脑血管病患者血管生成的作用。

