北仑河口红树林地埋管道生态养殖系统多环芳烃的分布、影响因素及风险评价
李 斌,庞碧剑,谭趣孜,巫冷蝉
(1.广西科学院广西红树林研究中心,北海 536000;2.广西红树林保护与利用重点实验室,北海 536000;3.广西壮族自治区海洋环境监测中心站,北海 536000)
多环芳烃(PAHs)是一类具有致癌、致畸、致突变的持久性有机污染物,由于PAHs亲油疏水,易于富集在海洋生物体内,并通过食物链的累积和传递作用进入人体,对人类健康和生态环境的潜在危害巨大,目前已被多国列为优先控制的污染物之一[1-2]。红树林是生长在热带、亚热带海岸潮间带的木本植物群落[3],因其根系发达、林内土壤富含有机质以及高还原性,成为了吸收和累积PAHs的场所[4-6]。本研究中的红树林地埋管道生态养殖系统位于广西北仑河口红树林自然保护区,该系统处于开放环境,周边生产生活产生的PAHs可通过潮汐作用等方式输入其内,影响养殖环境的安全。为此,本文拟通过研究养殖环境及中华乌塘鳢(Bostrychus sinensis)PAHs的时空分布、组成、风险及来源,分析养殖环境PAHs分布的影响因素以及中华乌塘鳢的富集响应,并评估养殖环境的理论阈值及剩余环境容量,以期为完善该养殖系统的日常管理技术和养殖灾害预警提供科学依据。
1 材料与方法
1.1 调查区域概况及样品采集
北仑河口红树林自然保护区位于广西防城港珍珠湾,湾内潮汐属不规则全日潮,保护区内分布着木榄(Bruguiera gymnorrhiza)、老鼠簕(Acanthus ilicifolius)、桐 花 树 (Aegiceras corniculatum)等10科13种红树植物[7]。红树林地埋管道生态养殖系统位于自然保护区的石角(21°36′57″N、108°13′55″E)(图 1-a)。该系统主要养殖中华乌塘鳢,每个管理窗口大约200尾,主要通过潮汐作用完成物质交换,涨潮时,潮水通过花管和管理窗口进入系统,蓄水池蓄满水;退潮时,系统水位下降,蓄水池的水流入管道,部分残饵、粪便等随之排出,实现养殖系统水体的持续更新(图1-b)[8]。红树林地埋管道生态养殖系统由7组21个管理窗口组成,本研究由近岸及远岸依次选择G1、G7、G3、G5 4个管理窗口作为调查采样点。该系统每15 d清理1次以保证养殖环境的健康,调查采样工作在清理的前1 d进行。分别于中华乌塘鳢幼苗期(2013年5月,春季)、中鱼期(2013年7月,夏季)和成鱼期(2013年10月,秋季)开展调查采样工作。低潮时,采集蓄水池(R)及各管理窗口的中层水;涨潮时,在管理窗口附近采集自然海水(N)。在采水样的同时,采集各管理窗口的表层沉积物和中华乌塘鳢鱼肉样品。由于幼苗期的中华乌塘鳢个体较小,采集其鱼肉样品需较多个体,会直接影响养殖产量,因此幼苗期不采集该类样品。为了评价养殖环境PAHs对中华乌塘鳢生长的影响,取投养前的鱼苗(体质量约20 g,体长约5 cm)鱼肉样品作为对照样品。中鱼期和成鱼期,每个管理窗口随机选取数条中华乌塘鳢作为实验样品,其中中鱼期选取的中华乌塘鳢体长和体质量分别为10~12 cm和60~70 g,成鱼期的为20~22 cm和110~130 g。在养殖过程中,投喂的人工饵料为粉粹的小杂鱼,为了判别人工饵料是否为PAHs进入中华乌塘鳢体内的主要载体,取部分人工饵料作为监测样品。
1.2 试剂与仪器
主要仪器:气-质联用仪(TRACE GC-ISQ);Thermo scientific TR-5MS色谱柱(30 m×0.25 mm×0.25μm);真空冷冻干燥仪(ALPHA1-4LD plus);旋转蒸发仪(R-3),氮吹仪(DC-24);球磨仪(XQM-2);箱式电阻炉(SRJX-4-13A);索氏抽提器。
18种PAHs(2~6环)混合标准溶液,质量浓度为1 000 mg·L-1(美国 o2si Smart Solutions);5种替代物混合标准溶液,质量浓度为2 000 mg·L-1(美国 o2si Smart Solutions);内标物标准溶液:四氯间二甲苯,质量浓度200 mg·L-1(美国 o2si Smart Solutions)。
1.3 样品处理与分析
水中悬浮物含量的测定依据《海洋监测规范》(GB17378.4-2007)[9]中的重量法。PAHs水样采集后用0.45μm玻璃纤维滤膜过滤,量取1L滤后水样加入PAHs替代物标准溶液和100 mL异丙醇,用C18固相萃取柱萃取(小柱萃取前分别用10 mL二氯甲烷、甲醇和纯水活化),控制水流速度为6~10 mL·min-1,萃取完的C18小柱用N2吹10 min,再用丙酮和二氯甲烷解析,正己烷置换后浓缩至0.5 mL,待测[10]。沉积物有机碳含量检测依据《海洋监测规范》(GB17378.5-2007)[11]中的重铬酸盐氧化—还原容量法。沉积物PAHs的检测按照《海洋监测技术规程 第2部分:沉积物》(HY/T 147.2-2013)[12]进行,饵料和鱼肉PAHs的检测按照《海洋监测技术规程 第3部分:生物体》(HY/T 147.3-2013)[13]进行。
上机条件:无分流进样,进样量为1μL;进样口温度为300℃,柱温箱初始温度为70℃,保持1 min,以6℃·min-1升至300℃,保持6 min;载气为高纯氦气,流速为1.2 mL·min-1。
1.4 质量控制
为了确保检测结果的质量,样品加入替代物混合标准溶液,用替代物的回收率表征PAHs的回收率;同时,每批样品做平行样检测。经分析,水样的PAHs回收率为75.3%~116.7%,沉积物的为83.6%~108.1%,饵料和鱼肉生物样品的为78.2%~113.4%,水体平行样的标准偏差在7.81%~14.60%,沉积物平行样的标准偏差在5.62%~9.78%,生物样品的平行样标准偏差为11.3%~17.8%。
1.5 数据处理
1.5.1 差异显著性分析
红树林地埋管道生态养殖系统水体、沉积物和生物样PAHs含量的差异显著性分析采用单因素方差分析,统计过程使用SPSS 17.0完成。
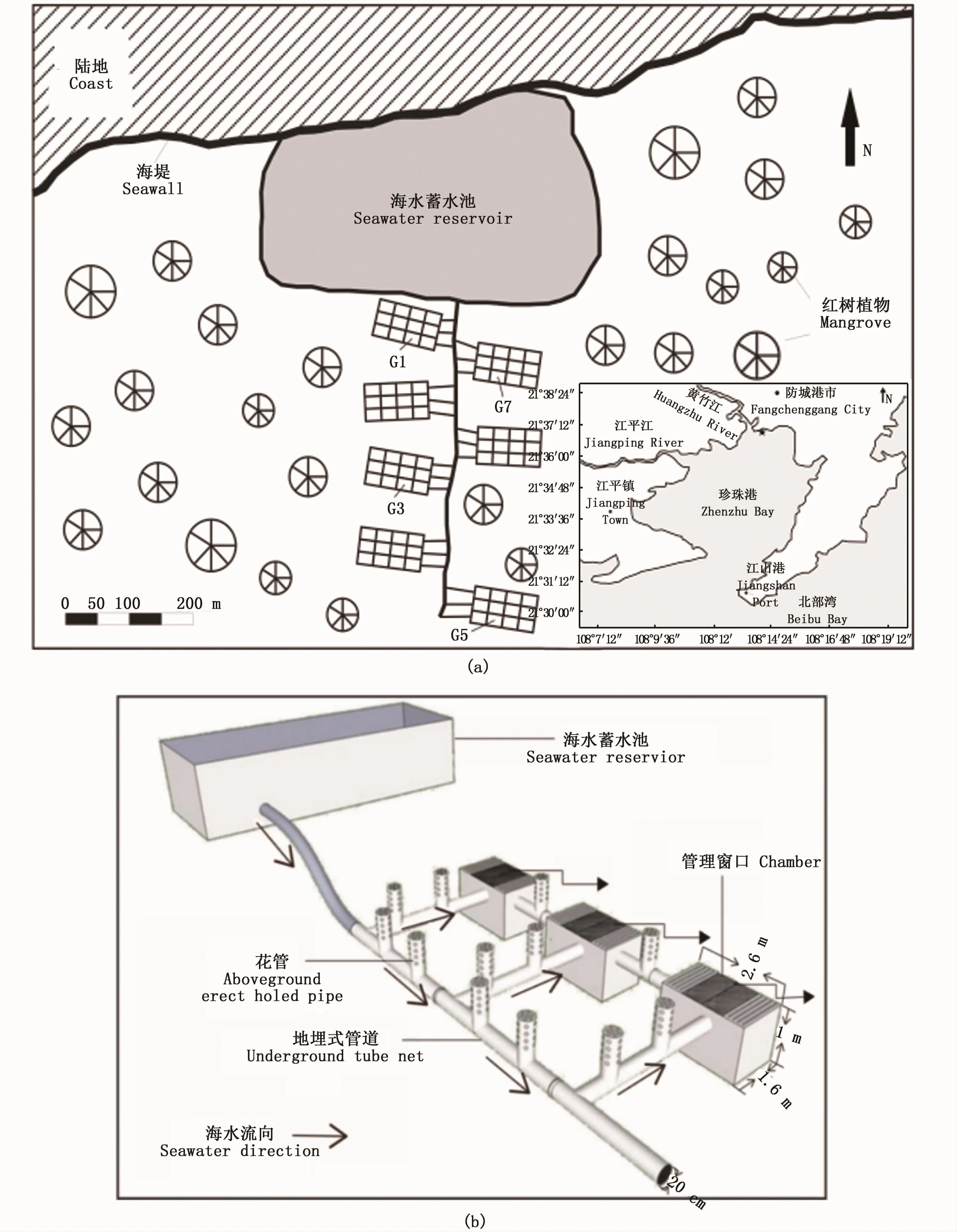
图1 红树林地埋管道生态养殖系统Fig.1 Location of mangrove in situ underground pipe eco-faming system注:a.地理位置;b.原理图Note:a.geographic location;b.schematic structure of the underground tube eco-farming system
1.5.2 养殖环境生态风险评价方法
根据 LONG等[14]的研究结果使用 12种PAHs单体的效应区间低值(effect range low,ERL)和效应区间中值(effect range median,ERM)评价沉积物PAHs残留对生物的潜在毒性效应,沉积物中PAHs含量小于ERL时对生物无明显毒副作用,大于ERL小于ERM时对生物有一定毒副作用,大于ERM时对生物有明显毒副作用。采用商值法[15-16]对养殖水体PAHs的生态风险进行评价,当危害商值HQ≥1表示存在潜在风险,HQ<1则表示生态风险相对较小。由于Acy、BbF、BkF、BeP、BjF、IcdP和 BghiP未检索到相应的生态基准值,因此本研究仅评价11种PAHs的危害商值(HQ),计算公式如下:

式(1)中:暴露值是指管理窗口养殖水体PAHs的平均浓度;TRV指毒性参考值(生态基准值)。
1.5.3 中华乌塘鳢及人工饵料健康风险评价方法
根据美国EPA推荐的健康风险评价方法[17-18],对中华乌塘鳢和人工饵料的健康风险进行评价。使用致癌风险指数CRI(cancer risk index)表示,计算公式见下式[19]:

式(2)中:Ci为 PAHs的暴露浓度(ng·g-1),由于各PAHs单体毒性差异大,评价参数不具体,因此通常用PAHs单体的BaP毒性当量因子将暴露浓度换算成等效BaPeq浓度,毒性当量因子如表1[20];CR为人均食用量,2012年我国城镇居民家庭人均水产品食用量为 15.19 kg·年-1[21];ED为暴露时长,致癌物通常取70年;CSF(cancer slope factor)为致癌强度系数,PAHs采用CSFBaP=7.3(kg·d)·mg-1[22];BW为人均体质量,取60 kg;AT为平均暴露时间(d),根据USEPA的规定,CRI<1×10-6表示没有致癌风险,1×10-6≤CRI≤1×10-4表示致癌风险可接受,CRI>1×10-4表示具有较高的致癌风险[17]。
1.5.4 水体及沉积物PAHs的来源分析方法
PAHs中同分异构体的热稳定存在差异,来源不同的PAHs会呈现独特的指纹特征[23],因此使用PAHs异构体的特征化合物比值可示踪其来源。本文采用 Phe/(Phe+Ant)、Fla/(Fla+Pyr)以及IcdP/(IcdP+BghiP)3种异构体比值解析红树林地埋管道生态养殖水体及沉积物PAHs的来源。有研究表明[23],Phe/(Phe+Ant)小于 0.1表示PAHs源于石油排放,大于0.1则是燃烧来源;Fla/(Fla+Pyr)小于0.4意味 PAHs源于石油排放,大于0.4且小于0.5则是石油燃烧排放,大于0.5则是木、煤燃烧来源;IcdP/(IcdP+BghiP)小于0.2表示主要是石油排放,大于0.2小于0.5则是石油燃烧来源,大于0.5则是木、煤燃烧来源。
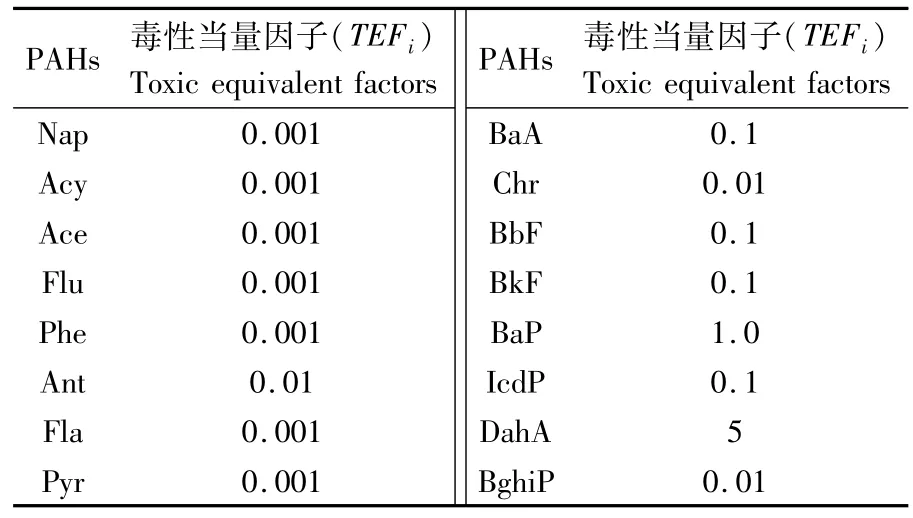
表1 PAHs的BAP毒性当量因子Tab.1 PAHs and their toxic equivalent factors
2 结果与分析
2.1 养殖水体PAHs的分布、组成及生态风险
调查期间,各管理窗口的水体PAHs含量在53.67~232.57 ng·L-1间,其中G5管理窗口的PAHs平均含量最高为122.58 ng·L-1,G7次之为113.56 ng·L-1,G1为105.54 ng·L-1,G3最小仅92.72 ng·L-1,但各管理窗口的PAHs含量差异不显著(P>0.05)。各管理窗口的PAHs含量均低于自然海水和蓄水池,但差异不显著(P>0.05)。在时间变化上,各管理窗口水体的PAHs含量变化不一,G1窗口的PAHs含量随养殖的推进逐渐增加,G5窗口则反之;G3和G7窗口的变化趋势一致,幼苗期的最低,中鱼期升至最高,成鱼期又有所回落。总体而言,管理窗口水体PAHs平均含量随着养殖的推进,在中鱼期升至最高,在成鱼期降至最低。与管理窗口的变化规律一致,自然海水的PAHs含量在中鱼期最高,幼苗期次之,成鱼期最低;蓄水池的PAHs含量则随养殖的推进逐渐降低。
幼苗期,G1、G3、G7管理窗口水体 PAHs以2、3环为主,占69.7% ~84.8%,G5以3、5环为主,共占72.8%,6环 PAHs在G3、G7管理窗口未检出;蓄水池和自然海水的PAHs组成类似,均以3、5环为主,分别占65.4%和65.1%。中鱼期,G1、G3、G7管理窗口水体PAHs则以3、4环为主,占78.4% ~88.3%,G5以3、5环为主,共占71.6%,6环PAHs在G3管理窗口未检出;蓄水池和自然海水均以3、4环为主,分别占80.0%和81.2%。成鱼期,G1、G3管理窗口以3、4环为主,分别占74.3%和73.3%,G5、G7管理窗口以2、4环为主,分别占79.7%和77.4%;蓄水池和自然海水均以2、4环为主,分别占71.2%和73.8%。总体而言,调查期间养殖系统内外水体的PAHs以3环为主,占40%以上,但G5与其他管理窗口不同,其5、6环含量较高,与自然海水、蓄水池的组成类似。
各调查时期,水中Nap的HQ值基本一致;Flu、Phe和Ant的HQ值在幼苗期较低,中鱼期升至最高,成鱼期又有所回落;Chr的HQ值在幼苗期较高,中鱼期降至最低,成鱼期稍有回升;Ace、BaP和DahA的HQ值随着时间前移不断减少,Ace、BaP和DahA则反之。总体而言,管理窗口养殖水体12种PAHs单体的HQ值均低于1,生态风险较小。
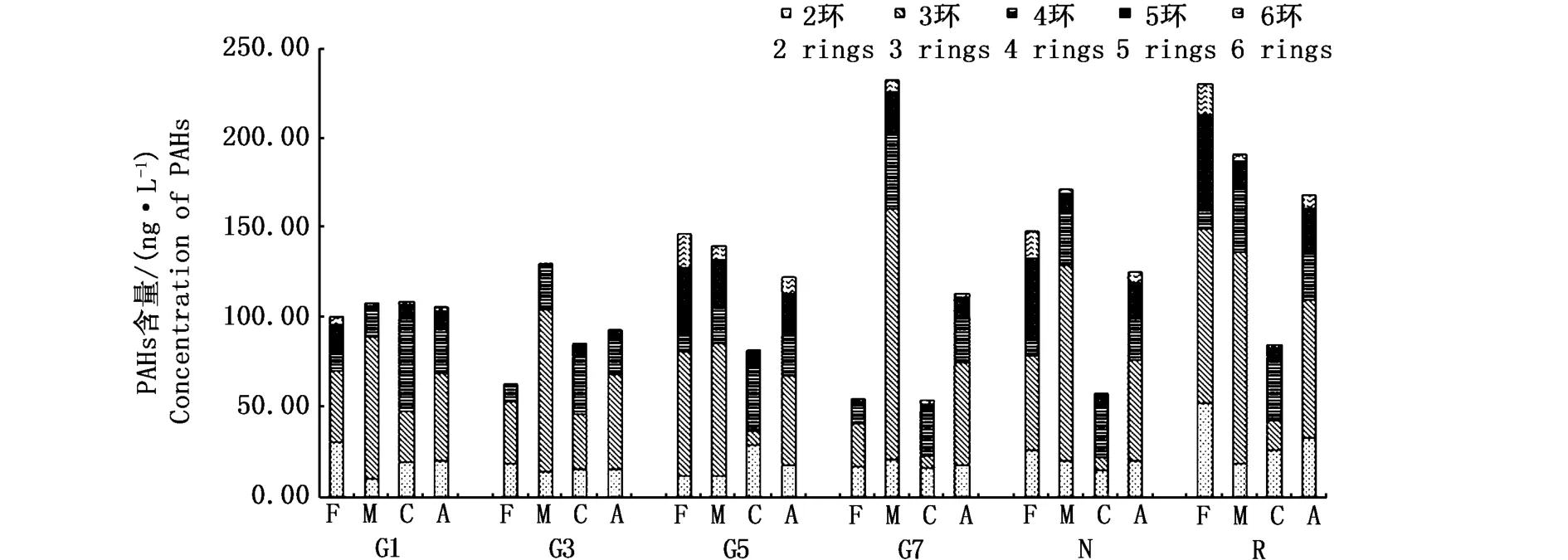
图2 红树林地埋管道生态养殖系统水体PAHs的含量及组成Fig.2 Concentration and composition of PAHs in water of mangrove underground in situ pipe eco-farming system
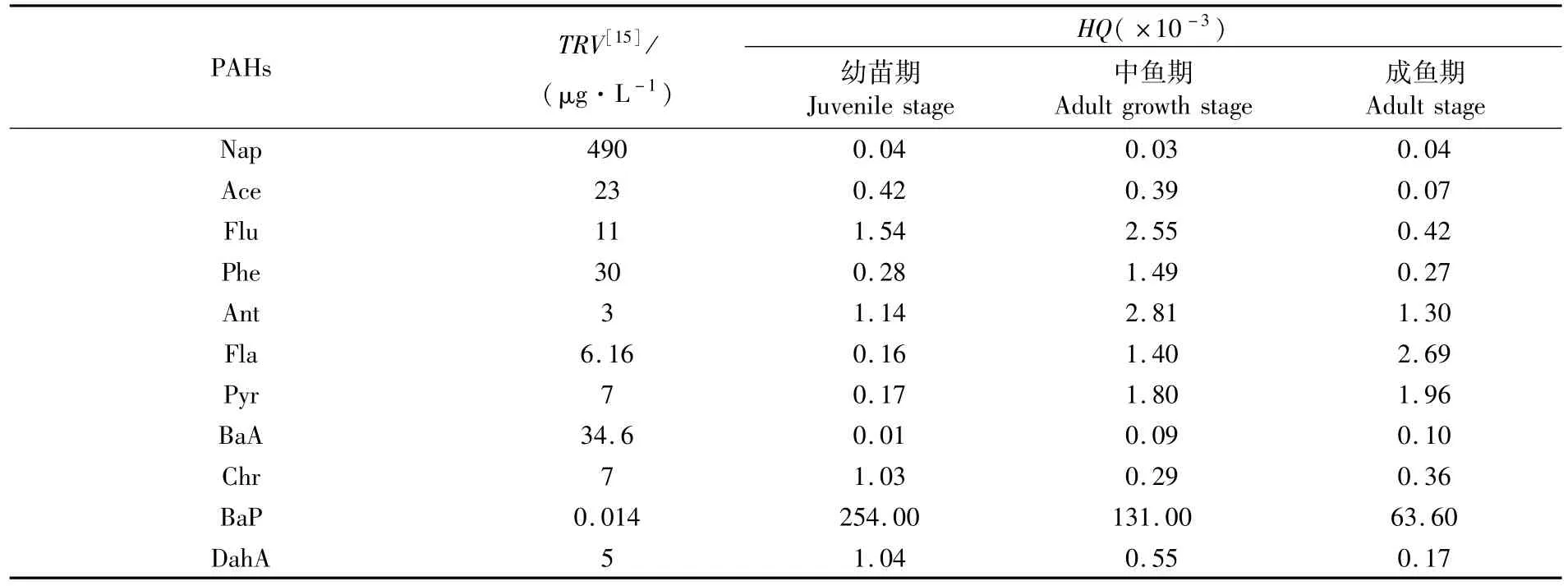
表2 红树林地埋管道生态养殖系统管理窗口水体PAHs的生态风险值Tab.2 TRV and HQ of PAHs in mangrove underground in situ pipe eco-farming system
2.2 沉积物PAHs的分布、组成及生态风险
调查期间,红树林地埋管道生态养殖系统管道窗口内沉积物 PAHs变化范围为171.33~406.98 ng·g-1,其中 G1管理窗口沉积物的PAHs平均含量最高达309.26 ng·g-1,其次是G3为292.21 ng·g-1,G7为262.17 ng·g-1,G5最小为247.38 ng·g-1,但各管理窗口沉积物PAHs含量的差异不显著(P>0.05)。在时间变化上,G1和G3管理窗口的沉积物PAHs含量随着养殖的推进不断降低;G5则是中鱼期的含量最高,幼苗期其次,成鱼期最低;G7的变化趋势与G5相反,幼苗期的含量最高,中鱼期最低,成鱼期含量有所回升。总体而言,管理窗口沉积物PAHs平均含量随养殖进程的不断推进逐渐减少。
各管理窗口沉积物2~6环的PAHs均有检出,但不同时期各管理窗口的PAHs组成各异。幼苗期,G1、G3、G5和 G7管理窗口的沉积物PAHs均以3~5环为主,分别占75.2%、73.0%、79.8%和77.8%。中鱼期,G1、G3管理窗口的沉积物PAHs以2~5环为主,分别占89.6%和89.8%;G5管理窗口的沉积物PAHs以3~5环为主,占73.4%;G7管理窗口的沉积物PAHs以2、4、5环为主,占73.7%。成鱼期,G1、G3、G5管理窗口的沉积物PAHs以3~5环为主,分别占79.1%、74.6%和76.3%,G7管理窗口的沉积物PAHs则以2、4、5环为主,占71.3%。总体而言,各管理窗口沉积物以3~5环的PAHs为主。
管理窗口沉积物中Nap的含量在幼苗期较低,中鱼期升至最高,成鱼期降至最低;Acy、Ace、Flu、Phe、Ant、Fla、Pyr、BaA、Chr和 BaP随着养殖进程的推进不断减少;DahA则是幼苗期含量最高,中鱼期和成鱼期接近。总体而言,沉积物PAHs的含量均低于ERL,对生物无明显毒副作用(表3)。
2.3 养殖环境PAHs的来源解析
由图4可知,调查期间养殖系统内外水体的Phe/(Phe+Ant)均大于 0.1,反映 PAHs主要源于燃烧源。幼苗期,G1、G3和G7管理窗口水体的 Fla/(Fla+Pyr)在 0.41~0.45间,表明 PAHs主要来源于石油燃烧排放,G5管理窗口的稍高于0.50,可认为是石油和木、煤燃烧的混合来源,蓄水池和自然海水的PAHs则分别源于石油排放和石油燃烧排放;蓄水池、自然海水和G1、G5管理窗口的 IcdP/(IcdP+BghiP)在0.2~0.5间,为石油燃烧来源,而G3、G7管理窗口的IcdP、BghiP均未检出。中鱼期,G1、G5和G7管理窗口水体的Fla/(Fla+Pyr)在 0.41~0.42间,表明 PAHs主要来源于石油燃烧排放,G3管理窗口、自然海水和蓄水池均小于0.40,为石油排放来源;养殖系统内外水体的 IcdP/(IcdP+BghiP)在 0.51~0.57间,均大于0.5,表明PAHs主要源于木、煤燃烧排放。成鱼期,养殖系统内外水体的Fla/(Fla+Pyr)均大于0.5,反映PAHs主要源于燃烧排放;G1管理窗口的IcdP/(IcdP+BghiP)在0.4~0.5间,主要源于石油燃烧排放,其余管理窗口、蓄水池和自然海水的IcdP/(IcdP+BghiP)均大于0.5,表明这些监测站位的水体PAHs主要源于木、煤燃烧源。总体而言,幼苗期管理窗口水体的PAHs主要源于石油燃烧排放,中鱼期主要是石油、石油燃烧和木、煤燃烧的混合源,成鱼期主要源于木、煤燃烧排放。

表3 红树林地埋管道生态养殖系统管理窗口沉积物PAHs的生态风险值Tab.3 Ecological risk assessment of PAHs in sediments from mangrove underground in situ pipe eco-farming system
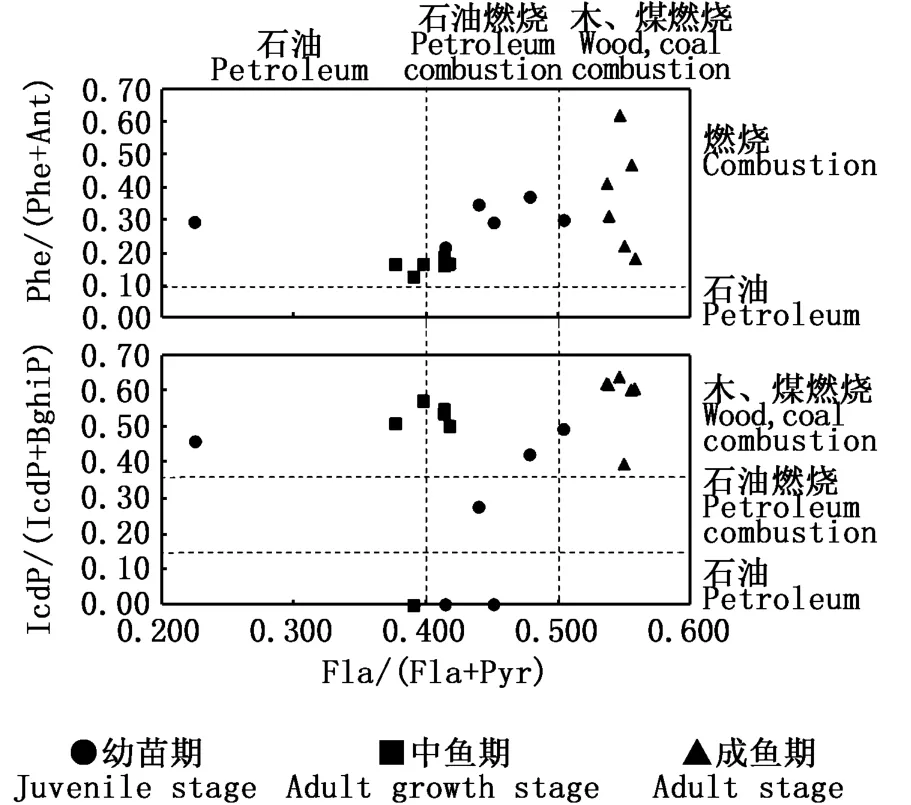
图4 红树林地埋管道生态养殖系统水体PAHs的来源分析Fig.4 Diagnostic ratios of PAHs in water of mangrove underground in situ pipe eco-farming system
从图5可以看出,整个调查期间各管理窗口沉积物的 Phe/(Phe+Ant)均大于 0.1,反映PAHs主要源于燃烧排放,进一步分析发现各管理窗口的 Fla/(Fla+Pyr)在0.56~0.60间,稍高于0.5,表明PAHs主要来源于木、煤燃烧排放。但 IcdP/(IcdP+BghiP)高于 0.5即 PAHs源于木、煤燃烧排放的管理窗口仅是成鱼期的G1、G3和G5管理窗口,其余调查时期各管理窗口的IcdP/(IcdP+BghiP)在0.46~0.49间,主要源于石油燃烧排放。总体而言,调查期间各管理窗口沉积物的 Fla/(Fla+Pyr)和 IcdP/(IcdP+BghiP)在0.5左右,PAHs主要源于石油燃烧和木、煤燃烧排放。
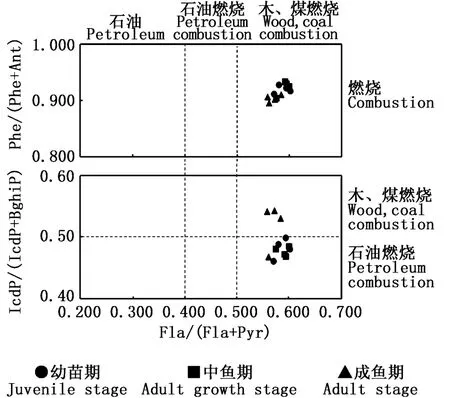
图5 红树林地埋管道生态养殖系统沉积物PAHs的来源分析Fig.5 Diagnostic ratios of PAHs in surface sediments of mangrove underground in situ pipe eco-farming system
2.4 中华乌塘鳢和人工饵料PAHs的分布、组成及健康风险
中鱼期和成鱼期,中华乌塘鳢鱼肉的PAHs含量变化范围为1.61~2.88 ng·g-1,其中G1管理窗口的平均含量最高为2.57 ng·g-1,其次是G7为2.39 ng·g-1,G3的为2.16 ng·g-1,G5的最小为1.70 ng·g-1,各管理窗口鱼肉的PAHs含量差异不显著(P>0.05)。在时间变化上,中鱼期中华乌塘鳢鱼肉PAHs的含量最高,成鱼期有所回落,但均高于投苗前的含量。人工饵料的PAHs含量较低,仅 0.13 ng·g-1。
中鱼期和成鱼期,各管理窗口中华乌塘鳢鱼肉中2~6环的PAHs均有检出,但主要富集4环的PAHs,其次是3环和2环,2~4环PAHs共占87.8%~96.4%。放养前中华乌塘鳢鱼肉的PAHs也是以4环为主,3环次之,但2环和5环的占比接近。人工饵料PAHs则3环为主,4环次之。
由表4可知,养殖过程中中华乌塘鳢的CRI先升高后回落,空间分布总体上是近岸高、远岸低,但整个调查期间各管理窗口中华乌塘鳢的CRI均低于1×10-6,没有致癌风险。人工饵料PAHs的平均含量仅为0.13 ng·g-1,其CRI远低于各生长期中华乌塘鳢的CRI。
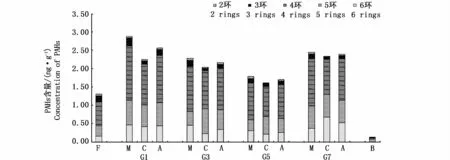
图6 中华乌塘鳢和饵料PAHs的含量及组成Fig.6 Concentration and composition of PAHs of Bostrychus sinensis and bait
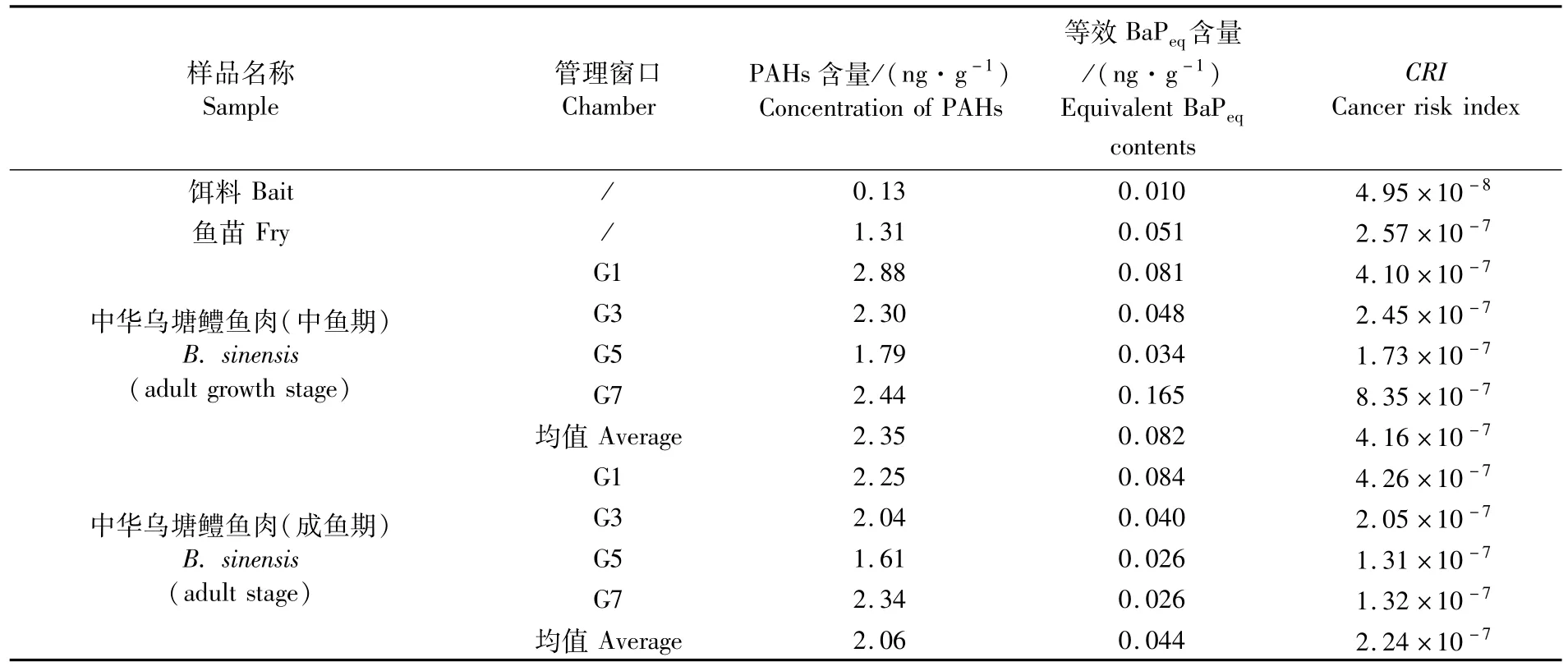
表4 中华乌塘鳢及饵料的PAHs含量、等效BaPeq含量及CRI值Tab.4 Concentration of PAHs,equivalent BaPeq contents and CRI values of B.sinensis and bait
3 讨论
3.1 养殖环境PAHs分布的影响因素
PAHs主要源于煤炭燃烧、石油炼化和草木燃烧等[24],既有天然来源,也有人为来源,其中人类活动产生的PAHs是近海环境PAHs的主要来源[25]。人为产生的PAHs主要通过地表径流、船舶运输、石油泄漏、工业和城镇生活污水等途径进入海洋[26-28]。北仑河口红树林地埋管道生态养殖系统位于防城港市珍珠湾,珍珠湾沿岸无产生PAHs的大型工业企业,湾内西北侧是人口密集的江平镇[29],湾顶有江平江和黄竹江注入,东岸靠近湾口有一个较大的港口(广西江山港边地贸口岸),这些成为了养殖系统PAHs的主要来源。
调查期间,由于船舶来往频繁,江山港边地贸口岸附近海域的石油类排放物超标[30],而珍珠湾的涨潮潮流恰好通过该区域[31],受此影响进入红树林地埋管道生态养殖系统自然海水的PAHs含量较高。本研究中的蓄水池紧挨道路,道路路面残留的汽车燃烧产物和轮胎磨损颗粒含有高浓度的PAHs[32],在被雨水冲刷后可进入蓄水池,引起蓄水池水体PAHs的含量升高。此外蓄水池的PAHs含量高也与涨潮时自然海水通过潮沟直接注入有关。养殖过程产生的残饵、粪便以及红树林区悬浮物的沉降给养殖系统带来了丰富的固体颗粒物,这些颗粒物易于吸附PAHs[33],降低养殖水体PAHs的含量。受此影响,退潮时蓄水池内高含量的PAHs水体通过固体颗粒物含量丰富的管道进入管理窗口后,理论上应形成由近岸及远岸各管理窗口的水体PAHs含量递减的分布规律,但调查中发现远岸的G5管理窗口的平均含量反而最高,引起该现象的主要原因可能是与G5管理窗口距岸较远、窗口内还存有大量PAHs含量较高的自然海水有关,这从两者的PAHs组成结构类似也可反映。而G7管理窗口的PAHs平均含量稍高于G1,可能是由两窗口内悬浮物含量差异所致,G7的悬浮物含量为45.3 mg·L-1,低于G1的56.7 mg·L-1。中华乌塘鳢幼苗期(春季),珍珠湾的石油类超标站位高达78%[30],因此管理窗口水体PAHs的平均含量较高。中鱼期雨量充沛,大量雨水可将沿岸桉树林历年炼山焚烧草木等生产生活产生的PAHs直接或间接输入海湾,此外中鱼期(夏季)的石油类污染也相对较高[30],PAHs的多种来源引起了该时期湾内海水PAHs的含量升高,导致管理窗口养殖水体的PAHs平均含量为3次调查中最高,这也与该时期PAHs的来源分析结果相符。成鱼期(秋季)降雨量减少,珍珠湾内的石油类污染也有所缓解[30],因此成鱼期管理窗口内水体PAHs的平均含量最低。
PAHs易吸附在富含有机质的悬浮颗粒,并沉降逐渐累积于沉积物[34]。红树林地埋管道生态养殖系统在运行过程中产生大量富含有机质的残饵、粪便等悬浮颗粒,这些颗粒是PAHs有效的吸附剂。涨潮时,海水穿过红树林,其中的悬浮物依粒径大小先后沉降,故进入各管理窗口的悬浮物粒径大小应与各管理窗口的离岸距离成正比。有研究表明,悬浮物粒径越小,其表面积与体积的比值越大,吸附PAHs的能力越强[35],因此进入各管理窗口的悬浮物PAHs平均含量应与管理窗口的离岸距离成反比。退潮时,蓄水池的水体通过管道进入各管理窗口,管道内因养殖产生的颗粒物质在吸附水体中的PAHs后可能会沉至管底,沉积的量与管道的长度成正比,造成了离岸越远、含PAHs的悬浮颗粒进入窗口内的量越低的现象。由于管理窗口是饵料投喂的主要场所,每天剩余的饵料会沉积在窗口底部成为新的吸附剂,吸附原有沉积物中的PAHs,并重新达到平衡,导致了离岸越远、管理窗口内沉积物的PAHs平均含量越低。此外,各管理窗口沉积物PAHs的组成也反映了该系统物质交换特点和管理窗口的离岸距离是决定沉积物PAHs空间分布的重要因素。G1管理窗口与蓄水池间的管道距离较短,退潮时蓄水池蓄存的自然海水主要在管理窗口与沉积物发生物质交换,而G5管理窗口靠近潮沟,涨潮时自然海水直接漫进该窗口,与沉积物发生作用,因此G1和G5管理窗口沉积物的PAHs组成相近。G3和G5管理窗口与蓄水池间的管道距离较长,处于红树林林内,无论涨、落潮,流进管理窗口的含PAHs海水或被管道内的颗粒物质吸附部分留存管道内、或被沿途红树植物以及表层沉积物部分吸附,因此G3和G5管理窗口的沉积物PAHs组成类似。综上所述,各管理窗口沉积物PAHs的平均含量大小关系理论上应是G1>G7>G3>G5,但调查结果却是G1>G3>G7>G5,出现这种现象可能是因为G3管理窗口沉积物的有机质含量高于G7管理窗口。研究表明,沉积物中有机碳含量与其吸附PAHs的量成正比[34,36],G3管理窗口沉积物的有机碳平均含量为2.45%,而 G7管理窗口的稍低为1.86%。沉积物吸附PAHs的过程中,其颗粒表面的疏水位点在吸附的初期会被PAHs快速占据,随后向沉积物颗粒内部的疏水位点缓慢扩散,并最终达到吸附平衡[37-38],这可能是导致各管理窗口水体与沉积物PAHs空间分布相反的根本原因。本研究3次调查采样均在养殖系统清理的前一天,各管理窗口沉积物颗粒的表面及内部疏水位点大部分已被PAHs占据,并达到吸附平衡,虽然与之接触的水体PAHs含量较高,但也无法快速大量吸附。沉积物累积PAHs是一个时间较长的过程[37-38],因此管理窗口沉积物PAHs平均含量的时间变化主要与水质的季节变化有关。调查期间珍珠湾海水中的石油类污染在春季较重,夏季有所缓解,秋季好转[30]。受此影响,中华乌塘鳢幼苗期、中鱼期管理窗口沉积物的PAHs来源于木、煤燃烧和石油燃烧排放,到了成鱼期则主要源于木、煤燃烧排放。这导致了调查期间管理窗口沉积物PAHs的平均含量与珍珠湾海水石油类的变化趋势一致,均呈现出递减的变化趋势。
3.2 与其他养殖区生态风险的比较
红树林地埋管道生态养殖系统管理窗口养殖水体PAHs的HQ均小于1,沉积物PAHs的含量也低于ERL,说明该养殖环境的生态风险较低,对生物无明显的毒副作用。与大亚湾澳头前山养殖区、马銮湾养殖区以及台州湾养殖区相比,红树林地埋管道生态养殖系统养殖水体PAHs的HQ平均值远低于大亚湾澳头前山养殖区和台州湾海水养殖区,但个别 PAHs单体(Flu、Phe、Ant、Fla、Pyr)的HQ稍高于马銮湾(表5)。除了Acy外,管理窗口沉积物PAHs的平均含量均低于大亚湾澳头前山养殖区和马銮湾养殖区,但与台州湾海水养殖区相比,管理窗口沉积物PAHs的平均含量仅Nap、Ace和Phe稍低,其余PAHs单体的平均含量均高于台州湾(表6)。澳头前山养殖区位于半封闭海湾大亚湾的西北角,主要养殖方式为网箱养殖,依靠潮汐作用净化养殖环境,但其周边分布着港口码头、工业和生活等污染源,各类污染物可通过潮流进入养殖区,导致养殖水体和沉积物个别PAHs单体的生态风险较高[39]。马銮湾是封闭海湾,其主要养殖方式也是网箱养殖,虽无潮流带入污染物,但湾内机动船含油废水的排放和汽油、柴油等燃料的燃烧,导致污染物在底质环境累积,沉积物中个别PAHs单体的生态风险偏高[40]。台州湾养殖区是围塘养殖,养殖环境可控,PAHs的生态风险相对较低[41]。由此可见,半封闭海湾养殖虽可自净环境,但易通过潮汐带入污染物,增加了PAHs的生态风险;封闭海湾养殖不易带入污染物,但自净能力差,易累积污染物,同样会增加PAHs的生态风险;围塘养殖环境可控,PAHs生态风险较低,但环境容量较低,抵御环境风险的能力较差。而红树林地埋管道生态养殖系统置身于半封闭的珍珠湾,周边产生PAHs的污染源较少,加之红树林湿地的净化能力较强,因此养殖环境PAHs的生态风险较低。
3.3 中华乌塘鳢健康风险的影响因素及理论环境阈值分析
人工饵料PAHs的平均含量较低,CRI也低于各生长期中华乌塘鳢的CRI,因此人工饵料不是中华乌塘鳢富集PAHs的主要渠道。中华乌塘鳢PAHs含量及CRI的时间变化主要与养殖环境的变化密切相关。幼苗期和中鱼期管理窗口养殖水体和沉积物PAHs的含量均高于成鱼期,含PAHs量低的中华乌塘鳢鱼苗在投养后,因PAHs亲油疏水而被快速富集,造成了中鱼期中华乌塘鳢的PAHs含量和CRI高。但成鱼期养殖水质和沉积物质量较好,中华乌塘鳢体内富集的PAHs通过代谢活动排出体外,因而成鱼期的PAHs含量和CRI低。可能受近岸陆源PAHs输入影响,各管理窗口中华乌塘鳢鱼肉PAHs和CRI的水平分布与离岸距离成反比。中华乌塘鳢属底栖生物,喜暗怕光,白天潜居于泥洞、石洞或其他隐蔽物中,多在夜间活动和摄食[42],由此可判断其体内的PAHs含量受到养殖水体及沉积物环境的影响。中华乌塘鳢对PAHs的富集系数按其体内PAHs含量与养殖水体、沉积物的比值进行计算,为了便于分析比较,统一量纲后再计算富集系数。由表7可知,中华乌塘鳢对养殖水体PAHs的富集系数为0.023,主要富集3、4环的PAHs单体,富集5、6环的较少,其中对芘和荧蒽的富集系数较高;对沉积物PAHs的富集系数为0.010,同样倾向于富集3、4环的PAHs,2、5、6环的单体富集较少,其中对苊、菲、芴和芘的富集系数较高。沉积物的PAHs含量高于养殖水体,但中华乌塘鳢对养殖水体PAHs的富集系数高于沉积物,其主要原因是管理窗口的沉积物定期清理,接触时间短,富集量低。
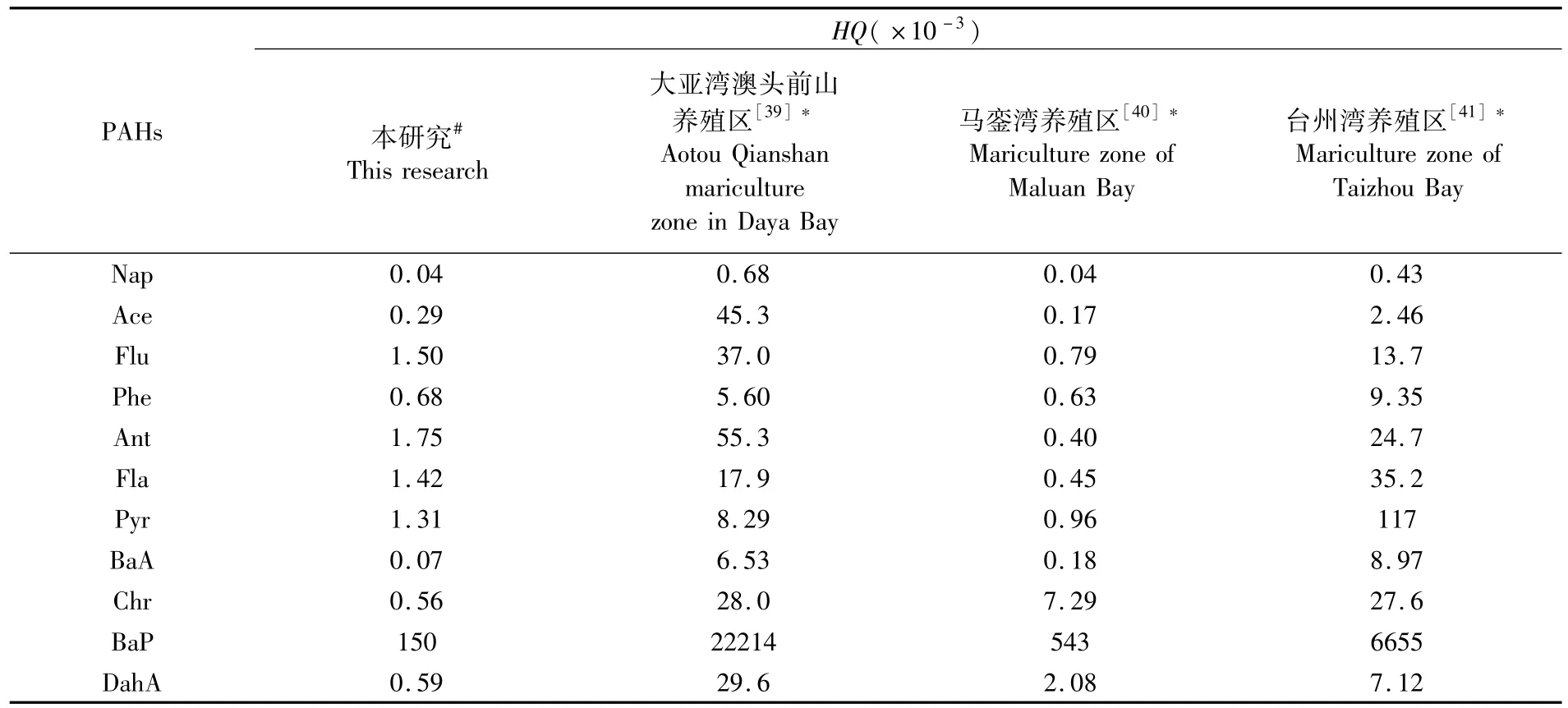
表5 不同养殖区水体PAHs的生态风险比较Tab.5 Comparison of HQ of PAHs in different mariculture zones
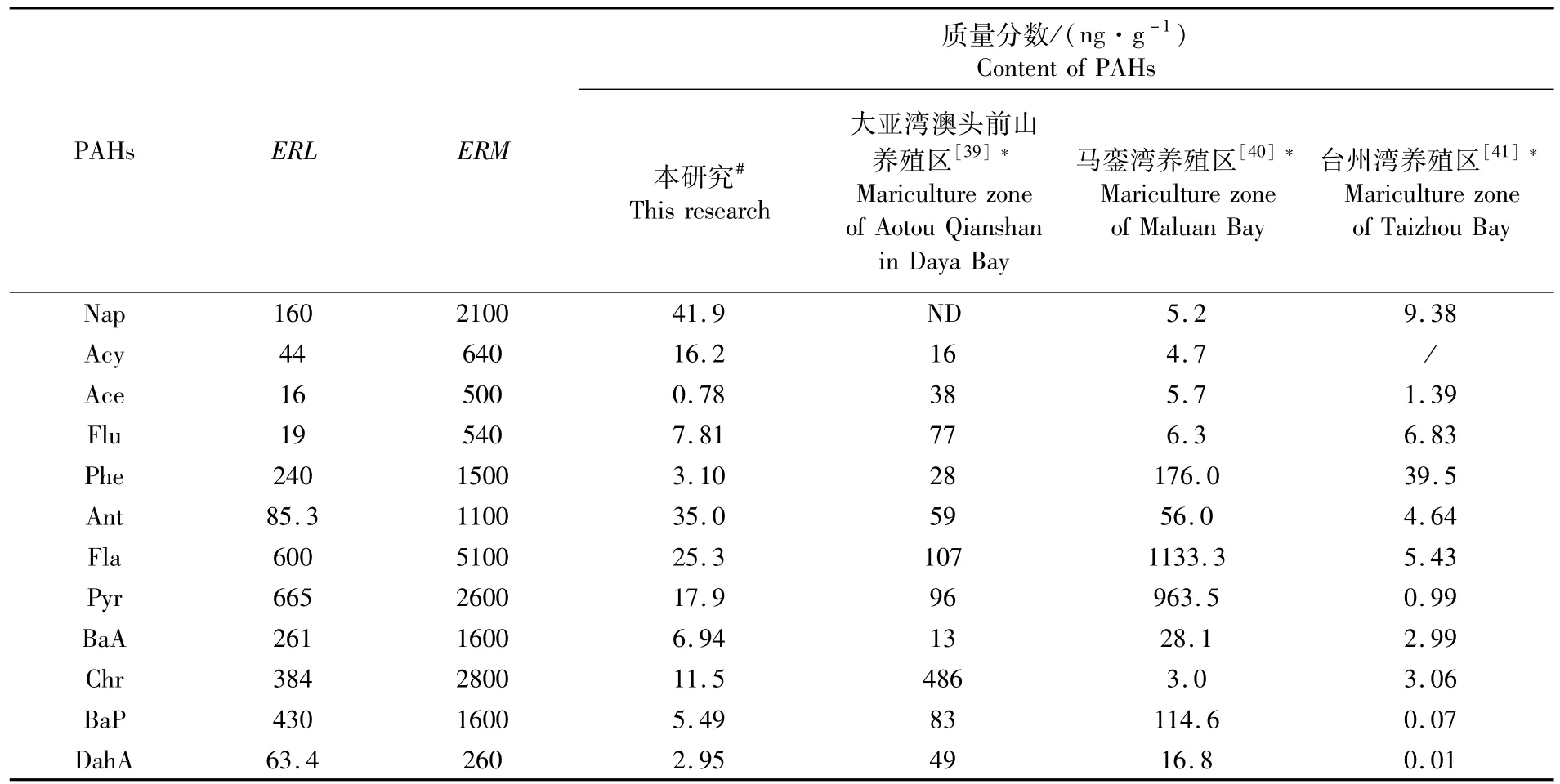
表6 不同养殖区沉积物生态风险的比较Tab.6 Ecological risk assessment comparison of PAHs in sediments from mangrove underground pipe eco-farming system
使用CRI的下限值、养殖环境PAHs单体的占比以及富集系数可分别反推取得致癌风险可接受情况下及较高情况下PAHs的理论环境阈值及剩余环境容量。由表8可知,在致癌风险可接受的情况下,养殖水体和沉积物PAHs的理论环境阈值分别为334.65 ng·L-1和773.61 ng·g-1,单位养殖环境的剩余环境容量较高,占环境阈值的66%以上。在致癌风险较高的情况下,养殖水体和沉积物PAHs的理论环境阈值分别为33.47 μg·L-1和77.36μg·g-1,单位养殖环境的剩余环境容量高,占环境阈值的99%以上。由此可见,红树林地埋管道生态养殖系统的环境质量较好,PAHs的剩余环境容量较大,但BaP和DahA等个别单体的毒性较大,且环境阈值相对其他单体的低,易受外部环境变化的影响,不能忽视。
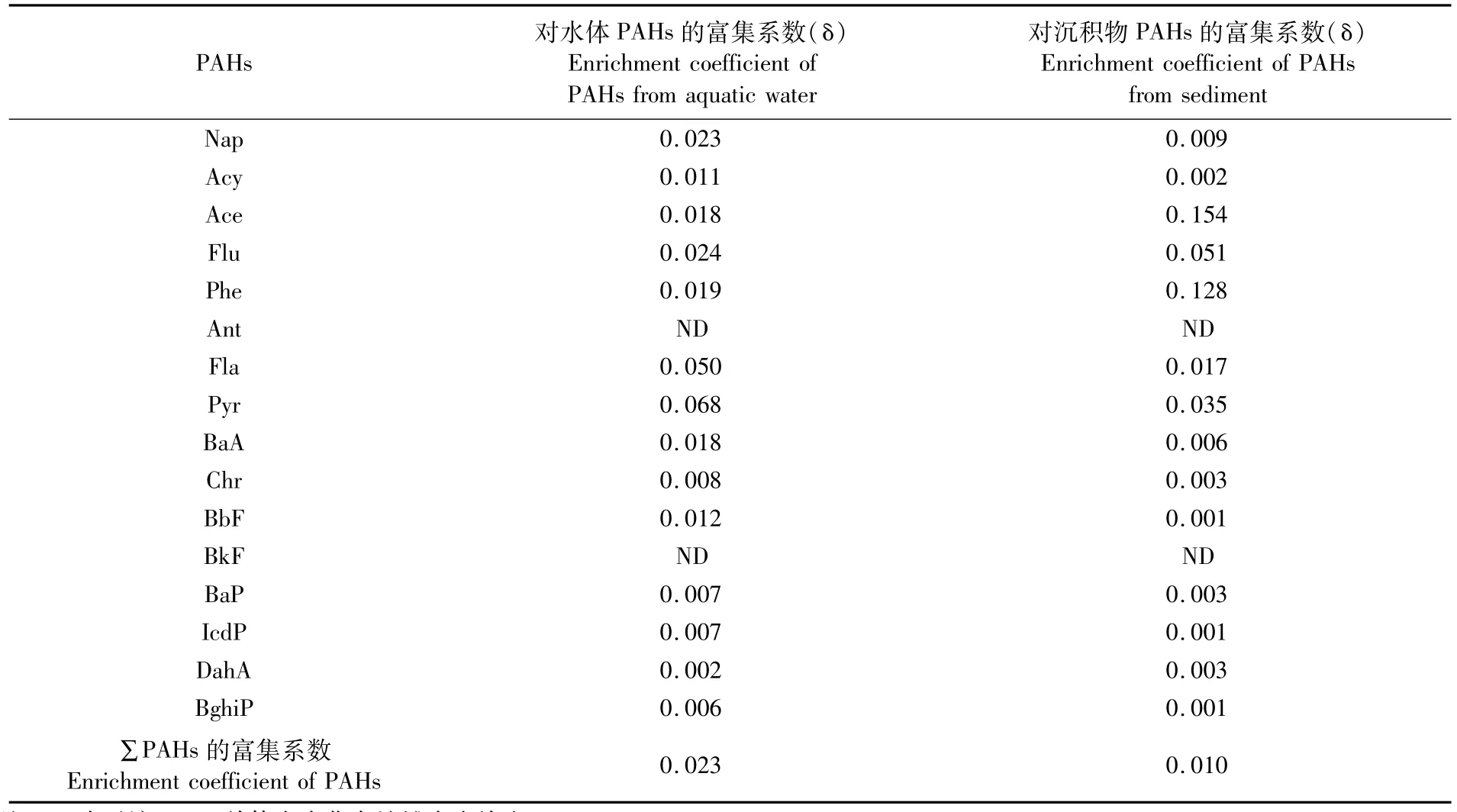
表7 中华乌塘鳢对PAHs的富集系数Tab.7 Enrichment coefficient of PAHs in Bostrychus sinensis
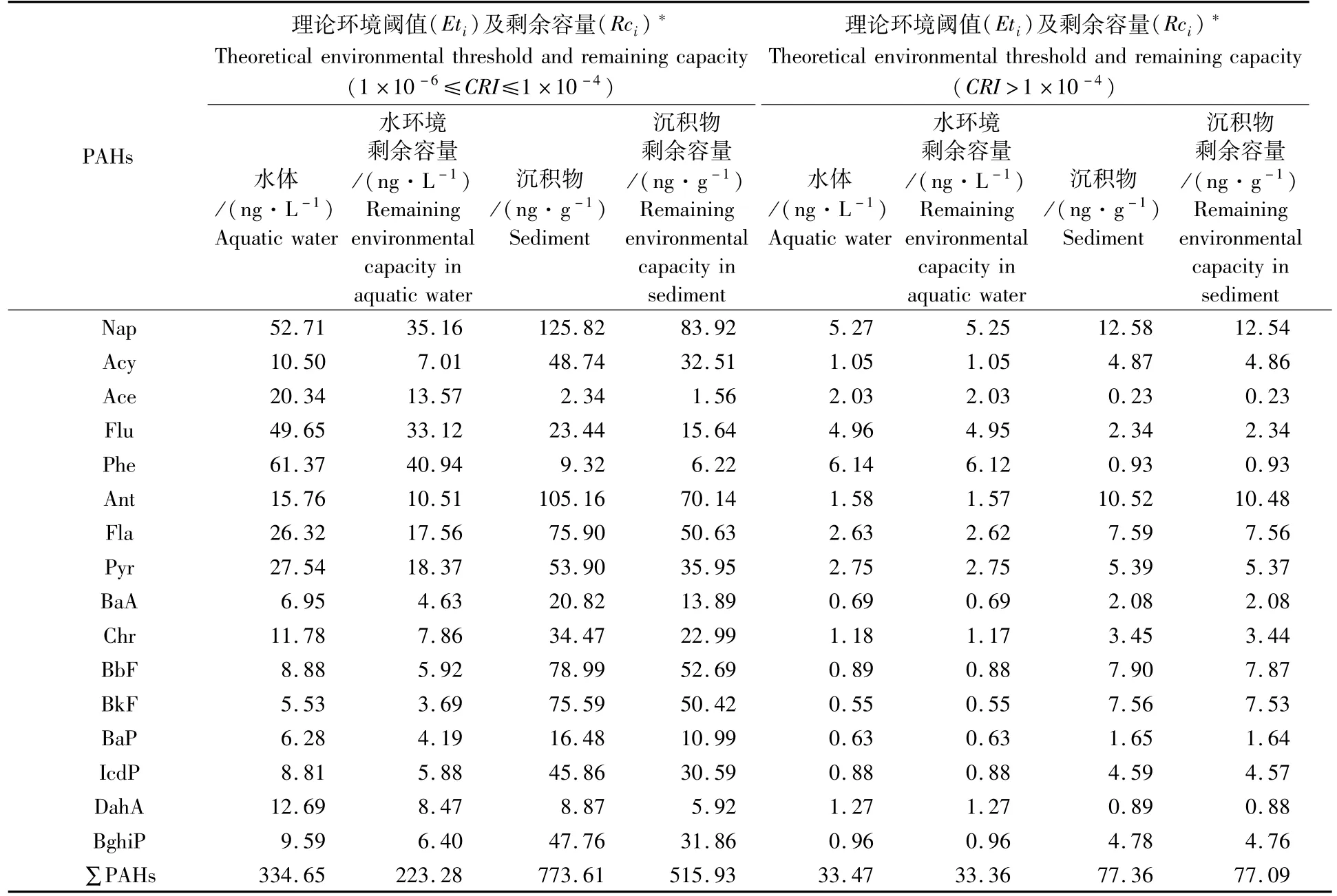
表8 养殖环境PAHs的理论环境阈值及剩余容量Tab.8 Theoretical environmental threshold and remaining capacity of PAHs in mariculture zone
4 小结
1)红树林地埋管道生态养殖系统管理窗口水体PAHs平均含量的水平分布为G5>G7>G1>G3,时间变化为中鱼期>成鱼期>幼苗期;沉积物PAHs的平均含量水平分布为G1>G3>G7>G5,时间变化为幼苗期>中鱼期>成鱼期。
2)幼苗期管理窗口水体PAHs主要源于石油燃烧排放,中鱼期主要是石油、石油燃烧和木、煤燃烧排放的混合源,成鱼期主要是木、煤燃烧排放。调查期间管理窗口沉积物的PAHs主要源于石油燃烧和木、煤燃烧排放。
3)管理窗口水体PAHs的水平分布主要与珍珠湾海水输入、近岸陆源输入和管理窗口理化性质差异有关,时间变化主要与珍珠湾水质季节变化以及地表径流输入有关。管理窗口沉积物PAHs的水平分布主要受管道颗粒物质含量影响,时间变化主要与珍珠湾水质季节变化有关。
4)红树林地埋管道生态养殖系统管理窗口水体PAHs的HQ小于1,沉积物PAHs含量都低于ERL,说明该养殖系统的PAHs含量水平对生物无明显毒副作用,生态风险较小。
5)调查期间,各管理窗口中华乌塘鳢的CRI均低于1×10-6,没有致癌风险。中华乌塘鳢的CRI时间变化主要与珍珠湾水质的季节变化有关,水平分布可能受陆源输入影响。
6)中华乌塘鳢的CRI为可接受或较高时,红树林地埋管道生态养殖系统PAHs的剩余环境容量较高。

