microRNA对肝癌细胞生物学行为影响的研究进展
胡超,王新保
(浙江省肿瘤医院腹部肿瘤外科,浙江 杭州 310022)
肝癌作为消化道恶性肿瘤中最常见的一类肿瘤,其致死率一直排在各种癌症中的前列。目前手术切除或者肝移植仍然是可能治愈肝癌的最佳方法。但是许多肝癌病人被确诊时往往已经到了肝癌晚期,错过了最佳手术时机。对于进展期肝癌病人,分子靶向治疗在临床上取得了一定的疗效,如索拉非尼,瑞格非尼等靶向药物的使用一定程度上延长了病人的生存期,但其中位生存期也仅为3~10个月[1]。因此,临床上迫切需要探索新的治疗方法,尤其是寻找更准确的肝癌早期诊断、治疗和预后指标。
微小RNA(microRNA)于1993年首次被人在线虫中发现与发育有关以后,掀起了全世界科学家对它的研究热潮。随着研究的不断深入,它在人体中的作用也越来越多的被揭示,从细胞的增殖、凋亡、分化一直到发育等。越来越多的microRNAs被发现在肿瘤细胞或者肿瘤组织中存在特异性表达,大量文献表明了它们在如肝癌、肺癌、胃癌、结肠癌、乳腺癌、前列腺癌等多种肿瘤的发生发展中发挥了重要作用[2-3]。目前的研究发现microRNA对肝癌细胞的增殖、凋亡、侵袭、迁移都有着重要的调控作用,而且对肝癌的血管形成也有着重要影响[4]。可见microRNA在肝癌的发生发展过程中起到了举足轻重的作用。因此本文对microRNA对肝癌细胞生物学行为的影响的研究进展进行了综述。
一、microRNA结构特点与作用机制
microRNA 是一类长度为20个核苷酸左右的非编码小RNA,主要通过与mRNA的3′非编码区相互作用,形成RNA诱导的沉默复合物导致翻译抑制或者使靶基因降解从而对基因的表达进行调控。microRNA在生物体内的作用方式主要有两种,一种是通过与靶基因的3′UTR区不完全互补结合,导致靶基因mRNA的翻译功能被抑制,但是这并不影响mRNA的稳定性,从而发挥其负性调控作用[5];第二种则是通过与其靶基因的3′UTR区完全互补结合,引起靶基因的mRNA的降解从而发挥其负性调控作用[6]。
二、肝癌中异常表达的microRNA
随着对肝癌中microRNA的研究的深入,越来越多的microRNA被发现在肝癌组织中表达异常。肝癌组织中表达异常的microRNA分为表达上调的microRNA和表达下调的microRNA。肝癌组织中表达上调的microRNA可能针对多个抑癌基因产生作用,通过负性调控作用抑制其表达,从而产生促癌作用,因此这些microRNA大多数为癌基因。根据文献报道,有些microRNA在肝癌组织中表达上调(表1),有些microRNA在肝癌组织中表达下调(表2)。这些下调的microRNA的靶基因大多数是癌基因,microRNA通过使靶基因降解或者抑制其翻译从而使相关蛋白的表达水平降低,肝癌组织中表达降低的microRNA对癌基因的抑制作用减少导致癌基因的表达增加,从而对肝癌的发生发展起到了一定的推动作用。这些上调或者下调的microRNA在肝癌的作用多种多样,通过不同的蛋白、不同的信号通路对肝癌细胞的增殖、凋亡、侵袭迁移以及血管形成等产生重要作用。
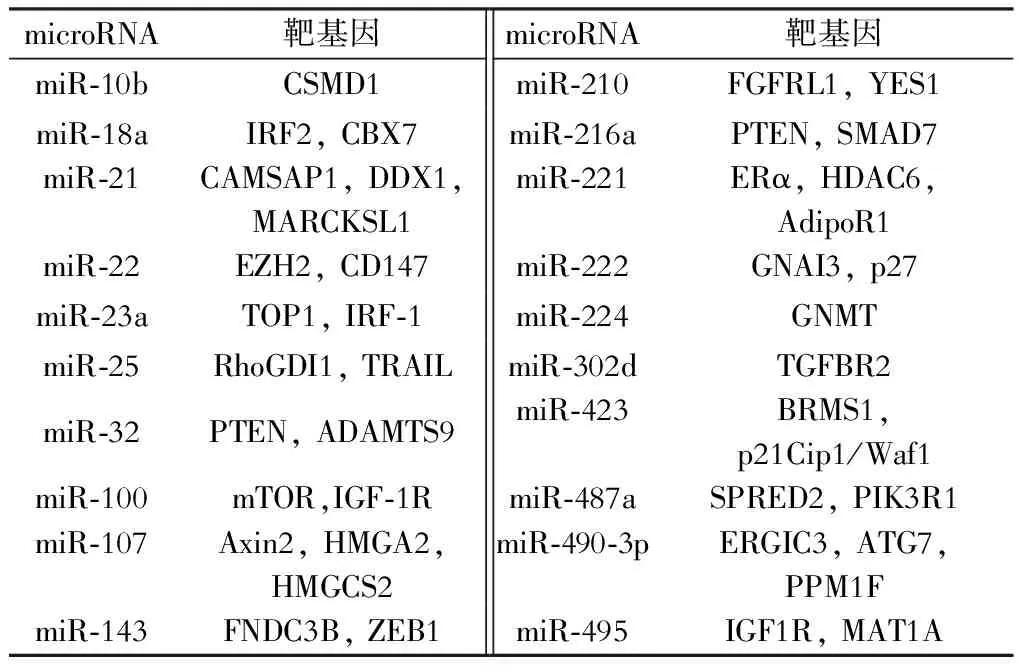
表1 肝癌组织中表达上调的microRNA及其靶基因

表2 肝癌组织中表达下调的microRNA及其靶基因
三、microRNA对肝癌细胞生物学行为的影响
(一)microRNA对肝癌细胞增殖的影响
在对肝癌的研究中有学者发现作为一种致瘤源性受体,酪氨酸激酶-肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR/c-met)在70%的肝癌组织中表达明显增高[7]。而且HGFR的水平受到多种microRNA的调节。如在肝癌组织中表达显著下降的miR-1-1、miR-23b、miR-34a,这些microRNA通过负性调节HGFR的表达,使HGFR的表达水平在肝癌组织中显著提高,从而促进肝癌细胞增殖能力的增加[8-9]。另一种肝癌组织中低表达的microRNA则是通过抑制Ras的活性来发挥抑癌基因的作用,因其在肝癌组织中的表达水平下降从而对Ras活性的抑制作用减弱,最后导致了Ras的过度活化促进肝癌细胞的增殖[10]。另外一些microRNA则可以通过作用于磷酸肌醇-3激酶(phosphatidylinositol 3′-kinase,PI3K)信号通路来调控细胞的增殖能力。miR-21和miR-155-5p是两种肝癌组织中高表达的microRNA,它们则是通过抑制PTEN(一种典型的PI3K活性抑制蛋白)的活性来作用于PI3K信号通路,这两种microRNA表达水平的升高使PTEN的表达水平得到明显抑制,从而使PI3K信号通路得到激活,从而促进了肝癌细胞的增殖[11-12]。还有miR-29a可以通过抑制哺乳动物乙酰化酶1(SIRT1)的表达来抑制肝癌细胞的增殖[13]; miR-124也是通过PI3K信号通路来调控肝癌细胞的增殖;miR-18a则可以通过调节雌激素受体α(ERα)的表达水平调节肝癌细胞的增殖。各种microRNA对肝癌细胞增殖影响的作用机制各不相同,我们目前发现的这些对肝癌细胞增殖作用有影响的microRNA只是众多microRNA中的一小部分,还需要进行更多的研究来揭示microRNA对肝癌细胞增殖作用的调控机制。
(二)microRNA对肝癌细胞凋亡的影响
线粒体通路和死亡受体通路是细胞凋亡的两条经典的凋亡途径。在线粒体通路中Bcl-2家族蛋白成员是调控细胞凋亡的重要因素,这些蛋白可以决定线粒体是否激活凋亡程序或者释放促凋亡因子使细胞发生凋亡。Bcl-2家族成员根据其功能不同分为抗凋亡成员和促凋亡成员,抗凋亡成员有Bcl-2、Bcl-X1、Bcl-w、Mcl-1等,而促凋亡成员则有Bax、Bak、Bad、Bid、Bmf、Bim、PUMA等。而死亡受体通路则是通过由细胞表面的死亡受体接收细胞外的死亡信号后激活细胞内的凋亡机制从而诱导细胞凋亡。死亡受体是肿瘤坏死因子(TNF)基因超家族的成员,目前已知的死亡受体成员主要有Fas(CD95/APO-1),TNFR1, DR4(TRAIL-R1、APO-2), DR5(TRAIL-R2),DR3(APO-3、TRAMP、LARD、WSL1)等。而microRNA主要是通过影响这两条途径来实现对肝癌细胞的凋亡进行调控的,其中与线粒体途径有关的microRNA有miR-25、miR-29、miR-93、miR-106b、miR-101、miR-122、miR-125b、miR-221、miR-224等。其中miR-25、miR-93、miR-106b、miR-221这4个在肝癌组织中表达上调的microRNA主要作用于促凋亡基因Bim,它们可以抑制Bim的表达从而使肝癌细胞的凋亡受到抑制,从而促进肝癌的发展[14]。miR-29、miR-101、miR-122、miR-125b等在肝癌组织中表达水平下调的microRNA则主要作用于抗凋亡基因Mcl-1、Bcl-2和Bcl-w,它们通过促进抗凋亡蛋白的表达来促进肝癌细胞的凋亡,因其在肝癌组织中表达水平较低,故其抗凋亡作用受到抑制,从而促进肝癌的发生发展[15]。而miR-221除了可调控线粒体途径外还能通过调控死亡受体途径来调控肝癌细胞的凋亡。miR-221和miR-222可以抑制PTEN蛋白和基质金属蛋白酶抑制因子3(TIMP3)的表达,从而使肝癌细胞对TRAIL途径导致凋亡的抵抗能力增强,最终使肝癌细胞凋亡减少[16]。
(三)microRNA对肝癌细胞侵袭迁移能力的影响
肝细胞肝癌是一种侵袭能力很强的肿瘤,这一特性也直接导致了大部分肝癌病人预后欠佳。肝癌细胞的侵袭及迁移能力的强弱直接关系到肝癌发生转移可能性的大小。肝癌组织中microRNA的特异性表达与肝癌细胞的侵袭迁移能力的强弱有着密切的联系,许多研究都发现microRNA可以在不同程度上对肝癌细胞的侵袭迁移能力进行调控。miR-205以及miR-200家族中的miR-200a、miR-200b、miR-200c、miR-141、miR-429等能够通过促进表皮组织标志物E-cadherin的表达、抑制间叶组织标志物Vimentin的表达从而抑制上皮间叶转化(EMT)的发生,从而阻止肝癌细胞的侵袭和迁移[17-18]。而在肝癌组织中表达上调的miR-155则是通过对Ras超家族蛋白成员A(RhoA)的调控来促进转化生长因子β(TGF-β)引起的EMT,从而促进肝癌细胞的侵袭迁移[19]。通过下调RhoA蛋白下游激酶(ROCK2)和组蛋白-赖氨酸N-甲基转移酶的表达,miR-124抑制了肝癌细胞细胞骨架改组以及EMT的发生,从而起到抑制肝癌细胞侵袭转移的作用[20]。有研究发现对细胞凋亡有调控作用的miR-29a对肝癌细胞的侵袭迁移能力也有影响,它可以和Ras信号通路共同作用降低锌指蛋白(TTP)的表达,而TTP是一种RNA结合蛋白,它能够与mRNA的3′非翻译区中富含AU的区域结合,从而介导mRNA的降解,当TTP的表达被抑制后,相应靶基因mRNA的降解就受到抑制,因此导致了EMT的发生并促进了肿瘤转移[21]。随着人们对microRNA关注度的不断提高,microRNA的研究手段也越来越丰富,特别是大规模的基因筛查,为我们筛选出了更多的与肝癌转移有关的microRNA,如miR-34a、miR-135a、miR-143、miR-139、miR-199a-5p等,这些研究成果为我们最终战胜肝癌打下了坚实的基础。
(四)microRNA对肝癌血管形成的影响
肝癌的发生、发展、转移等过程都需要依赖于肝癌内的血管形成,如果能够有效地抑制肝癌内新生血管的形成,那么就能够抑制体内肝癌的生长。随着microRNA被发现,人们发现microRNA对肿瘤血管生成也有着重要的调控作用。特别是像肝癌这些富血管的肿瘤,microRNA更是有着举足轻重的调控作用。有研究表明许多microRNA在肝癌组织的内皮细胞中有着特异性表达,而且从新生血管的生成到血管的生长发育,这些过程中都有microRNA的参与。microRNA可以通过肿瘤微环境中某些细胞因子的生成或者通过影响细胞内某些信号通路来调控肝癌内血管的形成。如miR-221和miR-222可以通过调控下游靶基因如c-kit、p27Kip1、p57Kip2、Cyclin G1等来调控血管内皮细胞的增殖和迁移,从而影响血管形成[22]。miR-122可以通过降低肿瘤坏死因子α转化酶的表达来抑制肝癌新生血管的生成[23]。除了抑制血管生成的microRNA,许多microRNA也可以促进血管生成。如miR-126,作为一个内皮细胞特异性microRNA,它能够通过调节血管内皮生长因子(VEGF)水平以及促进内皮细胞增殖,从而促进血管生成。有研究表示将miR-126敲除后肿瘤就失去了血管完整性以及新生血管生成能力[24]。miR-296能够通过作用于肝细胞生长因子调节的络氨酸激酶(HGS)来调节VEGF受体2以及血小板源性生长因子β受体的表达,从而促进肝癌血管生成[25]。促进血管生成的microRNA还有miR-17-92家族的一系列microRNA,它们通过作用于凝血酶敏感蛋白1(TSP1)和结缔组织生长因子(GTGF)来调控血管生成[26]。
四、microRNA与肝癌的诊断
早发现、早诊断、早治疗是所有肿瘤的处理原则,特别是像肝癌这种早期缺乏特异性临床特征的疾病,早期诊断直接关系到病人的治疗方案、效果及生存时间。目前肝癌在血清学指标上尚无灵敏性及特异性均比较高的检测指标,虽然血清甲胎蛋白(AFP)的检测应用于临床已经多年,然而AFP的灵敏性及特异性均不是特别高,它的灵敏性只有39%~65%,而特异性也只有76%~94%。而且除了肝癌,其他疾病也可能会导致AFP升高,如肝炎、肝硬化以及某些生殖细胞肿瘤等。因此寻找一种特异性及灵敏度均比较高的标志物就显得刻不容缓。
因为microRNA在肝脏及肝癌组织中的特异性表达,越来越多的研究开始关注microRNA作为肝癌的肿瘤标志物是否可行这一问题上来。要对肝癌进行早期诊断,取肝组织检测microRNA的表达情况显然不现实,因此人们把目光投向了血清学microRNA,然后人们就发现外周血中microRNA的表达非常稳定,特别是在疾病的早期或者发病之前。而肝癌病人外周血中的miR-21、miR-122、miR-223比正常人以及慢性肝炎病人均显著升高[27]。有学者通过检测肝癌外周血中miR-21水平并与正常人以及慢性肝炎病人进行比较,发现其检测准确度显著高于AFP。还有报道显示miR-130b检测肝癌的灵敏度为87.7%,而特异性为81.4%,也远远优于AFP,而阳性率最高的microRNA则是miR-15b,其阳性率为98.3%,然而其特异性较差,只有15.3%[28]。近期还有研究发现与健康受试者以及肝硬化病人相比miR-101-3p、miR-1246 以及miR-106b-3p在肝癌病人外周血中表达显著增高,该项研究表明上述3个microRNA作为早期诊断肝癌的标志物,具有较高的潜能[29]。除此之外还有许多microRNA被发现在肝癌病人外周血中显著升高,如miR-1、miR-25、miR-92a、miR-206、miR-375、let-7f等20余种。可见microRNA是有很大潜力作为肝癌诊断标志物的,其稳定性和特异性都符合作为一种诊断标志物的标准。然而由于肝癌病人常常伴有许多其他疾病,引起肝癌的原因也各不相同,因此还需要更多的研究来确定血清中microRNA的含量和其他疾病的关系,才能最终确定是否可以用于肝癌的诊断。
五、microRNA与肝癌的治疗
目前针对microRNA的研究大多数还局限于体外研究,在细胞水平上研究microRNA对肝癌的作用。大多数都是根据microRNA作为癌基因或者抑癌基因的作用,通过生物学方法抑制某个microRNA的表达或者使某个microRNA过表达来观察其对肝癌细胞的生物学行为的影响。而在活体研究中一项针对miR-26a的研究中,研究者们针对miR-26a在正常肝脏组织中呈高表达而在肝癌组织中几乎不表达的特性,利用腺病毒导入肝癌小鼠模型中,最后发现miR-26a可以显著抑制肝癌细胞增殖,促进肝癌细胞特异性凋亡,延缓病情的恶化,而且并未发现对动物有明显的毒副作用。这一结果首次表明了针对microRNA的基因替代疗法来治疗肝癌是有可能实现的[30]。还有另外两项动物模型的研究发现,通过反义核苷酸技术抑制肝癌小鼠模型中miR-221的表达,可以显著缩小肿瘤的体积,延长小鼠的生存时间[31-32]。以上表明针对microRNA来治疗肝癌是很有可能的。
目前对中晚期肿瘤病人的治疗往往是通过化疗来实现的,然而肝癌对于大部分化疗药物的敏感性都比较低,许多化疗方案在肝癌的治疗上均宣告失败。因此如何降低肝癌细胞对化疗药物的耐药性是目前亟待解决的问题。随着对肝癌耐药机制的研究,多项研究结果表明microRNA在促进或者降低肝癌细胞耐药性上具有调节因子的作用,许多药物都是通过microRNA对特异靶点发挥作用,因此microRNA可能在对降低或者逆转肝癌对化疗药物的耐药性上具有潜在的治疗意义。索拉非尼一直是肝癌的一线治疗药物,但是由于肿瘤异质性、先天或者后天养成的耐药性,索拉非尼的作用并没有得到很好的发挥。但是有多项研究表明某些microRNA可以降低甚至逆转肝癌对索拉非尼的耐药性,如miR-7可以通过PI3K-AKT信号通路降低其靶基因TYRO3的表达从而降低肝癌细胞对索拉非尼的耐药性[33]。还有研究表明miR-216a/217的过表达可以激活TGF-β信号通路从而导致肝癌细胞对索拉非尼的耐药,因此如果降低其表达并阻断TGF-β信号通路则可以逆转索拉非尼的耐药性[34]。miR-367-3p则是通过调控MDM2/AR/FKBP5/PHLPP/(pAKT和pERK)信号通路来增加索拉非尼对肝癌细胞的作用效果[35]。除了索拉非尼,microRNA对其他化疗药物的敏感性也有调控作用,如miR-182可以通过调控TP53诱导核蛋白1(TP53INP1)的表达来促进肝癌细胞对顺铂的耐药性[36]。而降低miR-33a-5p的表达却将导致肝癌细胞对顺铂的敏感性降低[37]。还有miR-31以及其靶基因NDRG3的表达则可促进肝癌细胞对阿霉素的敏感性[38]。
六、microRNA与免疫应答
近几年,免疫治疗在肿瘤中的应用引起了人们广泛关注,其理论基础是1957年提出的“免疫监视”学说,即体内不断产生肿瘤细胞,但机体免疫系统可有效识别新生的肿瘤细胞,并在出现临床特征之前将其清除。临床所见肿瘤属稀有事件,乃肿瘤逃避免疫监视的结果。最近研究发现microRNA参与了免疫细胞的分化、天然免疫以及适应性免疫应答等,在肿瘤免疫多个环节起重要作用。如NK细胞能非特异性地杀伤多种肿瘤细胞,对正常细胞则无杀伤作用,是一类重要的抗肿瘤效应细胞,而miR-152的过表达可使人体中的自然杀伤细胞(NK细胞)增殖明显增加,这也说明miR-152可能是通过上调NK细胞的增殖来增强宿主的免疫功能[39]。而Tsukeman等[40]则通过体外杀伤和动物体内肿瘤清除实验证明了过表达miR-10b可以增强肿瘤对NK细胞杀伤的抵抗,而沉默miR-10b则产生相反效果。作为抗肿瘤免疫中的抗原递呈细胞以及吞噬肿瘤的效应细胞,巨噬细胞也受到众多microRNA的调控,Luers等[41]通过用阵列技术发现hsa-let-7a、miR-16、miR-23a、miR-30b、miR-103、miR-146a、miR-212、miR-378等microRNA在巨噬细胞的肿瘤免疫方面起着重要作用。
七、展望
根据上面的描述,我们可以发现同一种microRNA可以对细胞的增殖、凋亡、侵袭、迁移以及血管生成等多个方面进行调控,而细胞的这些生物学行为中的每一个又可以被多个microRNA调控,可见microRNA对细胞生物学行为的调控是一个密不可分的调控网络,这些microRNA通过作用于不同的信号通路,又把这些作用连接在一起,互相影响,互相制约,从而形成了精密而又复杂的microRNA调控网络。目前的研究结果对microRNA复杂的调控网络来说无异于只是发现了冰山一角,尚有众多microRNA及其靶基因未被发现,其调控网络的组成关系也尚未研究透彻,许多针对肝癌的microRNA研究结果重复性较差,甚至有部分出现了完全相反的结果,其差异可能与病因不同、个体差异或实验技术等因素有关。microRNA 作为一种新的基因治疗方式拥有较好的治疗前景,但是其安全性、长效性、治疗特异性等仍值得进一步研究,希望通过更深入研究,早日解决这些难题,为临床上肝癌治疗带来希望。

