机器人辅助胰十二指肠切除术治疗胰头导管腺癌的安全性及预后分析
姜毓,翁原驰,金佳斌,邓侠兴,彭承宏,沈柏用
(上海交通大学医学院附属瑞金医院胰腺外科,上海 200025)
胰腺癌发病呈快速上升趋势。外科手术的微创化、个体化及更加重视功能保留和生活质量提高成为外科手术的发展目标,以腹腔镜和机器人手术系统为代表的微创外科迅速发展。机器人手术系统可以提供高清的三维手术视野,操作灵活的Endowrist机械臂及过滤手的微震可提高操作稳定性,有利于提高解剖的精准和良好的术野暴露。越来越多的临床研究显示机器人胰十二指肠切除术(robotic pancreaticoduodneectomy,RPD)与传统开腹手术(open pacreaticoduodenectomy,OPD)相比是安全可行的,但是RPD治疗胰头导管腺癌在肿瘤根治性方面的价值目前仍不明确。本研究通过回顾单中心RPD治疗胰头导管腺癌的病人资料,以探究其安全性及有效性。
资料与方法
一、一般资料
回顾性收集2012年6月至2017年12月上海交通大学医学院附属瑞金医院胰腺外科行RPD手术的胰头导管腺癌病人的临床资料。包括:①病理证实为胰腺导管腺癌;②术前影像学检查未见远处转移;术前影像学评估未见肿瘤侵犯肝动脉、肠系膜上动脉等主要血管;③无严重心、肺、脑等功能不全;④围手术期及随访资料完整。根据意向性分析原则,因各种原因中转开腹的病人仍纳入本研究。
二、手术方法
所有病人术前常规留置胃管及导尿管。常规气管插管全身麻醉,RPD采用“五孔法”建立人工气腹,维持气腹压12~14 mmHg。主要手术步骤:游离胰腺下缘建立胰后隧道,肝十二指肠韧带淋巴结清扫,胰腺、空肠及胃离断,胰腺钩突游离,消化道重建。胰肠吻合采用胰管空肠黏膜对黏膜吻合(图1)。
三、分析指标与评价标准
1.分析指标 ①一般资料:年龄、性别、体质量指数(BMI)、吸烟史、饮酒史、糖尿病史、腹部手术史;②术前资料:白细胞、血红蛋白、血小板、总胆红素、术前胆道引流及方式、美国麻醉医师协会(ASA)分级、肿瘤标志物;③术中资料:手术时间、术中出血量、输血量、胰管直径、胰腺质地;④术后病理:手术切缘、TNM分期、脉管侵犯、神经侵犯;⑤术后资料:Clavien-Dindo分级、术后出血、胰瘘、胃排空障碍、腹腔感染、二次手术、术后住院时间、围手术期死亡;⑥随访资料:术后辅助治疗、复发时间、复发部位、死亡时间。
2.相关指标定义及标准 TNM分期采用美国癌症联合委员会(AJCC)第8版胰腺癌分期标准[1]。Clavien-Dindo分级参照中华医学会外科学分会胰腺外科学组发布的胰腺术后外科常见并发症诊治及预防的专家共识(2017)[2]。胰瘘标准参照国际胰瘘研究学组(ISGPF)2016版诊断标准[3]。术后胰瘘的诊断标准为术后>3 d时,引流液淀粉酶含量大于血清淀粉酶正常值上限的3倍,且与临床治疗预后相关。本研究中胰瘘指2016版诊断标准中B级和C级的病人。胃排空障碍参照国际胰腺外科学组(International Study Group on Pancreatic Surgery,ISGPS)的诊断标准[4]。胆漏参照国际肝胆外科学组(International Study Group of Liver Surgery,ISGLS)的诊断标准[5]。腹腔感染的诊断主要依据为
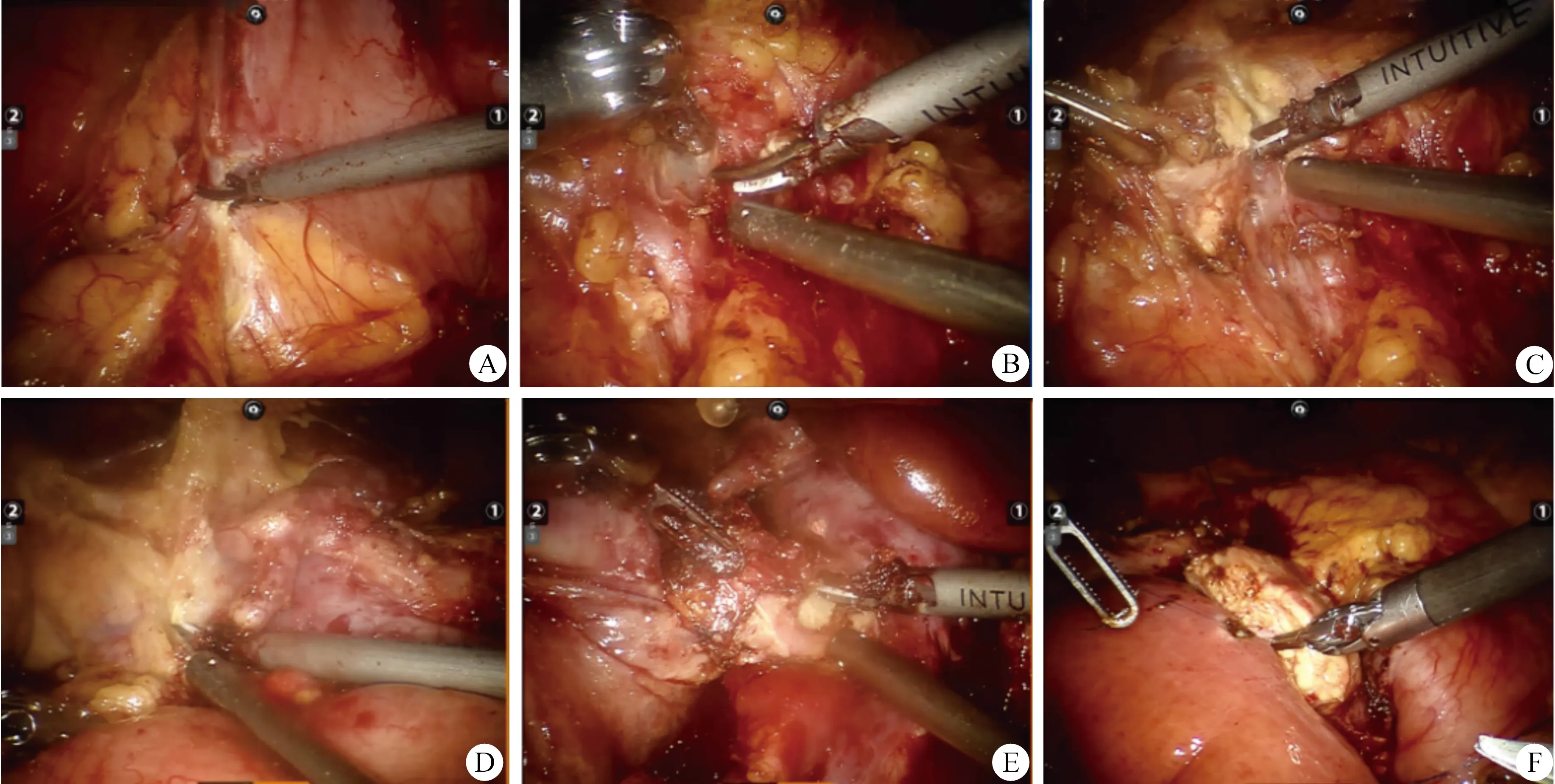
图1 机器人胰十二指肠切除术手术步骤 A.Kocher切口;B.解剖胰腺下缘,分离肠系膜上静脉;C.离断胰腺颈部;D.清扫肝十二指肠,离断胃十二指肠动脉;E.沿肠系膜上动脉游离胰腺钩突;F.胰肠吻合
腹腔引流管引流液培养阳性。二次手术是指同一次住院期间非计划内进行的再次手术,包括出血介入治疗。围手术期死亡是指术后住院期间或术后30 d内病人出现死亡。无病生存期指从手术开始至疾病复发的时间。总生存期的定义是指从手术开始至因任何原因引起死亡的时间。
四、统计学方法
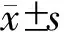
结 果
一、一般资料
共有120例病人纳入本研究。其中,男性74例(61.7%),女性46例(38.3%),年龄(62.4±9.3)岁。有既往腹部手术史病人8例(6.7%),因梗阻性黄疸接受术前胆道引流病人37例(30.8%)。CA19-9值为(520.9±1151.7) U/ml,术前影像学检查肿瘤直径为(3.0±1.0) cm。术前影像学提示9例(7.5%)病人存在门静脉-肠系膜上静脉侵犯。
二、术中及围术期情况
中位手术时间为300 min,中位出血量为300 ml(表1)。2例(1.7%)病人中转开腹。术后总体并发症发生率为27.5%,其中Clavien-Dindo≥Ⅲ级的并发症发生率为5.0%;围术期其他情况详见表1。18例病人诊断为腹腔感染,其中14例(77.8%)经过保守治疗好转,4例(22.2%)病人接受介入穿刺引流。2例(1.7%)病人因术后出血接受二次手术,其中1例病人因胃十二指肠动脉出血行剖腹止血,另1例病人因胃十二指肠动脉出血行血管造影栓塞止血治疗。术后中位住院时间为18 d,再入院率为3.3%(表1)。
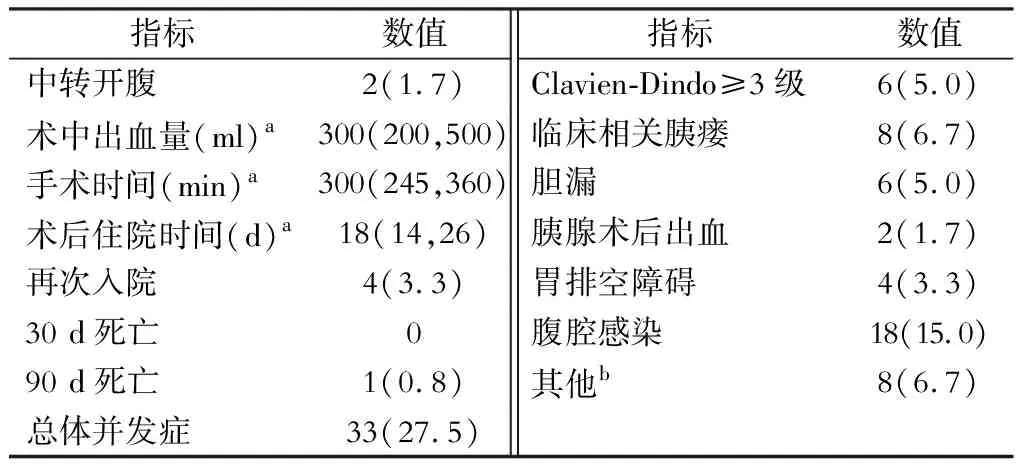
表1 120例胰头导管腺癌病人围手术期情况
注:除标注单位的外,余指标单位均为“例(%)”;a.采用中位数(四分位数间距)表示;b.包括肺部感染、深静脉血栓形成、肝脓肿、乳糜瘘
三、病理资料
83例(69.2%)病人的病理为低分化导管腺癌,107例(89.2%)病人达到R0切除,中位淋巴结清扫数目为11枚,53例(44.2%)存在淋巴结转移;根据AJCC第8版胰腺癌分期标准,63例(52.5%)为T2期,另外67例(55.8%)病人为N0期;详细情况见表2。
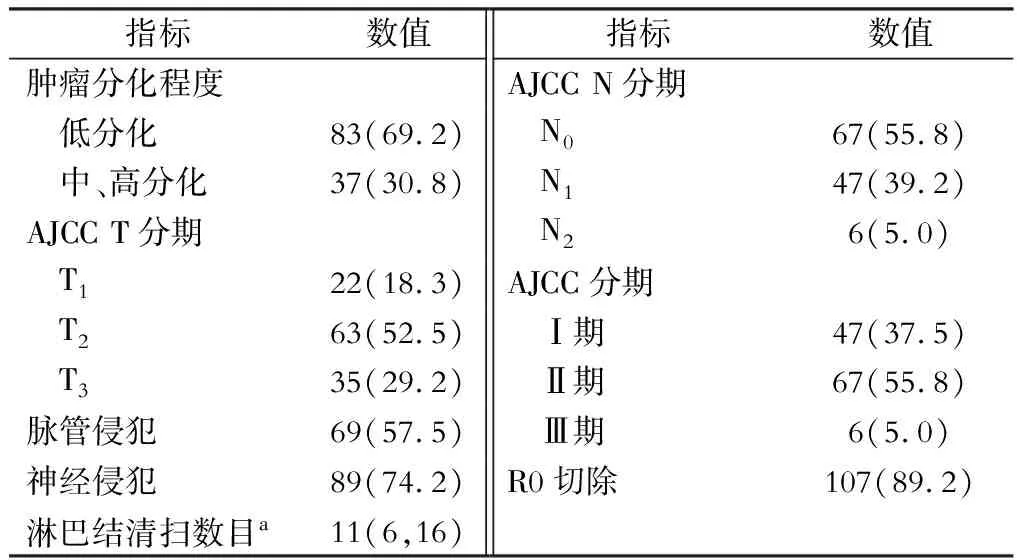
表2 120例胰头导管腺癌病人病理资料[例(%)]
注:a.采用中位数(四分位数间距)表示
四、远期随访
61例(50.8%)病人接受术后辅助化疗,其中67.2%病人接受以吉西他滨为基础的化疗方案,14.7%的病人接受替吉奥口服化疗。术后中位随访时间为24个月,73例(60.8%)病人出现肿瘤复发,其中56例(46.7%)出现远处转移,肝脏为最主要的远处转移部位,29例(24.2%)出现局部复发,包括胰腺局部复发(4例次,3.5%)及区域淋巴结复发(27例次,22.5%)。中位无病生存期为14个月(11~22个月),1年无病生存率为53.9%(95%CI:45.5%,63.8%),3年无病生存率为16.3%(95%CI:4%,41.2%)(图2)。53例(44.2%)病人随访过程中死亡,其中51例(42.5%)为肿瘤相关死亡。中位总体生存期为27个月(19~35个月),1年总体生存率为78.1%(95%CI:70.8%,86.1%),3年总体生存率为24.9%(95%CI:13.4%,46.3%)(图3)。
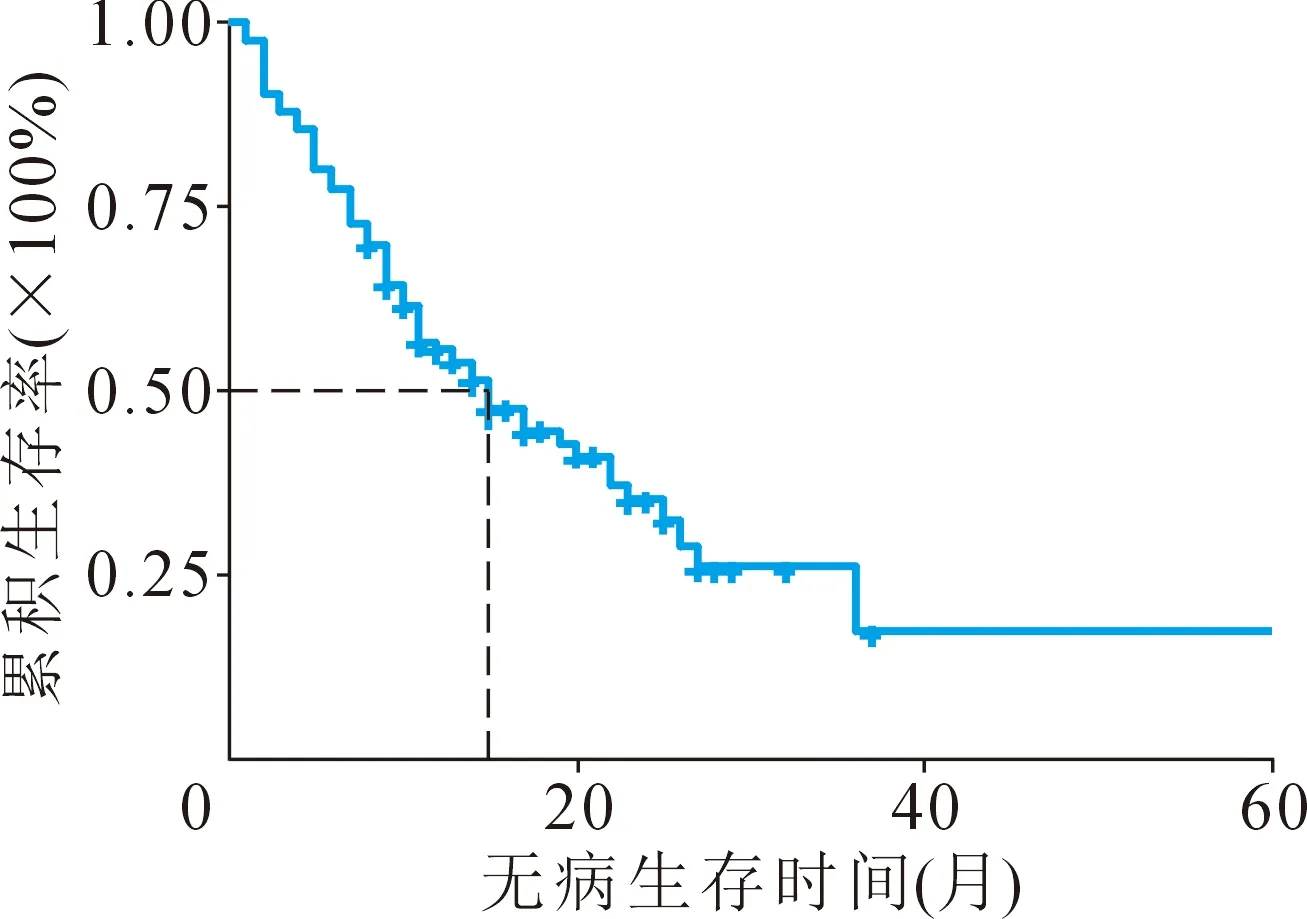
图2 无病生存期生存曲线
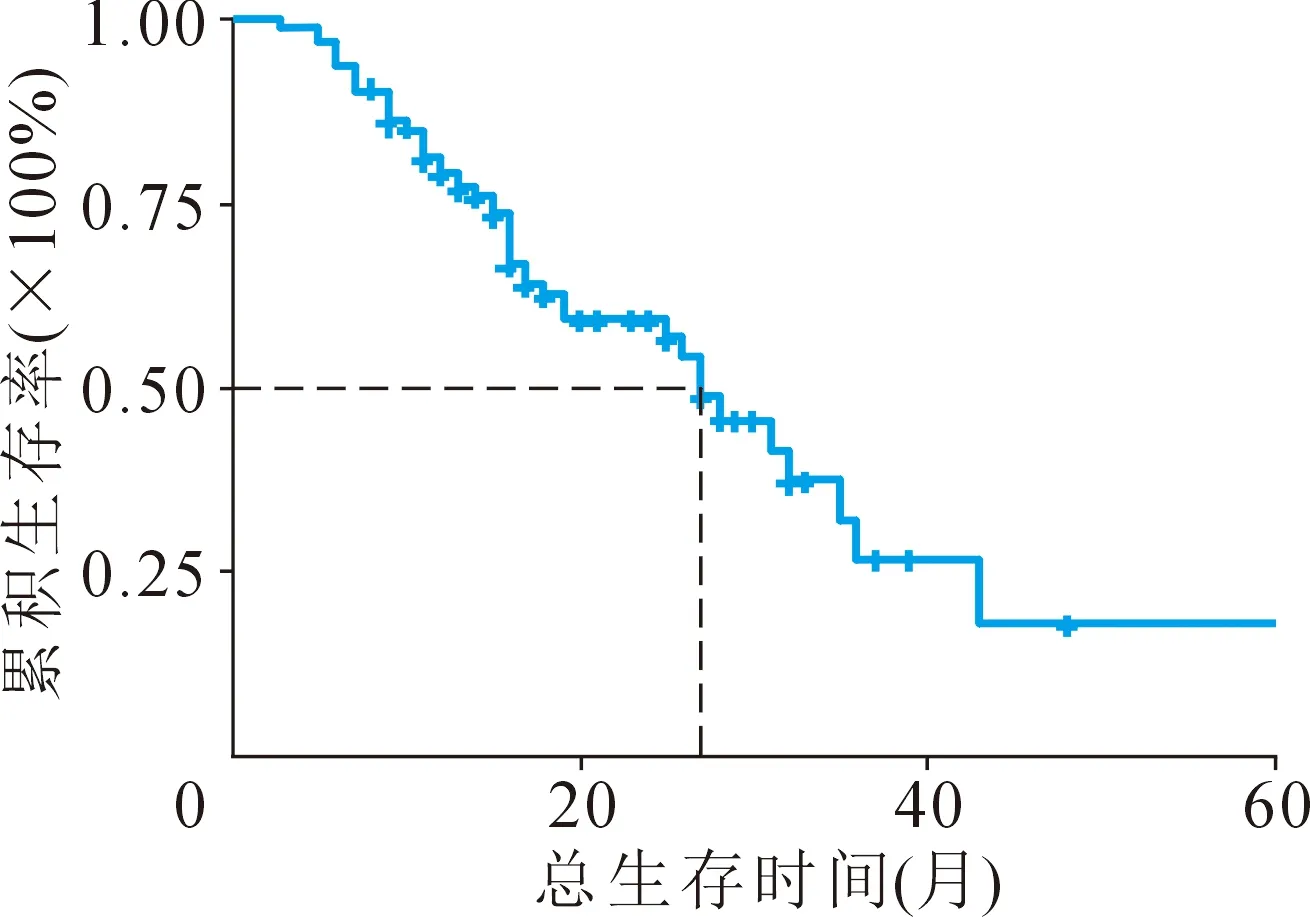
图3 总生存期生存曲线
讨 论
本研究回顾性分析了单中心2012-2017年行RPD的120例胰头导管腺癌病人的临床资料,术后总体并发症发生率为27.5%,严重并发症(Clavien-Dindo分级≥Ⅲ级)为5.0%,无围手术期死亡,中位无病生存期为14个月,中位总体生存期为27个月。本研究结果显示RPD治疗胰头导管腺癌是安全且有效的。
以腹腔镜及机器人手术系统为代表的微创手术是目前外科领域发展的趋势。因胰腺手术的复杂性,微创手术在胰腺外科领域的应用始终存在争议。近年来,越来越多的临床研究进一步证实了机器人胰腺手术的安全性。2013年美国匹兹堡医学中心Zureikat等[6]报道了机器人胰腺手术前瞻性研究结果,其中包括132例RPD,83例机器人胰体尾切除术,13例胰腺中段切除,数据显示30 d死亡率和90 d死亡率分别为0.8%和2.0%,Clavien-Dindo Ⅲ级和Ⅳ级并发症分别为14%和6%,C级胰瘘发生率为4%(参考2006年ISPGF标准),该研究初步证实机器人胰腺手术安全和可行。目前临床研究结果显示,相比于OPD,RPD可降低术中出血量及输血率,但延长手术时间[7-13]。同时RPD可以降低总体术后并发症发生率及切口感染率,促进病人术后早期下床活动并缩短术后住院时间[7-13]。Zureikat等[14]进行的一项纳入多中心大样本的回顾性研究显示,RPD平均延长手术时间75.4 min,平均可减少181 ml的术中出血量并可降低术后严重并发症发生率[OR=0.64;95%CI:(0.47,0.85);P=0.003]。本中心既往的对照研究结果显示,与OPD相比,RPD手术时间延长但可减少术中出血量、加快术后康复,且并不增加术后各项并发症发生率[12]。
胰瘘是胰十二指肠切除术后最常见的并发症,胰腺术后出血、感染等严重并发症与胰瘘密切相关。机器人手术是否可以降低胰瘘发生率目前仍不明确。2017年McMillan等[15]回顾性分析了2 846例胰十二指肠切除术病人资料,1∶1倾向性匹配研究(RPD152例,OPD152例),结果显示与OPD相比,RPD并不能减少临床相关胰瘘(2016年ISGPF标准B级和C级)的发生率(6.6%比11.2%,P=0.23)。而2019年美国匹兹堡医学中心Cai等[16]报道了一项大样本RPD对比OPD的临床研究(RPD460例,OPD405例),结果显示RPD可以降低临床相关胰瘘的发生率[OR=0.239;95%CI:(0.14,0.41);P<0.001],经过倾向性匹配后结果一致。目前临床研究表明胰管直径、胰腺质地、胰腺病理类型等因素与胰瘘发生密切相关,同时胰肠吻合的方式及学习曲线也是影响胰瘘发生率的重要因素,以上因素或许可以解释目前临床研究结果的差异。目前临床研究中可采用临床胰瘘风险评分(FRS)系统来评估胰十二指肠切除术术后胰瘘风险[17],McMillan等[15]的研究中49.3%的RPD病例胰腺直径≥4 mm,53.3%的RPD病例为低危病理类型(胰腺导管腺癌或胰腺炎)且38.2%的病例胰腺质地硬,即在该研究中大部分病人是胰瘘低危组,这也可以解释该研究中极低的临床相关胰瘘率。机器人手术的优势在于高倍视野、灵活性及稳定性所带来的精准操作,而机器人手术是否可以降低高危病人(如胰管直径≤2 mm、良性及交界性肿瘤等)的胰瘘率目前仍不明确,Cai等[16]的研究显示,RPD与OPD比可降低胰瘘中危组(FRS 3~6分)的胰瘘发生率(7.1%比15.2%,P=0.008),在高危病人(FRS 7~10分)RPD也可降低临床相关胰瘘发生率,尽管未达到统计学差异(P=0.198)。未来仍需要更多的前瞻性临床对照研究探究RPD在降低临床胰瘘方面的优势。
多项回顾性研究显示相比于OPD,RPD可减少切缘阳性率[18]。但是因上述研究都为回顾性研究故可能存在选择偏倚,所以目前RPD是否可以降低切缘阳性率仍有争议。本中心的回顾性研究显示,RPD与OPD相比,R0切除率(94.7%比92.1%)差异无统计学意义,同时RPD与OPD在清扫淋巴结数目及阳性淋巴结数目方面差异也无统计学意义[12]。远期随访结果显示RPD与OPD比较,中位总体生存期(23.0个月比22.0个月,P=0.748)及中位无病生存期(14.0个月比13.0个月,P=0.364)差异无统计学意义[12]。Cai等[16]进行的多中心回顾性研究显示RPD并不增加胰腺癌手术的切缘阳性率[OR=1.33;95%CI:(0.88,2.00);P=0.17];淋巴结清扫达标率(清扫淋巴结数目≥12枚)两者差异也无统计学意义[OR=1.61;95%CI:(0.29,9.09);P=0.59]。2019年Shyr等[19]报道了43例联合肠系膜上静脉-门静脉(SMV-PV)切除重建的胰十二指肠切除术病例,其中11例(25.6%)为机器人完成。RPD联合SMV-PV切除重建与传统开放手术相比术中失血量、R0切除率、淋巴结清扫数目及各类术后并发症发生率方面差异均无统计学意义,其1年总体生存率为92.6%,3年总体生存率为26.5%。Ocuin等[20]曾报道了11例机器人联合腹腔干切除的胰体尾癌根治术(RDP-CAR),与传统开腹手术比较不增加手术相关并发症及死亡率,R0切除率差异无统计学意义(RDP-CAR 82%,ODP-CAR 79%),中位生存期两者差异也无统计学意义(RDP-CAR 33个月比ODP-CAR 40个月,P=0.310)。虽然目前回顾性研究结果显示RPD治疗胰头癌效果与OPD并无差异,但仍缺乏大样本前瞻性临床对照研究。
本研究为单中心较大样本的回顾性研究,是RPD治疗胰头导管腺癌的初步探索。本研究结果显示RPD治疗胰头导管腺癌是安全有效的。未来仍需多中心合作进行前瞻性对照研究进一步验证RPD治疗胰头导管腺癌的价值及优势。

