铬离子对高温高浓度硝酸铵水溶液热稳定性的影响
王锡东,刘 锋,魏 国
铬离子对高温高浓度硝酸铵水溶液热稳定性的影响
王锡东,刘 锋,魏 国
(安徽理工大学化学工程学院,安徽 淮南,232001)
为研究铬离子对硝酸铵(NH4NO3)的危险性,利用C80微量热量仪模拟密闭环境,对含有0.1%、1%、2%、3% 4种不同Cr(NO3)3杂质含量的95%NH4NO3溶液进行热分析。结果表明:硝酸铬对硝酸铵晶变温度影响较小,但是会使混合体系起始反应温度向前推移,溶液放热量提高,表观活化能降低。95%NH4NO3溶液的起始反应温度为295.5℃,当混合体系中Cr(NO3)3含量为1%时起始反应温度为234.5℃,下降了61.0℃,Cr3+对NH4NO3的热分解有催化作用。
硝酸铵水溶液;C80微量热仪;硝酸铬;热稳定性
高温高浓度NH4NO3溶液广泛应用于乳化炸药的生产中,过饱和NH4NO3溶液储存温度为120~140℃,溶液呈酸性,其在高温下可以自发反应,混入其他杂质后其物理化学性质和热力学性质会发生改变,影响到高温高浓度NH4NO3溶液的安全使用,为此,国内外的多位学者开展了相关研究。侯秀婷[1]做了关于氯离子和pH值对NH4NO3溶液热稳定性影响的研究,得出酸性条件下,随着氯离子的增加NH4NO3溶液热稳定性下降,临界爆炸温度降低。白燕[2]的研究得出浓度为80%NH4NO3溶液具有同样的热爆炸危险性。赵省向、张亦安[3-4]等人的研究表明当温度高于175℃,压缩机油、氯离子、酸可以促进NH4NO3的热分解,当温度低于140℃时,控制氯化物混入NH4NO3溶液中是极其重要的。胡洋勇、康磊[5-6]等分别研究了铁离子和乙酸对高温高浓度NH4NO3溶液的影响,实验表明铁离子和乙酸对NH4NO3水溶液的分解有促进作用。孙金华[7]等使用C80微量热仪研究NH4NO3盐酸混合物热流曲线,计算混合体系热力学参数,并利用Semenov模型[8]求解其自加速分解温度(SADT)。
研究高温高浓度NH4NO3溶液热稳定性,尤其是杂质对其热分解的影响对安全生产工业炸药有重要的现实意义。高温高浓度NH4NO3溶液在运输以及炸药制备过程中容易与不锈钢容器和设备发生接触,在酸性条件下高温高压NH4NO3溶液与不锈钢制品容易发生氧化还原反应,铁离子与铬离子极易混入NH4NO3溶液中,因此,研究铁离子与铬离子对过饱和高温高浓度NH4NO3溶液热稳定性影响,对工业炸药的安全生产十分重要。胡洋勇[5]等研究表明铁离子对高温高浓度NH4NO3溶液的分解有促进作用,为此,本研究利用C80微量热仪,在高压池模拟储存运输中的高温密闭环境,对Cr(NO3)3、过饱和NH4NO3溶液混合体系状态下的热分解进行了研究,得到了体系的热分解参数以及Cr(NO3)3对过饱和NH4NO3溶液的热分解作用,为工业炸药安全生产提供了依据。
1 实验
1.1 实验试剂与仪器
NH4NO3,化学纯,分子量80.04,含量不少于99.5%,河南永昌硝基肥有限公司。Cr(NO3)3•9H2O,分析纯,分子量400.15,含量不少于99%,上海阿拉丁生化科技股份有限公司。
本文测试仪器选择法国SETARAM公司生产的CALVET式C-80微量量热仪,C80测试系统由C80量热器、CS32控制器、稳压电源及计算机4部分构成,如图1所示,该仪器利用差热测量法直接测量样品的吸、放热情况,输出数据为样品发生物理化学变化时的热流。
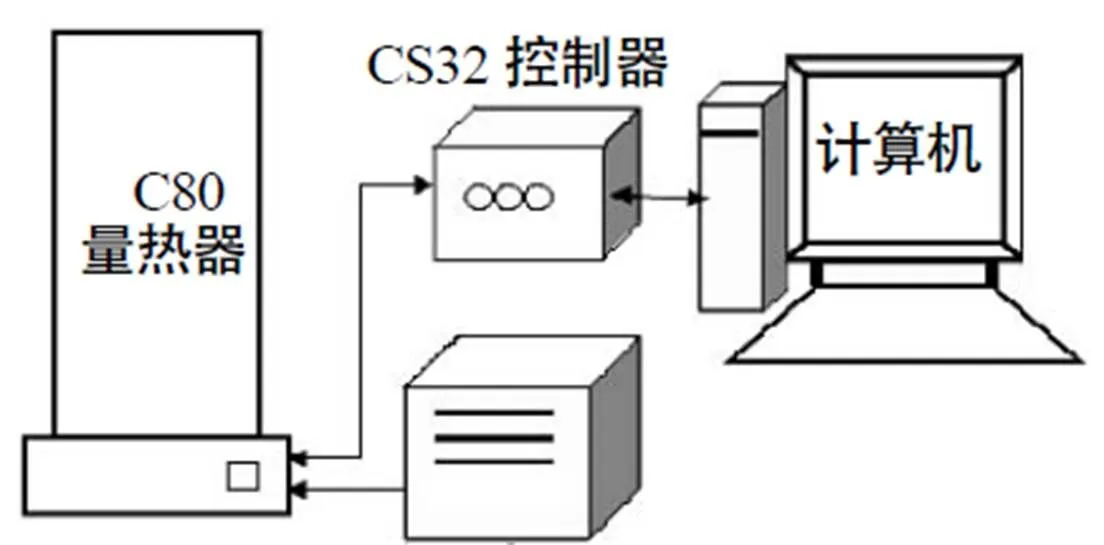
图1 C-80仪示意图
其主要技术指标为:测量温度为25~300℃,升温速度为0.01~2.00 ℃/min,分辨率为0.1mW,感度极限为1μW,样品质量:0~10g。
1.2 实验方法
配置95%NH4NO3溶液,加热溶化后搅拌加入质量比为0.1%、1%、2%、3%、4%的Cr(NO3)3固体,充分搅拌使体系充分混合,冷却结晶,研磨粉碎。取样分析:各样品分别取100mg加入C80高压反应池中进行热分解测试。测试条件:实验样品恒温25℃,时长3 600s;后由25℃升温至300℃,升温速率1K/min;达到300℃后开始降温,降温速率2 K/min。
2 实验结果与分析
图2为不同含量Cr(NO3)3混合样品的热流曲线。图3为不同含量Cr(NO3)3混合样品的热流——时间曲线。由图2~3可以看出混合样品分别在68.5℃、106.4℃、145.5℃、183.5℃时有4个吸热的晶型转变峰,其中145.5℃与183.5℃时吸热较为明显。升温前期(150℃前)5组样品热流曲线变化不大,即在低温状态下Cr(NO3)3对NH4NO3晶型转变影响较小,但150℃以后对NH4NO3的影响效果开始体现,尤其是含3% Cr(NO3)3的样品晶型转变Ⅱ→Ⅰ的吸热峰温度降低了15℃,表明Cr(NO3)3的加入在高温下对NH4NO3的晶型转变有影响。放热阶段加入Cr(NO3)3的样品放热峰提前较为明显,放热峰高度变高,半峰宽变窄,并且随着Cr(NO3)3的增加,放热峰提前越明显,表明Cr(NO3)3的加入对NH4NO3的分解有促进作用。
根据化学反应理论和阿伦尼乌斯定律[7],可以得到 与 的关系式:
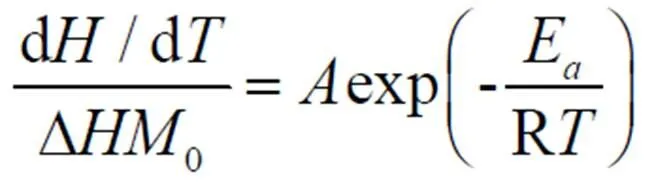
两边取对数得:
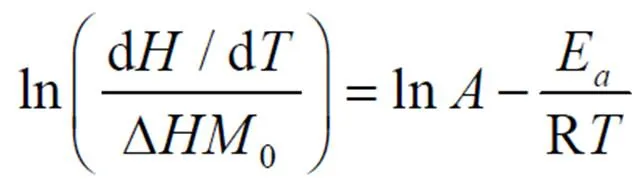
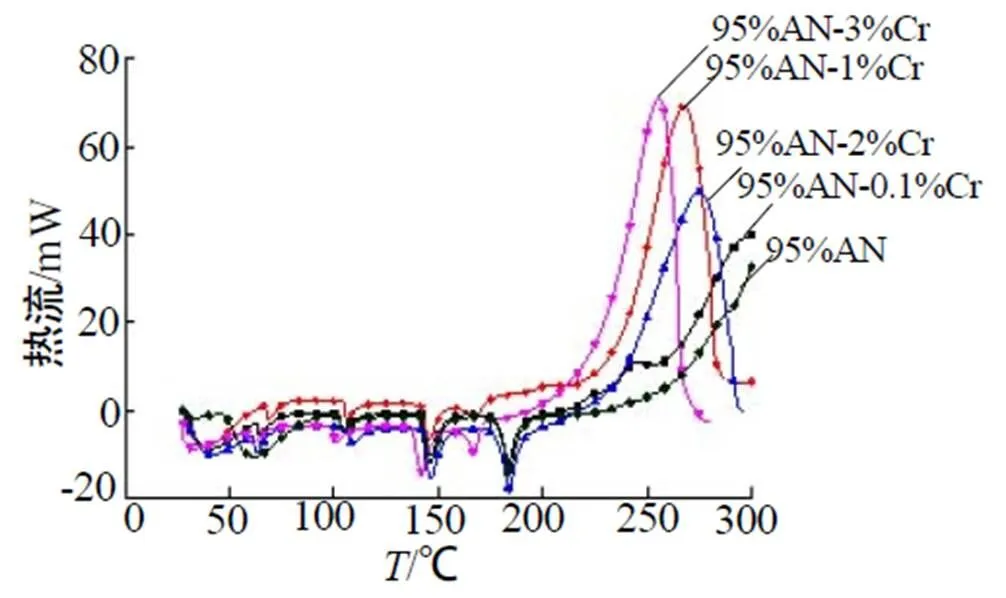
图2 不同含量Cr(NO3)3混合样品热流曲线
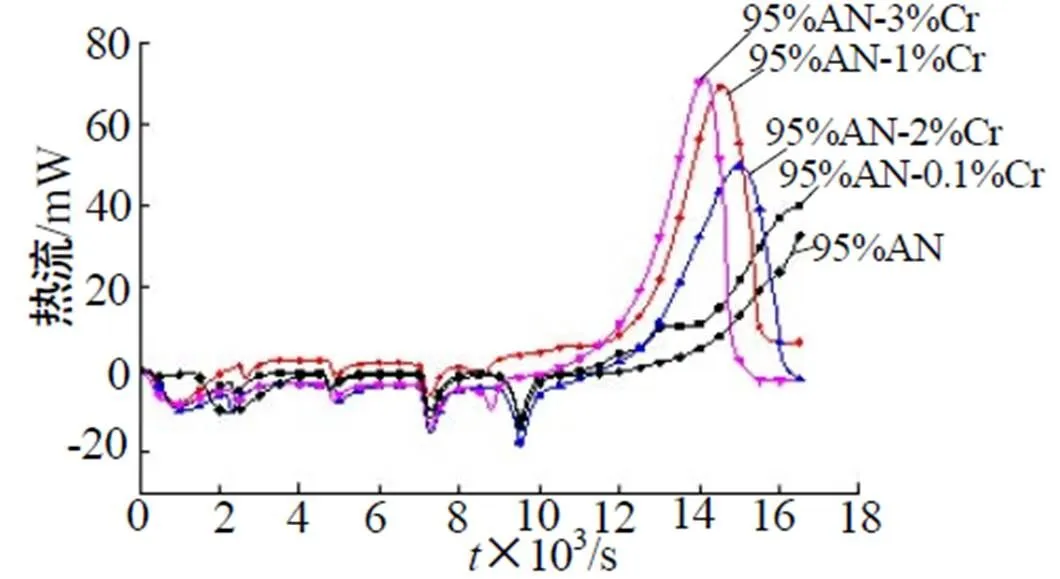
图3 不同含量Cr(NO3)3混合样品热流——时间曲线
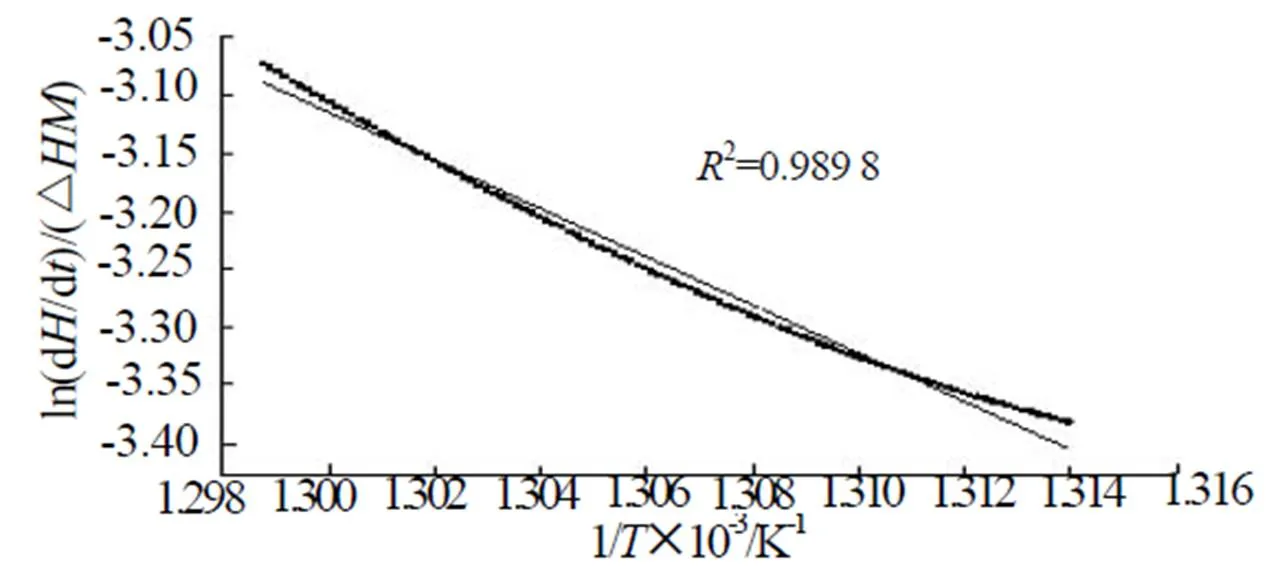
图4 1%Cr(NO3)3的ln[(dH/dt)/(ΔHM)]与1/T的关系曲线
表1 不同含量Cr(NO3)3混合样品热力学参数
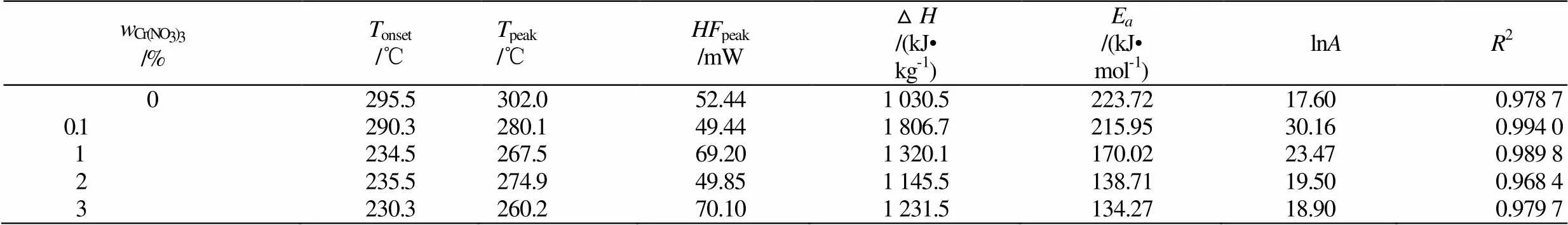
Tab.1 Thermodynamic parameters mixed sample with different content of Cr(NO3)3
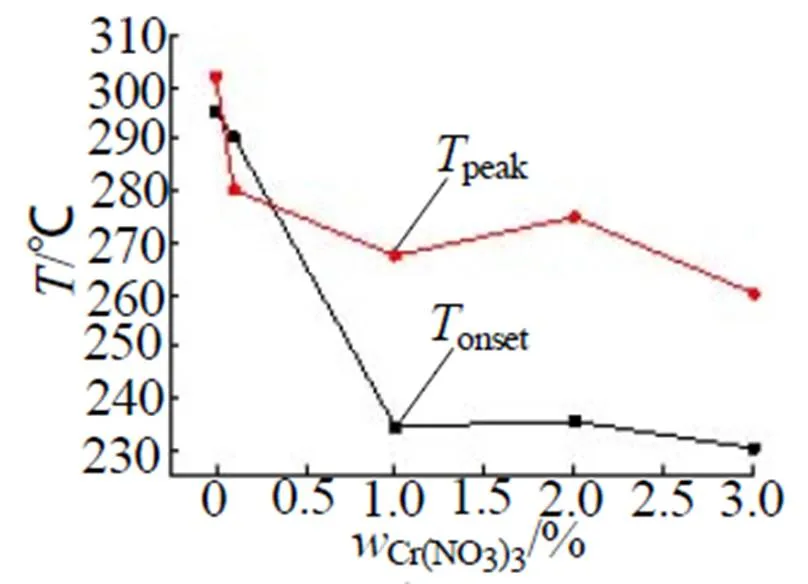
图5 Cr(NO3)3含量与Tonset、Tpeak的关系
由表1可以看出Cr(NO3)3的加入使样品体系的自反应起始温度发生变化,95%NH4NO3溶液自反应起始温度为295.5℃,加入1% Cr(NO3)3后降低为234.5℃,温度下降了61℃,随着Cr(NO3)3的增加,自反应的起始温度变化不明显。并且,Cr(NO3)3的加入使样品体系的反应峰值温度发生变化,95%NH4NO3溶液反应峰值温度大于300℃,加入0.1% Cr(NO3)3后反应峰值温度为280.1℃,随着Cr(NO3)3的增加,反应峰值温度呈下降趋势,如图5所示。
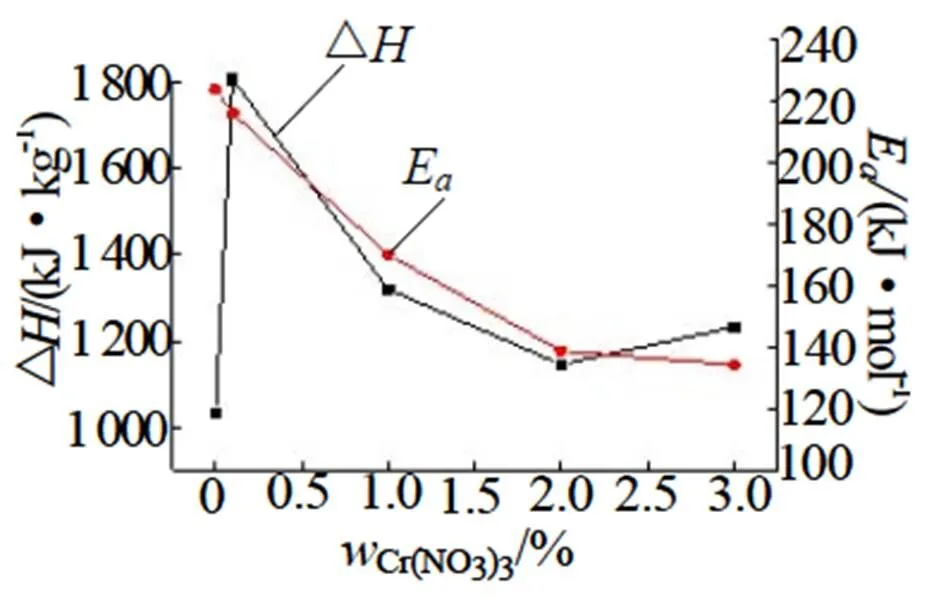
图6 Cr(NO3)3含量与△H、Ea的关系
由表1可见,95%NH4NO3溶液活化能为223.72 kJ•mol-1,随着Cr(NO3)3的增加,样品体系的活化能总体下降,当Cr(NO3)3含量增加至2%时,活化能下降不明显。Cr(NO3)3使得整个体系的活化能下降,当Cr(NO3)3的含量增加至3%时,体系活化能下降了89.45 kJ• mol-1,NH4NO3溶液体系反应变得容易,体系反应速率加快。由表1也可以看出加入Cr(NO3)3后体系的△明显变大,95%NH4NO3溶液的△为1 030.5 kJ•kg-1,加入0.1%Cr(NO3)3后体系△为1 806.7 kJ•kg-1,体系△增加了776.2 kJ•kg-1,表明Cr(NO3)3的加入对NH4NO3溶液的分解有促进作用。但随着Cr(NO3)3的增加体系的△下降,可见Cr(NO3)3在一定程度内可以减少体系的放热量,如图6所示。从化学反应方面对热分解机理可以有如下解释:Cr(NO3)3极易溶于水,在一定条件下对整个混合体系的NO2+形成有非常大的影响。在高温条件(>120℃)下整个体系会呈现溶液状态,体系中的NH4NO3会电离生成NH4+和NO3-离子,而Cr3+在3d轨道上有空轨道,所以Cr(NO3)3是一种形成络合物Cr[(NO3)6]3-的路易酸,主要的络合反应为反应式(6),Cr3+与NO3-的络合反应加速了NH4NO3的电离分解。
NH4NO3→NH4++NO3-(3)
Cr(NO3)3+NO3-→Cr[(NO3)4]-(4)
Cr[(NO3)4]-+NO3-→Cr[(NO3)5]2-(5)
Cr[(NO3)5]2-+ NO3-→Cr[(NO3)6]3-(6)
在高温条件下,NH4NO3的初级热分解反应形成HNO3和NH3。HNO3是强氧化性的物质,可将NH4+氧化生成NO2+离子,NO2+离子极易与NH3反应生成氮氧化物。
NH4NO3→NH3+HNO3(7)
HNO3+NH4+→NO2++H2O (8)
NH3+ NO2+→N2O+H++H2O (9)
综上所述,Cr(NO3)3可通过形成络合物加速NH4NO3的热分解,降低NH4NO3的热稳定性,随着Cr(NO3)3含量的增加,Cr(NO3)3对NH4NO3溶液催化的能力加强,NH4NO3溶液热稳定性下降,onset明显下降,Cr(NO3)3含量高于2%时,催化能力下降。Cr3+对于NH4NO3溶液是一种具有催化作用的物质,可加速NH4NO3溶液的分解,破坏系统的稳定性,故在使用不锈钢容器生产、储存和运输高温高浓度NH4NO3溶液时,应控制溶液温度和酸性,减少容器腐蚀程度。
3 结论
(1)在低温状态下加入Cr(NO3)3的NH4NO3溶液的热流曲线与不添加Cr(NO3)3的NH4NO3溶液的热流曲线基本重合,但150℃以后对NH4NO3的影响效果开始体现,3% Cr(NO3)3的样品晶型转变Ⅱ→Ⅰ的吸热峰温度降低了15℃,高温(>150℃)时Cr(NO3)3对NH4NO3的晶形转变影响较大。
(2)95%NH4NO3溶液自反应起始温度为295.5℃,加入1% Cr(NO3)3后降低为234.5℃,温度下降了61℃,但随着Cr(NO3)3的增加,自反应的起始温变化不明显。加入Cr(NO3)3后混合体系△明显提高,但随着Cr(NO3)3的加入混合的△呈下降趋,表明Cr3+对NH4NO3溶液的热分解有催化作用。
(3)使用不锈钢容器或管道储存和运输高温高浓度NH4NO3溶液时,应及时检查溶液温度和不锈钢设备的腐蚀情况,应实时控制NH4NO3溶液中Cr3+的浓度,避免因杂质离子过多导致NH4NO3溶液体系热稳定性下降而发生危害。
[1] 侯秀婷,曹雄.氯离子和pH值对硝酸铵水溶液热稳定性的影响研究[J].安全与环境学报,2010,10(2):193-196.
[2] 白燕.硝酸铵水溶液热稳定性研究[J].工业安全与环保,2009,35(8):4-6.
[3] 张为鹏,赵省向,张亦安.杂质对硝酸铵溶液热分解特性的影响[J].化肥工业,2001,28(4):12-14,45.
[4] 张为鹏,赵省向,张亦安.硝酸铵溶液的氯催化分解[J].火炸药学报,2004,27(1):33-35.
[5] 颜事龙,胡洋勇,刘锋,等.硝酸铁对高温高浓度硝酸铵水溶液热稳定性的影响[J].含能材料,2015,23(5):459-463.
[6] 康磊,颜事龙,刘锋.乙酸对硝酸铵溶液热安定性影响的研究[J].火工品,2015(4):50-52.
[7] 孙金华,陆守香,孙占辉.自反应性化学物质的热危险性评价方法[J].中国安全科学学报,2003,13(4):44-47.
[8] 孙金华,丁辉.化学物质热危险性评价[M].北京:科学出版社,2005.
Effect of Chromium Ion on Thermal Stability of Ammonium Nitrate Solution with High Temperature and High Concentration
WANG Xi-dong,LIU Feng,WEI Guo
(College of Chemical Engineering, Anhui University of Science and Technology, Huainan, 232001)
To explore the dangerous of chromium ions effecting on the thermal stability of NH4NO3,thermal analysis for 95% NH4NO3solution with different content of Cr(NO3)3(0.1%,1%,2%,3%) were studied by C80 micro thermal instrument in close environment . The results show that Cr(NO3)3has little effect on the crystal temperature of NH4NO3, but it can make the onset temperature of the mixed system moved forward and activation energy lowered, as well as the released heat enhanced. The onset temperature of 95% NH4NO3solution is 295.5 °C, when the Cr(NO3)3content in the mixed system is 1%,its onset temperature is 234.5℃, which is decreased by 61.0℃, the study shows chromium ions has a catalytic influence on the thermal decomposition of NH4NO3.
Ammonium nitrate solution; C80 micro thermal instrument;Chromium nitrate;Thermal stability
TQ564.4
A
10.3969/j.issn.1003-1480.2019.04.012
1003-1480(2019)04-0048-04
2019-07-04
王锡东(1996-),男,在读硕士研究生,主要从事爆炸理论及其应用研究。
工业信息化部委托项目。

