延迟投喂对许氏平鲉消化酶发育的影响
席丹 张保仁

摘要:为查明许氏平鲉(Sebastesschlegelii)仔、稚鱼消化酶活性随日龄的变化过程,探讨消化酶的发育特性与饥饿的影响,以其初产仔鱼为研究对象,设置6个实验组,分别在1、2、3、4、5d时开始初次投喂(即C、D1、D2、D3和D4组)和完全不投喂(S组)。结果显示,仔鱼前期的许氏平鲉消化酶的比活力波动较大,进入仔鱼后期(22d后),消化酶比活力逐渐稳定;而总活力在仔、稚鱼阶段均不高,变化不显著,进入稚鱼后期后(26d后)随日龄显著升高;存活的各实验组仔、稚鱼消化酶活力在相同日龄时差异并不显著,但由于前期的饥饿,实验结束时D2、D3组仔稚鱼的全长、体重和特定生长率均显著低于C、D1组。结果表明,延迟投喂时间对许氏平鲉的生长发育有显著影响,而且这种影响在生长后期很难恢复。
关键词:许氏平鲉(Sebastesschlegelii);延迟投喂;饥饿;消化酶;生长发育
中图法分类号:S917.4
文献标志码:A
自然环境中,因食物会受环境条件变动的剧烈影响,而在空间和时间上分布极不均匀,很多鱼类的野生种群都会遭受饥饿的胁迫[1]。尤其是在鱼类生活史早期阶段,饥饿是导致鱼类死亡的主要原因之一[2-3]。仔、稚鱼期的个体小而脆弱、发育不完全,对饥饿最为敏感[4]。因此,饥饿胁迫对仔鱼生长存活过程的影响已成为近年来的研究热点[5-12]。
鱼类仔鱼阶段要经历从内源性营养向外源性营养的转变,而仔鱼的初次摄食是其开始外源性营养的重要标志,对仔鱼后期的存活和生长发育也有重要影响[13]。初次摄食期间遭受到饥饿的胁迫可能对仔、稚鱼阶段营养生理的变化过程有重要影响,而消化酶的发育变化是其中的重要内容之一[12,14-15]。通过研究延迟投喂对仔、稚鱼消化酶的发育影响可以更好地帮助阐明其不同发育阶段的摄食、消化和吸收机制,为优化海水鱼类早期饵料的配方以及制定科学的投喂策略提供生理学基础。
许氏平鲉(Sebastesschlegelii),俗称黑鲪、黑鱼、黑石鲈等,隶属于硬骨鱼纲(Osteichthyes)、鲉形目(Scorpaeniformes)、平鲉科(Sebastidae)、平鲉属(Sebastes),是一种卵胎生的岩礁性鱼类,主要分布于西北太平洋近岸海域,是我国黄渤海区常见的底层经济鱼类之一[16]。近年来,随着过度捕捞与环境恶化,许氏平鲉的自然资源量不断下降,使其成为增殖放流与人工培育的重要鱼种[17-18]。据统计,近年来仅山东省烟台市沿海区域每年放流数量就超过150万尾[19-20]。仅2015年,我国就在渤海、黄海沿岸计划放流3000万尾的许氏平鲉幼鱼,用以提高其生物资源量和渔民收入(数据来源于中华人民共和国农业部《全国水生生物增殖放流总体规划(2011-2015)》)。
目前国内外针对许氏平鲉的研究主要包括生理生态学、组织学、形态学、行为学以及生物化学等方面[21-27]。然而,关于延迟投喂对许氏平鲉仔、稚鱼消化酶发育变化的影响却未见报道。本实验通过对不同日龄的许氏平鲉仔鱼进行初次投喂,观察其消化酶活性随日龄的变化过程,探讨消化酶的发育特性与饥饿的影响,以期为其苗种培育过程中饵料配方的优化与投喂策略的改进提供理论帮助。
1材料与方法
1.1实验鱼
实验于2018年5月~7月在恒海生物科技有限公司进行,以许氏平鲉初产仔鱼为实验对象。仔鱼产出后在车间育苗池(5m×5m×0.6m)中用地下卤水与淡水配制的海水进行流水培育。实验期间日常监测养殖条件,其中水温15.3~19.8℃,盐度26‰~31‰,pH7.7~8.3,溶解氧5.0mg/L以上,日换水量约50%,光照强度为400~600lx。对于正常投喂的实验组:1~7d(日龄)仔鱼投喂轮虫幼体,7~10d投喂轮虫幼体与卤虫无节幼体,10~15d仔鱼投喂卤虫无节幼体,15~25d投喂卤虫无节幼体与人工颗粒饲料(鱼宝、彩优等品牌),25d后仅投喂人工颗粒饲料,每日投喂3~5次。其它实验组按处理要求进行投喂。
1.2分组与取样
本实验分为6个组别,即正常投喂组(对照组,C组),延迟1d、2d、3d、4d投喂组(D1组、D2组、D3组、D4组)和完全饥饿组(S组)。每组取约5000尾初产仔鱼,放入实验水槽中(40cm×50cm×60cm,海水约120L,仔鱼密度为41.67ind/L),养殖49d。每个组别设置5个平行,其中3个平行用于观察仔鱼存活率的变化,2个平行用于取样。
针对不同日龄的仔鱼,取样间隔有所差别:1~10d的仔鱼,每日取样;12d后的个体,每3~5日取样,样品用纱布吸干水分后冷冻保存,每组每次用3个2.0mL的冻存管存放于液氮罐中保存,带回实验室后测量全长(TL)、体重(BW)与脂肪酶、淀粉酶和胰蛋白酶活性。整个实验期间,仔鱼个体较小,无法单独取其消化道进行酶活指标测量,因此将多尾仔鱼一起称量后整体进行匀浆测量。
1.3数据测量、统计与分析
1.3.1生长存活指标样品解凍后根据仔鱼大小分别用拍照解剖镜(NikonSMZ800)和游标卡尺(精度0.1mm)测量全长。用精密天平(精度0.0001g)测量仔鱼体重。此外,统计存活率(SR)和特定生长率(SGR)的变化。SGR的计算方法:
式中:Lt分别是试验开始时和试验结束时实验鱼的全长,t是试验天数。
1.3.2消化酶活性指标各实验组的样品在称量后放入5mL的离心管。根据样品重量,按1∶9加入生理盐水,用匀浆机进行组织匀浆。随后在4℃,10000r/min的条件下离心20min,取上清液(酶液)放入4℃冰箱内冷藏,24h内完成3种消化酶(脂肪酶、淀粉酶和胰蛋白酶)活性的测量。测量时各实验组的样品设置3个平行,具体测量方法如下。
脂肪酶活力的测定:利用脂肪酶测定试剂盒(购买于南京建成生物工程研究所)进行测定,具体操作参照试剂盒说明书。脂肪酶(比)活力的定义为:37℃下,1g组织蛋白中的脂肪酶与底物反应1min,每消耗1μmol底物为一个酶活力单位。
淀粉酶活力的测定:利用淀粉酶测定试剂盒(购买于南京建成生物工程研究所)进行测定,具体操作参照试剂盒说明书。淀粉酶(比)活力的定义为:37℃下,1mg组织蛋白中的淀粉酶与底物反应30min,水解10mg淀粉为一个酶活力单位。
胰蛋白酶活力的测定:利用胰蛋白酶测定试剂盒(购买于南京建成生物工程研究所)进行测定,具体操作参照试剂盒说明书。胰蛋白酶(比)活力的定义为:在pH8.0,37℃下,1mg组织蛋白中的胰蛋白酶1min分解酪蛋白生成1μg酪氨酸為一个酶活力单位。
1.3.3数据分析实验测量数据用MicrosoftExcel2019和IBMStatisticSPSS22.0进行统计分析。其中,各组均值的比较采用单因素方差分析(ANOVA),P<0.05表示差异显著。
2结果与分析
2.1生长存活指标
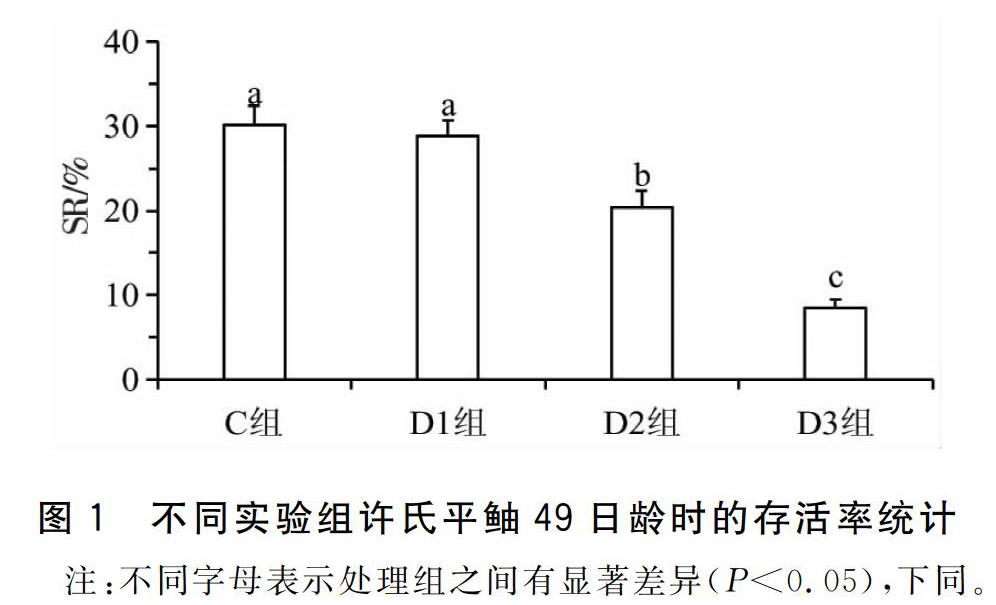
2.1.1存活率的变化经过49d的养殖,C组和D1组的许氏平鲉平均存活率无显著差异(P>0.05),分别是30.6%±2.3%和28.5%±1.7%;D2组与D3组的仔、稚鱼存活率显著低于前两组(P<0.05),分别为19.2%±2.0%和8.8%±1.1%;D4组与S组仔鱼在7d时全部死亡,见图1。
2.1.2全长与特定生长率的变化7d时,C组的仔鱼全长TL=6.25mm±0.16mm,前7d的SGR=2.16%±0.20%,这两个指标与D1组的仔鱼无显著差异(P>0.05);D2组(TL=6.03mm±0.11mm,SGR=1.78%±0.19%)与D3组(TL=5.71mm±0.12mm,SGR=1.36%±0.18%)仔鱼的全长和SGR都显著低于前两组(P<0.05);D4组(TL=5.19mm±0.13mm,SGR=-1.58%±0.13%)与S组(TL=5.14mm±0.15mm,SGR=-1.77%±0.13%)仔鱼均出现了显著的负生长现象,并在7d时全部死亡。49d时,C组(TL=30.67mm±2.15mm,SGR=3.55%±0.22%)与D1组(TL=29.17mm±1.97mm,SGR=3.52%±0.24%)的全长和SGR无显著差异(P>0.05);D2组(TL=26.78mm±1.87mm,SGR=3.21%±0.16%)与D3组(TL=25.67mm±1.75mm,SGR=2.91%±0.19%)的全长与SGR均显著低于前两组,二者之间也有显著差异(P<0.05)。具体见图2。
2.2消化酶活力指标
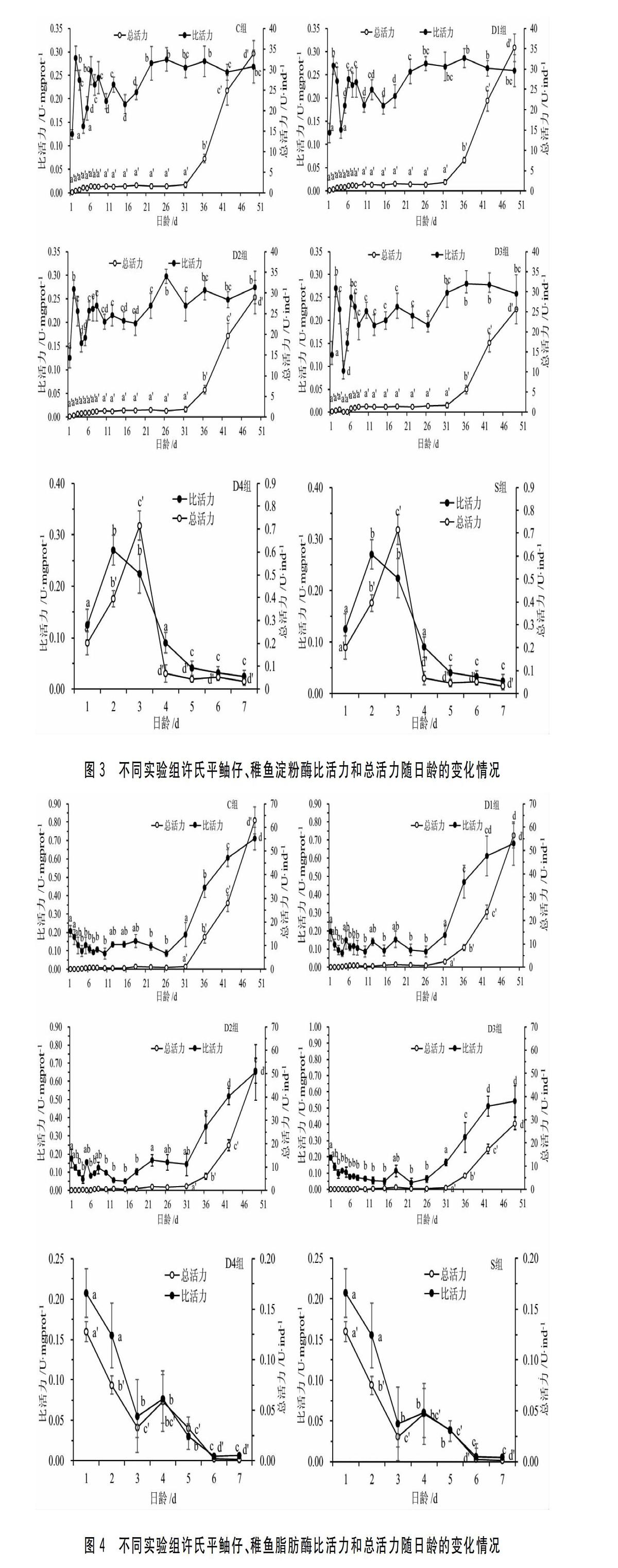
许氏平鲉仔鱼和稚鱼早期阶段3种消化酶的总活力均较低,而开始进入稚鱼期后,消化酶的总活力显著升高。而消化酶的比活力在仔鱼阶段,尤其是前7d波动较大,7d后比活力变化不显著。具体结果如下。2.2.1淀粉酶的变化C组的初产仔鱼(1d)的淀粉酶比活力为0.125±0.010U/mgprot,随后显著波动,22d后相对稳定;总活力在31d前均处于较低状态,无显著差异(P>0.05),而31d后显著升高,49d时约为33.87U/尾。D1组、D2组、D3组仔、稚鱼淀粉酶比活力与总活力的变化趋势与之相似。D4组和S组仔鱼的淀粉酶活力变化趋势一致,比活力和总活力刚开始随日龄显著升高(P<0.05),分别在2d和3d时达到最高值,随后显著下降(P<0.05),并且在7d时仔鱼完全死亡。具体趋势见图3。
2.2.2脂肪酶的变化C组的初产仔鱼(1d)的脂肪酶比活力为0.207U±0.030U/mgprot,随后逐渐下降至稳定状态,26d后逐渐升高;总活力在31d前均处于较低状态,几乎检测不到,而31d后显著升高(P<0.05),49d时约为25.64U/尾。D1组、D2组、D3组仔、稚鱼脂肪酶比活力与总活力的变化趋势与之相似。D4组和S组仔鱼的脂肪酶活力变化趋势一致,比活力和总活力在产出后随日龄逐渐下降,7d死亡时酶活力已检测不到。具体趋势见图4。
2.2.3胰蛋白酶的变化C组的初产仔鱼(1d)的胰蛋白酶比活力非常低,为0.022U±0.003U/mgprot,随后逐渐升高,8d后酶活力变得相对稳定,约为0.150U/mgprot左右;总活力在31d前均处于较低状态,无显著差异(P>0.05),而31d后显著升高,49d时约为33.88U/尾。D1组、D2组、D3组仔、稚鱼胰蛋白酶比活力与总活力的变化趋势与之相似。D4组和S组仔鱼的淀粉酶活力变化趋势一致,比活力和总活力刚开始随日龄显著升高,在3d时达到最高值,随后显著下降(P<0.05),并且在7d时仔鱼完全死亡。具体趋势见图5。
3讨论与结论
鱼类受精卵孵化出膜后即进入仔鱼期,此时仔鱼的口和肛门并没有与外界连通,消化器官的发育也并不完全,不能建立外源性营养,仍依靠卵黄囊提供生长发育所需的能量[9]。鱼类从开口到完全建立外源性营养的过渡期(从初次开口摄食到卵黄囊消失)是仔鱼可能大量死亡的临界期[8,24,28]。有研究表明,正常投喂的许氏平鲉仔鱼临界期内死亡率可达到30%,若该时间内发生饥饿,死亡率会显著增加[27]。而本研究中,也出现了类似的结果,延迟投喂的D2组仔稚鱼的存活率要显著低于对照组与D1组(图1)。
一般情况下,仔鱼还未开口时体内消化酶就已存在,但活性较低,开口摄食后其活性会显著提高[29-31],例如,鮸(Miichthysmiiuy)[12]与河鲈(Percafluviatilis)[32]的初孵仔鱼体内胰蛋白酶和淀粉酶就已能检测到,而开口摄食前这2种酶的活性显著增强;六丝多指马鲅(Polydactylussexfilis)虽然在初孵时不能检测到淀粉酶活性,但在开口摄食前也能检测到[33]。因此,在开口摄食之前,仔鱼已经从生理上作好了接受外源食物的准备[12]。本研究中,许氏平鲉仔鱼在产出后即可检测到胰蛋白酶和淀粉酶的活性,而且在开口摄食时比产出时酶活性显著提高,甚至在没有食物刺激的条件下,其活性也显著增加(见D4与S组)。类似的结果在黄鰤鱼(Seriolalalandi)[31]、河鲈(P.fluviatilis)[32]、大黄鱼(Pseudosciaenacrocea)[34]和鳊鱼(Parabramispeknensis)[35]中也有发现。此外,有研究表明条纹狼鲈(Moronesaxatilis)在开口摄食前消化酶的浓度足以消化外源配合饵料,而不受外源饵料的调控,这为其人工苗种培育提供了重要的生理基础[36]。由此可见,初孵仔鱼消化酶的活性变化与鱼类从内源营养向外源营养的转换过程是同步进行的,而消化酶发育的完善程度可能与鱼类安全度过这个关键期有重要关系[12]。
许氏平鲉属于卵胎生的鱼类,从亲体产出后即为仔鱼,在1~2d时口和肛门已与外界相通,可以开口摄食,3~4d时卵黄囊和油球消失[16,24]。本研究中发现,许氏平鲉仔鱼的脂肪酶活性从产出后逐渐降低,在3~4d时达到最低值,推测可能与卵黄囊与油球的吸收过程有关(图3)。这在鮸(M.miiuy)[12]和狭鳕(Theragrachalcogramma)的研究中也有相似的结果[37]。进入稚鱼期后(约26d),许氏平鲉的脂肪酶活性有逐渐升高的趋势,这可能与投喂的饵料从卤虫无节幼体转换为人工颗粒饲料的变化有关。进入稚鱼后期(约26d),许氏平鲉脂肪酶的比活力与总活力均显著升高,推测可能与其消化系统发育较为完善相关。
前7d的許氏平鲉仔鱼淀粉酶的比活力变化较大,而且无论是否完成初次摄食,在口和肛门均与外界相通时(2~3d)活力处于最高值,推测这是仔鱼在为摄入外源营养做生理准备(图2)。而这个高峰之后其活力都会显著降低,则可能与仔鱼摄入的营养物质为轮虫幼体有关(其碳水化合物含量较少),这在很多鱼类中都有报道[12,38]。仔鱼期淀粉酶比活力波动较大,可能与卤虫幼体和颗粒饲料的混合投喂有关(图2中4~22d)。进入稚鱼期后(26d),淀粉酶的比活力较为稳定,总活力呈显著上升的趋势,这可能与完全投喂颗粒饲料有关。许氏平鲉仔鱼期的淀粉酶比活力较高,表明在饲料中添加一定量的碳水化合物可以改善由内源蛋白向外源蛋白转变时能量的匮乏。因此,在仔鱼期适当添加植物性饵料可以改善许氏平鲉的营养状况,也有利于降低仔鱼死亡率、提高生长速度。
许氏平鲉仔鱼的胰蛋白酶在产出后即可检测到,这可能与卵胎生的方式有关。仔鱼在亲体内器官系统发育已相对完善[16,24,26-27],并且也为外源蛋白的摄入做生理准备。随着日龄增长,比活力显著升高,8d之后胰蛋白酶比活力呈稳定趋势,可能与消化系统已发育较为完善有关,这在鮸(M.miiuy)[12]和狼鲈(Dicentrarchuslabrax)[39]中也有发现。此外,还有一些鱼类的胰蛋白酶比活力在仔鱼期过后变化不显著,还可能与胃的发育有关,胃蛋白酶的发育取代了部分胰蛋白酶的功能,导致胰蛋白酶活力在仔鱼期就不再升高,比如黄鰤鱼(Seriolalalandi)[31]、大黄鱼(P.crocea)[34]和美洲蝶(Pleuronectesamericanus)[40]。胰蛋白酶总活力与脂肪酶、淀粉酶的变化趋势相似。进入稚鱼期后,整个消化系统已经相对完善,消化酶活力均有显著升高。
鱼类孵化后的初次摄食,对仔鱼生长和消化酶发育均有显著影响[12]。一般情况下,鱼类在开口摄食时消化系统的发育并不完善,初次摄入的生物饵料包含的部分外源消化酶直接进入肠道帮助仔鱼消化,同时转化为自身蛋白质后,合成各种酶,促进消化酶的发育,这也是仔鱼在开口摄食后消化酶活性显著升高的重要原因[10,15]。本研究中,D4组和S组的仔鱼由于没有能量的摄入导致消耗自身而出现了负生长现象,而且可能也超过了消化酶发育的关键时期,即使再投喂(D4组)也无法摄入或消化。这个酶发育的关键时期可能与仔鱼的不可逆点(PNR,即在这个点之前,如果仔鱼不能完成初次摄食,后期再投喂也无法完成摄食消化,也称之为“生态死亡”)有重要关系[9]。同时,其它延迟投喂组(D2和D3组)仔鱼的消化酶发育出现了一定的滞后现象(图3、图4和图5),而这不仅会导致仔鱼初期的消化能力弱、生长缓慢,还会进一步影响后续的生长和发育,即使后期正常投喂到49d,SGR仍显著低于C组和D1组(图2)。此外,有研究表明,饵料生物和配合饲料的组成可以调节鱼类消化酶的活性[34,39]。本研究中,仔鱼开口摄食时主要消化酶的活性迅速增加,表明许氏平鲉仔鱼在摄食初期已经具有消化蛋白质、脂肪和碳水化合物的能力;3~22d由于生物饵料的转变,消化酶的活性处于不断的变化的波动状态,这种变化可能是与消化器官的不断发育有关,22d到实验结束许氏平鲉的消化酶活性处于相对稳定的状态,这表明了消化系统发育的成熟。
综上所述,许氏平鲉仔鱼开口摄食前(2~3d),消化酶的活性已经处于较高状态,为进入外源性营养期作好了营养生理准备。如果投喂不及时(3d以后),消化酶活力会显著下降,最终影响仔鱼的生长、存活和消化酶的发育,而且这种影响在后期正常投喂很长一段时间也无法消除。前7d是消化酶快速发育并有所波动的关键时期,建议一定要及时并多次投喂,提高许氏平鲉早期苗种培育的存活率。
参考文献:
[1]柳敏海,施兆鸿,陈波,等.饥饿对点带石斑鱼饵料转换期仔鱼生长和发育的影响[J].海洋渔业,2006,28(4):292-298.
[2]殷名称.鱼类早期生活史阶段的自然死亡[J].水生生物学报,1996(4):363-372.
[3]鲍宝龙,苏锦祥.海洋饥饿仔鱼营养状况的研究[J].上海水产大学学报,1998,7(1):51-58.
[4]BENJAMINGH,RICEJA,CROWDERLB.Size-dependenteffectscontinuousandintermittentfeedingonstarvationandmasslossinstaringyellowperchlarvaeandjuveniles[J].TaransAmFishSoci,1996,125:14-26.
[5]MCGURKMD.EffectsofdelayedfeedingandtemperatureontheageofirreversiblestarvationandontheratesofgrowthandmortalityofPacificherringlarvae[J].MarineBiology,1984,84(1):13-26.
[6]YINMC,BLAXTERJHS.Morphologicalchangesduringgrowthandstarvationoflarvalcod(GadusmorhuaL.)andflounder(PlatichthysflesusL.)[J].JournalofExperimentalMarineBiologyandEcology,1986,104(1-3):215-228.
[7]殷名称.北海鲱卵黄囊期仔鱼的摄食能力和生长[J].海洋与湖沼,1991,22(6):554-560.
[8]殷名称.鱼类早期生活史研究与其进展[J].水产学报,1991,15(4):348-358.
[9]殷名称.鱼类仔鱼期的摄食和生长[J].水产学报,1995,19(4):335-342.
[10]GISBERTE,CONKLINDB,PIEDRAHITARH.EffectsofdelayedfirstfeedingonthenutritionalconditionandmortalityofCaliforniahalibutlarvae[J].JournalofFishBiology,2004,64(1):116-132.
[11]YOSEDAK,DANS,SUGAYAT,etal.EffectsoftemperatureanddelayedinitialfeedingonthegrowthofMalabargrouper(Epinephelusmalabaricus)larvae[J].Aquaculture,2006,256(1):192-200.
[12]单秀娟.鮸(Miichthysmiiuy)早期生长存活过程和消化生理机制的研究[D].中国科学院研究生院(海洋研究所),2008.
[13]GISBERTE,WILLIOTP.LarvalbehaviourandeffectofthetimingofinitialfeedingongrowthandsurvivalofSiberiansturgeon(Acipenserbaeri)larvaeundersmallscalehatcheryproduction[J].Aquaculture,1997,156(1-2):63-76.
[14]YúFERAM,PASCUALE,PoloA,etal.Effectofstarvationonthefeedingabilityofgiltheadseabream(SpamsaurataL.)larvaeatfirstfeeding[J].JournalofExperimentalMarineBiologyandEcology,1993,169(2):259-272.
[15]KOLKOVSKIS,TANDLERA,KISSILGW,etal.Theeffectofdietaryexogenousdigestiveenzymesoningestion,assimilation,growthandsurvivalofgiltheadseabream(Sparusaurata,Sparidae,Linnaeus)larvae[J].FishPhysiology&Biochemistry,1993,12(3):203-209.
[16]陳大刚,叶振江,段钰,等.许氏平鲉繁殖群体的生物学及其苗种培育的初步研究[J].海洋学报,1994,16(3):94-101.
[17]LH,ZHANGX,XID,etal.UseofcalceinandalizarinredSforimmersionmarkingofblackrockfishSebastesschlegeliijuveniles[J].ChineseJournalofOceanologyandLimnology,2014,32:88-98.
[18]LH,ZHANGX,FUM,etal.UseoftetracyclinehydrochlorideandalizarincomplexoneforimmersionmarkingblackrockfishSebastesschlegelii[J].ChineseJournalofOceanologyandLimnology,2014,32:810-820.
[19]席丹,张秀梅,吕红健,等.许氏平鲉早期异速生长模式的研究[J].中国海洋大学学报:自然科学版,2014(12):28-34.
[20]陈颖.山东省渔业资源增殖放流现状及前景分析[D].烟台:烟台大学,2017.
[21]BAISC,LEEKJ.DifferentlevelsofdietaryDL-α-tocopherylacetateaffectthevitaminEstatusofjuvenileKoreanrockfishSebastesschlegeli[J].Aquaculture,1998,161:405-414.
[22]LEESM,KIMJD.DietaryoptimumphosphoruslevelofjuvenileKoreanrockfish(Sebastesschlegeli)[J].FisheriesandAquaticSciences,1998,1(2):180-186.
[23]LIMSR,CHOISM,WANGXJ,etal.EffectsofdehulledsoybeanmealasafishmealreplacerindietsforfingerlingandgrowingKoreanrockfishSebastesschlegeli[J].Aquaculture,2004,231(1):457-468.
[24]刘立明,姜海滨,王茂剑,等.黑鲪仔、稚、幼鱼生长、发育与成活率变化的研究[J].中国海洋大学学报:自然科学版,2013,43(03):25-31.
[25]郭浩宇,张秀梅,高天翔.人工隐蔽物及投喂频率对许氏平鲉幼鱼生长和行为的影响[J].中国水产科学,2015,22(2):319-331.
[26]XID,ZHANGX,LH,etal.Predictionofcannibalisminjuvenileblackrockfish,Sebastesschlegelii(Hilgendorf,1880),basedonmorphometriccharacteristicsandpairedtrials[J].Aquacultureresearch,2017,48(6):3198-3206.
[27]XID,ZHANGX,LH,etal.Cannibalisminjuvenileblackrockfish,Sebastesschlegelii(Hilgendorf,1880),rearedundercontrolledconditions[J].Aquaculture,2017,479:682-689.
[28]KENDALLJRAW.Earlylifehistorystagesoffishesandtheircharacters[J].Ontogenyandsystematicsoffishes,1984,24:11-22.
[29]ALVAREZ-GONZLEZCA,CERVANTES-TRUJANOM,TOVAR-RAMREZD,etal.DevelopmentofdigestiveenzymesinCaliforniahalibutParalichthyscalifornicuslarvae[J].FishPhysiologyandBiochemistry,2005,31(1):83-93.
[30]COMABELLAY,MENDOZAR,AGUILERAC,etal.DigestiveenzymeactivityduringearlylarvaldevelopmentoftheCubangarAtractosteustristoechus[J].FishPhysiologyandBiochemistry,2006,32(2):147.
[31]CHENBN,QINJG,KUMARMS,etal.OntogeneticdevelopmentofdigestiveenzymesinyellowtailkingfishSeriolalalandilarvae[J].Aquaculture,2006,260(1-4):264-271.
[32]CUVIER-PRESA,KESTEMONTP.DevelopmentofsomedigestiveenzymesinEurasianperchlarvaePercafluviatilis[J].FishPhysiologyandBiochemistry,2001,24(4):279-285.
[33]KIMBG,DIVAKARANS,BROWNCL,etal.Comparativedigestiveenzymeontogenyintwomarinelarvalfishes:Pacificthreadfin(Polydactylussexfilis)andbluefintrevally(Caranxmelampygus)[J].FishPhysiologyandBiochemistry,2001,24(3):225-241.
[34]MAH,CAHUC,ZAMBONINOJ,etal.Activitiesofselecteddigestiveenzymesduringlarvaldevelopmentoflargeyellowcroaker(Pseudosciaenacrocea)[J].Aquaculture,2005,245(1-4):239-248.
[35]CARAJB,MOYANOFJ,S.CRDENAS,etal.Assessmentofdigestiveenzymeactivitiesduringlarvaldevelopmentofwhitebream[J].JournalofFishBiology,2003,63(1):48-58.
[36]BARAGIV,LOVELLRT.Digestiveenzymeactivitiesinstripedbassfromfirstfeedingthroughlarvadevelopment[J].TransactionsoftheAmericanFisheriesSociety,1986,115(3):478-484.
[37]OOZEKIY,BAILEYKM.Ontogeneticdevelopmentofdigestiveenzymeactivitiesinlarvalwalleyepollock,Theragrachalcogramma[J].MarineBiology,1995,122(2):177-186.
[38]COUSINJCB,LAURENCINFB.Histologicalalterationsobservedinturbot,ScophthalmusmaximusL.fromdays15to40afterhatching[J].Aquaculture,1987,67(1):218-220.
[39]ZAMBONINOINFANTEJL,CAHUCL.Ontogenyofthegastrointestinaltractofmarinefishlarvae[J].ComparativeBiochemistry&PhysiologyPartC,2001,130(4):477-487.
[40]DOUGLASSE,GAWLICKAA,MANDLAS,etal.Ontogenyofthestomachinwinterflounder:characterizationandexpressionofthepepsinogenandprotonpumpgenesanddeterminationofpepsinactivity[J].JournalofFishBiology,1999,55(5):897-915.
Abstract:Toinvestigatethecharacteristicchangesofdigestiveenzymeswithdevelopmentandearlystarvationinblackrockfish(Sebastesschlegelii),thenew-bornlarvaeweredividedinto6groups,i.e.C,D1,D2,D3,D4andS,whichrepresentedthatthelarvaewerefirstfedon1d,2d,3d,4d,5dandnotfedatall,respectively.Wemeasuredtheactivitiesofamylase,lipaseandtrypsinoflarvaeineachgroupwithgrowth.Theresultsshowedthatthespecificactivitiesofdigestiveenzymesfluctuatedduringpre-larvalstageandbecomesteadyafter22d.Thetotalactivitiesofdigestiveenzymeswereatalowandstablelevelduringlarvalandjuvenilestagesandincreasedsignificantlyafter26d.Theactivitiesoftheseenzymeswerenotdifferentsignificantlybetweenthesurvivedgroupsatthesamedayage.However,thetotallength,bodyweightandSGRofblackrockfishinD2andD3groupsweresignificantlylowerthanthoseinCandD1groups,whichindicatedthedelayedfirstfeedingaffectedthegrowthanddevelopmentofblackrockfishsignificantly,andtheinfluencescouldhardlybeeliminatedafteralongtime.Accordingtotheseresults,wesuggestthatthenew-bornlarvaeofblackrockfishbefirstfedin1~2d,whichwouldbehelpfultomitigatestarvation,promoteregularlydevelopmentandlowerlarvaldeathrate.
Keywords:Sebastesschlegelii;delayedfeeding;starvation;digestiveenzyme;growthanddevelopment
(收稿日期:2019-07-09;修回日期:2019-07-30)

