小粒咖啡树咖啡碱合成途径中CaXMT1、CaDXMT1、CCS1表达差异及其与咖啡碱含量的相关性
李芬 李丽江 徐丹旎 陈春林 王玮 李梅
(1. 滇西应用技术大学普洱茶学院,普洱 665000;2. 云南省农业科学院茶叶研究所,勐海 666201)
咖啡为茜草科(Rubiaceae)咖啡属(Coffea genus)植物,该属主要为二倍体和四倍体[1]。主要种植的有小粒种(Coffee arabica)、中粒种(Coffee robusta)和大粒种(Coffee liberica)[2-4]。其中,由于小粒种咖啡品质较好,生产规模较大,其产量达到全球咖啡产量的73%,已成为很多地区独具优势的特色经济产业。
咖啡中含有咖啡碱,适量摄入对身体有益,过多则有害。咖啡树中,咖啡碱主要在嫩叶中合成。咖啡幼苗的叶片和子叶含咖啡碱,而根部和成熟枝条的褐色部分不含咖啡碱[5]。目前,从咖啡树中已克隆获得一系列与咖啡碱合成相关的关键酶基因,包括7-黄嘌呤核苷甲基转移酶基因(7-methylxanthosine synthase,CaXMT1)[6]、可可碱合成酶基因CaMXMT、咖啡碱合成酶基因(Coffee caffeine synthase,CaDXMT1)[7]和双功能酶基因(Bifunctional coffee coffeine synthase,CCS1)[8]等。尽管这些酶的氨基酸系列组成具有很大的相似性(>80%),但是底物专一性差异性较大[6]。
目前,对小粒咖啡树不同组织不同发育时期(嫩叶、成熟叶片、幼果和成熟鲜果)CaXMT1、CaDXMT1、CCS1相对表达量差异,以及这3个关键基因的表达与咖啡碱含量关系的研究报道甚少。
本研究采用qRT-PCR方法测定咖啡树不同组织中咖啡碱合成途径3个关键酶基因(CaXMT1、CaDXMT1和CCS1)的相对表达量,并将其与各组织中的咖啡碱含量进行相关性分析,从而探究这3个基因的mRNA相对表达量与咖啡碱含量的关系,进一步探讨小粒种咖啡豆中咖啡碱合成机理,为咖啡树的育种提供理论依据。
1 材料与方法
1.1 材料
2017年11月,在云南省普洱市南岛河进行样品采集,采集生长状况一致的小粒种(Coffeearabica)咖啡品种植株嫩叶、成熟叶片、幼果和成熟鲜果4个部位。采摘后,每个部位选取部分样品置于液氮中冷冻,之后于-80℃保存;剩余样品干燥至恒重,用研磨机研磨至粉末状,并过200目筛,聚乙烯自封袋密封备用。
1.2 方法
1.2.1 小粒咖啡树不同部位咖啡碱含量的HPLC测定
(1)样品提取 按照HPLC测定植物样中咖啡碱含量的样品提取方法[9-10],称取0.167 g粉末状样品,放入15 mL离心管中,加入10 mL超纯水。将离心管放入水浴锅中100℃浸提20 min。然后4 000 r/min离心5 min。提取上清液至50 mL容量瓶中,定容至50 mL。经0.22 μL水系滤膜过滤,-20℃保存。
(2)HPLC色谱条件 色谱柱:Amethyst C18-H(4.6×250 mm);流动相:甲醇∶水(40∶60);柱温40℃;进样量10 μL;流速0.5 mL/min;检测波长280 nm;进样时间:15 min。
1.2.2 关键酶基因的qRT-PCR检测
(1)RNA提取及cDNA合成 选取小粒咖啡各部位样品,分别加入PVPP及液氮充分研磨;各取约20 mg研磨试样,加入900 μL CTAB提取液及50 μL β-巯基乙醇,65℃ 30 min;用 RNA 提取试剂盒提取总RNA。使用PrimeScript 1st Strand cDNA Synthesis Kit(TaKaRa D6110S)合成第一链cDNA。
(2)基因表达量测定 qRT-PCR反应体系(20μL)为 SYBR Premix Ex Taq(TaKaRa DR081A)10.0 μL、PCR forward & reverse primer(10 μmol/L)各 0.8 μL、cDNA 1st Strand(100 ng/μL)2 μL 和 ddH2O 6.4 μL。qRT-PCR 程序为 95℃ 30 s;95℃ 5 s,62℃ 30 s,40个循环。在65-95℃建立溶解曲线。以GAPDH作为内参基因[11],用2-ΔΔCt法计算基因相对表达量。引物序列见表1。
1.2.3 数据处理 采用Microsoft Excel 2013、SPSS及Origin8.5软件分析处理试验数据。

表1 小粒种咖啡树咖啡碱合成途径3个关键酶基因的引物序列
2 结果
2.1 小粒咖啡树不同组织咖啡碱含量的HPLC法测定
咖啡碱出峰时间为8.85 min。色谱峰面积(y)与浓度(x,mg/mL)的线性回归方程为y=2.10×105x+6.70×105,r2=0.999 4。云南小粒种咖啡植株中的咖啡含量范围为0.62%-1.52%,其中,成熟叶片中的咖啡碱含量最低,嫩叶中的最高(表2,图1),达到1.22%±0.18%,嫩叶中的咖啡碱含量是成熟叶片中的1.8倍。小粒种咖啡植株不同组织不同发育时期咖啡碱含量顺序表现为嫩叶>幼果>成熟鲜果>成熟叶片,且嫩叶和幼果中的咖啡碱含量分别显著高于成熟叶片(P=0.001)和成熟鲜果(P=0.007)中的。
2.2 小粒咖啡树不同组织间3个关键酶基因的表达量差异
由表3可知,云南小粒种咖啡中的CCS1相对表达量范围为1.03-2.38,不同组织的CCS1相对表达量顺序为嫩叶<成熟叶片<幼果<成熟鲜果;CaDXMT1的表达量范围为1.08-2.82,不同组织的相对表达量顺序为嫩叶<成熟叶片<成熟鲜果<幼果;CaXMT1相对表达量范围为1.34-2.29,不同组织的相对表达量顺序为:嫩叶<幼果<成熟叶片<成熟鲜果。CaXMT1和CaDXMT1在嫩叶和成熟叶片中的相对表达量存在极显著性差异(P<0.01),而幼果和成熟鲜果之间仅仅只有CaXMT1存在极显著性差异(P<0.01)。
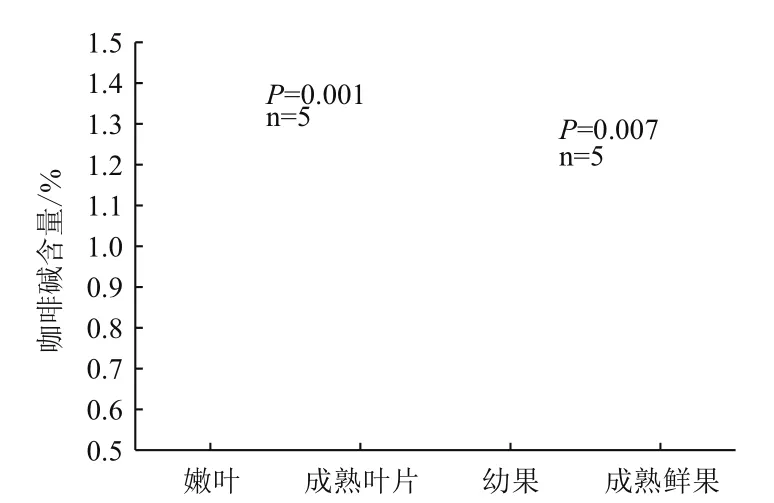
图1 小粒种咖啡树不同组织咖啡碱含量
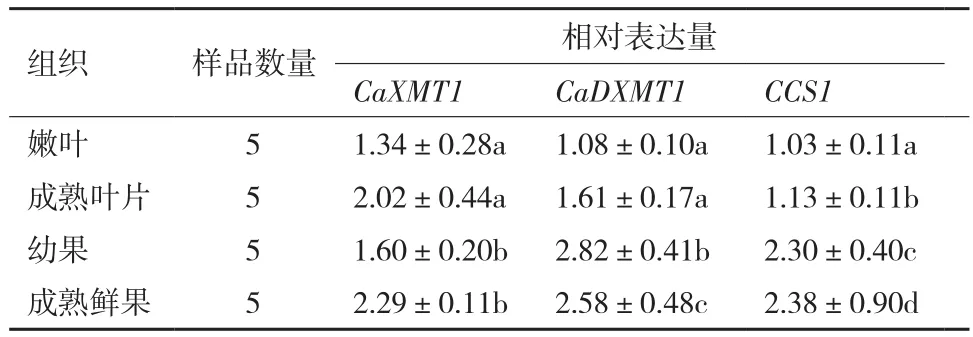
表3 小粒种咖啡树咖啡碱合成途径3个关键酶基因的相对表达量
2.3 基因表达量与咖啡碱含量的相关性分析
由图2可知,CaXMT1在成熟叶片和成熟鲜果中的相对表达量随着咖啡碱含量的增加而增加,其相关系数R2分别为0.25和0.15。然而,CaXMT1在嫩叶和幼果中的相对表达量随着咖啡碱含量的增加而呈降低趋势,其相关系数分别为0.30和0.93,且在幼果中显著负相关(P=0.004)。
CaDXMT1相对表达量在嫩叶、成熟叶片、幼果和成熟鲜果中的相对表达量随着咖啡碱含量的增加均呈增加趋势,其相关系数R2分别为0.20、0.067、0.33和0.084。
CCS1在嫩叶和成熟鲜果中的相对表达量随着咖啡碱含量的增加而呈增加趋势,其相关系数R2分别为0.15和0.32。而在成熟叶片和幼果中则随着咖啡碱含量的增加呈现降低的趋势,其相关系数R2分别为 0.29和0.24。
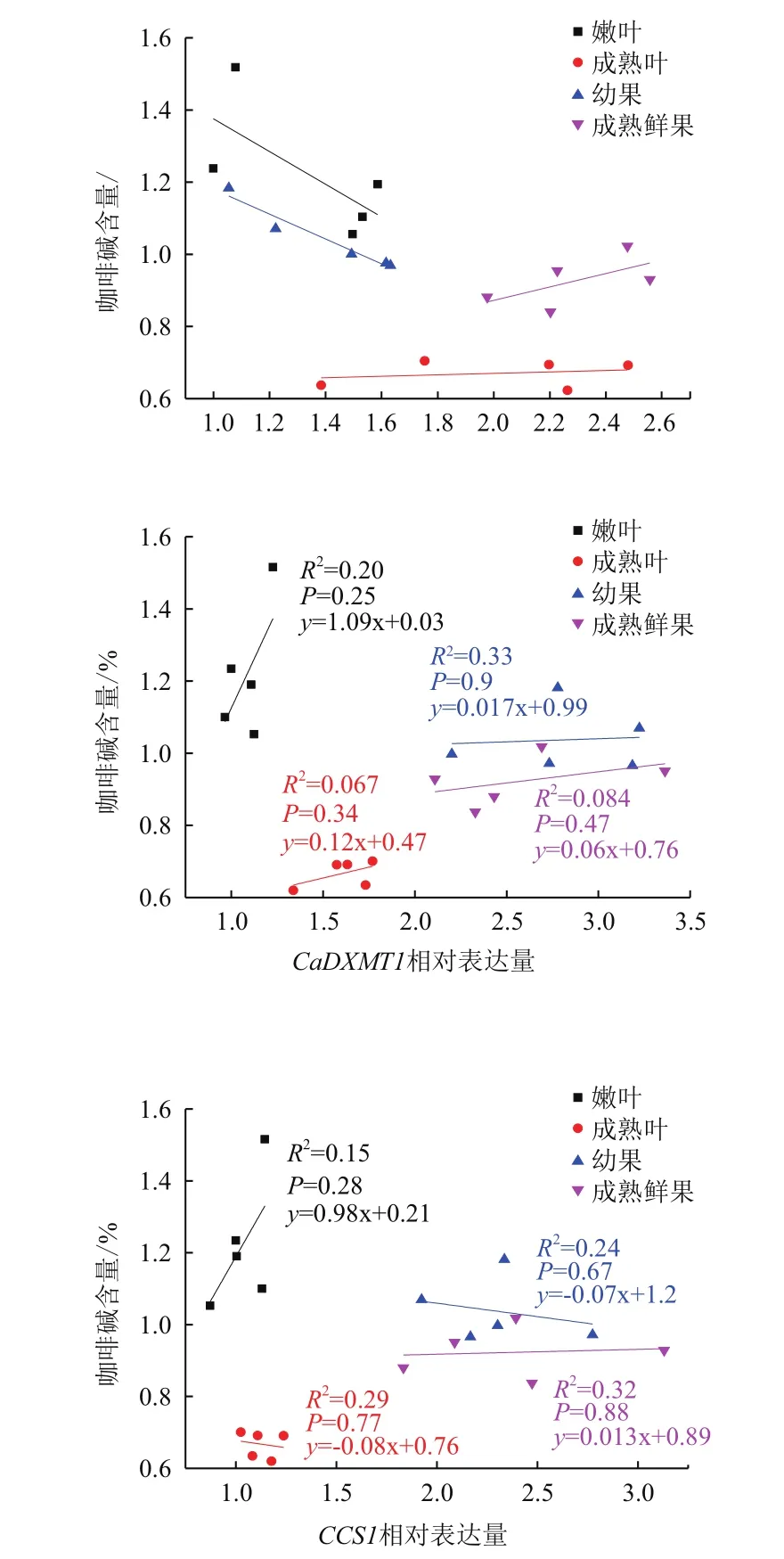
图2 小粒种咖啡树咖啡碱合成途径关键酶基因CaXMT1、CaXMT1及CCS1相对表达量与咖啡碱含量的相关性
3 讨论
本研究中云南小粒种咖啡植株叶片咖啡碱含量范围为0.62%-1.52%,均值为0.94%±0.32%;果实中为0.84%-1.18%,均值为0.98%±0.10%;前人研究结果表明,小粒咖啡的大多数品种的咖啡豆中咖啡碱含量约为1.0%。本研究结果与前人报道的含量相符[12]。植物中的咖啡碱99%存在于叶片中[13-15],且植物中咖啡碱合成的主要部位是叶绿体,合成后的咖啡碱与绿原酸结合成复合物储存在细胞液泡中[16-17],根和茎中几乎不能合成咖啡碱[18],植物中咖啡碱不同组织含量分布规律为幼嫩新梢>茎梗>花果[19]。叶片中咖啡碱的合成主要在幼叶中进行,随着叶龄的增加,合成速率降低[15]。
本研究发现除了CaXMT1在嫩叶和幼果中的相对表达量分别显著低于成熟叶片和鲜果(P<0.01)中的,且在幼果中相对表达量与咖啡碱含量显著负相关(R2=0.93,P<0.01)以外,其他基因的相对表达量在嫩叶和成熟叶片、幼果和成熟鲜果中的差异性不明显。3个关键酶基因在不同组织不同发育时期表达的差异性,可能与这3个酶的特性以及咖啡碱合成途径中关键酶基因调控机制的复杂性相关[6-8,20-21]。在咖啡碱合成过程中,主要包括4个反应步骤(表4)、3个甲基化反应步骤及一个脱核苷反应步骤。咖啡碱合成过程中,首先是在N7甲基转移酶(CmXRS1和CaXMT1)的催化下,由S-腺苷甲硫氨酸提供甲基,黄嘌呤核苷合成7-甲基黄嘌呤核苷[21]。其次是在脱核苷酶的催化下,7-甲基黄嘌呤核苷脱核苷,目前,脱核苷酶基因未被克隆[22-23],估计7-甲基转移酶在催化黄嘌呤核苷甲基化的同时,催化7-甲基黄嘌呤核苷脱除核苷[24]。然后,在N3甲基转移酶基因CTS和CaMXMT的调控下,7-甲基黄嘌呤合成可可碱(3,7-二甲基黄嘌呤)[20-21]。最后,可可碱在N1甲基转移酶基因(CCS1和CaDMXT1)的调控下合成咖啡碱[6]。
这些咖啡碱合成关键酶基因的氨基酸序列相似性(>80%)较大,且其分子量及编码的多肽氨基酸组成个数差异性小,底物专一性却差异较大[6]。如黄嘌呤核苷甲基转移酶基因(XMT/CmXRS),其编码的多肽由372个氨基酸组成,且分子量为41.8 kD。可可碱合成酶基因MXMT1(42.7 kD)、MXMT2及CTS2(43.4 kD),其编码的多肽分别由378、384个氨基酸组成,多肽分子量及氨基酸组成个数相似,但催化特性差异性大。可能与不同的酶具有不同的催化特性有关,而酶的催化特性与其动力学参数Km相关性较大。如咖啡碱合成酶DXMT和CCS1,其编码的多肽分子量(43 kD)及氨基酸个数(384)相同,但其动力学参数差异性较大,在调控可可碱合成咖啡碱的过程中,其动力学参数Km值分别为1 200和 157 μmol/L,DXMT的Km值 是CCS1的 8倍[8,20-21]。而且,CCS1能够利用7-甲基黄嘌呤、3,7-二甲基黄嘌呤及1,7-二甲基黄嘌呤合成咖啡碱,具有N1及N3甲基化的双功能[21],其中,1,7-二甲基黄嘌呤为其最活跃的底物,对1,7-二甲基黄嘌呤的催化活性是对可可碱的3倍[26-27]。但在咖啡植物中1,7-二甲基黄嘌呤的含量较少。因此,咖啡碱的合成主要是7-甲基黄嘌呤通过合成可可碱而合成咖啡碱。进一步研究发现咖啡碱合成途径中的几个关键酶基因在细胞中既可以形成同源二聚体,也可形成异源二聚体,且检测异源二聚体有双重活性,这可能是有利于咖啡碱的快速合成[28]。通过咖啡碱合成途径中几个关键酶特性的差异性,可知咖啡碱的合成途径是一个复杂的过程,与酶底物的可利用性以及浓度等密切相关[6-8,20-21]。
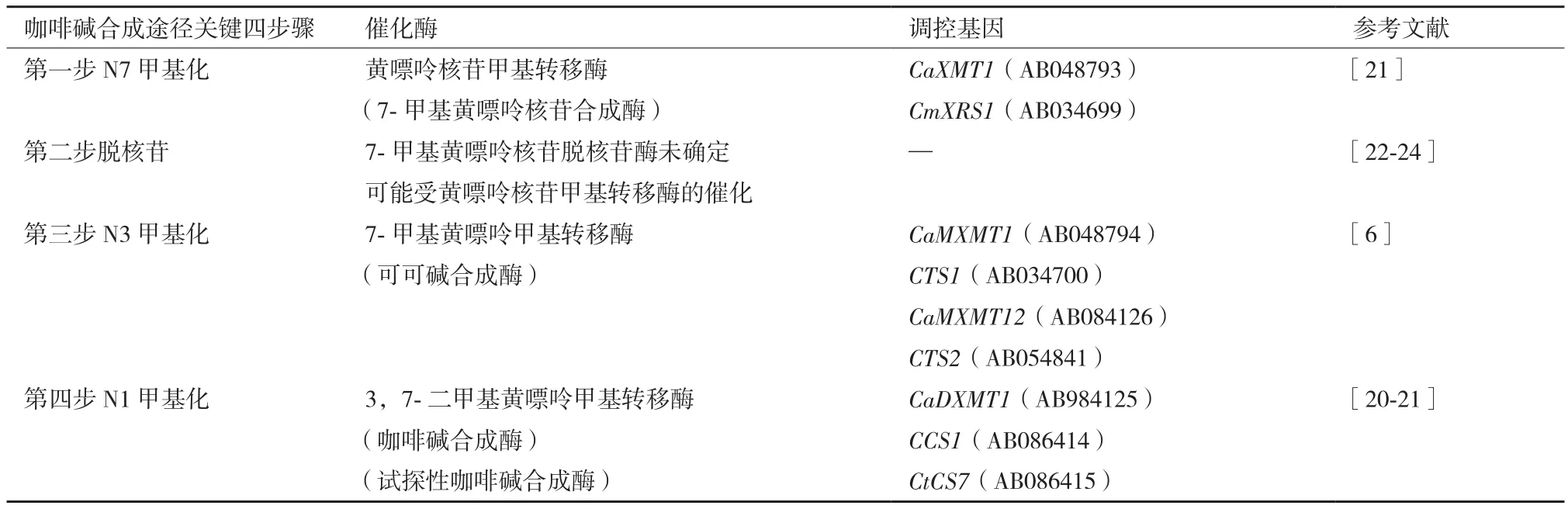
表4 咖啡碱合成途径中的N-甲基转移酶及编码基因[25]
咖啡碱合成途径中的3个甲基化反应,需要有嘌呤环、甲基供体以及甲基载体四氢叶酸。植物中咖啡碱的量,除了与这3个关键酶基因的相对表达量,可能还与嘌呤环、甲基供体以及甲基载体四氢叶酸的合成量相关。咖啡碱结构中的甲基和黄嘌呤核苷分别经过不同的途径组合,目前已发现的黄嘌呤核苷的合成可通过4条途径[29],分别是核糖-5-磷酸途径、腺嘌呤核苷酸途径、鸟嘌呤核苷酸途径和S-腺苷甲硫氨酸循环途径。其嘌呤环的合成途径中受多种酶基因的调控,Fujimori等[30]研究表明,腺嘌呤核苷脱氨酶促进腺嘌呤核苷酸合成嘌呤环进而提高咖啡碱的合成量。咖啡碱结构中的3个甲基由S-腺苷蛋氨酸提供[31],且在嘌呤环甲基化的过程中,四氢叶酸接受来自S-腺苷蛋氨酸的甲基,变成N5-甲基四氢叶酸,在甲基转移酶的作用下,携带甲基的四氢叶酸将甲基转移到嘌呤环上去,从而完成甲基化作用[32],而这一转甲基的过程中,受到蛋白质代谢的影响[33],这与蛋白质代谢旺盛的嫩叶中咖啡碱含量最多的现象也相符。
然而,小粒咖啡树中不同部位咖啡碱的含量除受基因的调控外,还受到光照、温度、氮素、钾离子浓度、季节等环境因子的影响。前人应用碳同位素示踪技术发现,光通过温度间接影响酶的活性,强光和大量日照,通过加速氨基酸的分解,进而抑制咖啡碱的合成[34-35]。关于季节,研究表明,秋季茶树新稍中的咖啡碱含量低于春夏两季[36]。氮肥通过增加氨基酸的含量来增加咖啡碱的合成量[37-38]。钾肥则通过提高酶的活性来增加咖啡碱的含量[39-42]。海拔也影响咖啡碱的合成,Owuor等[43]研究表明,随着海拔的增加,茶叶中的咖啡碱含量增加。刘建军等[44]通过对茶叶进行不同遮阴方式的处理,发现遮阴能够增加茶叶氨基酸、咖啡碱含量,且不同遮阴方式的增加效果不一样,其中黑色双层遮阳网遮荫效果最好。而郑高云等[45-46]研究也表明,植物为了预防虫害,会释放更多的咖啡碱。
同时,咖啡碱在植物体内的分解也影响咖啡碱在植物体内的含量。咖啡碱在植物体内的代谢,一方面是合成,一方面是分解。咖啡碱的分解先脱去环上的基团,变成黄嘌呤,脱下的甲基又通过四氢叶酸载体转移到其他化合物中[32],黄嘌呤有两种去向,一种是继续分解,一种是转化为其它嘌呤核苷酸再被利用。黄嘌呤在茶树体内的分解主要是在老叶中进行,分解产物主要是尿酸和尿囊素。研究报道,夏季高温加速蛋白质以及咖啡碱的分解[34],导致植物体内的咖啡碱含量降低。
4 结论
咖啡碱在幼龄组织中的合成量显著高于成熟组织中的合成量;合成途径中的CaXMT1、CaDXMT1、CCS13个关键酶基因,在不同组织不同发育时期表达具有差异性。

