ENO1在食管鳞癌中的差异表达及对食管鳞癌细胞增殖凋亡的影响
王文洁,彭昊,李锋,杨兰,崔晓宾,陈云昭,3*
(1石河子大学医学院病理系,新疆 石河子 832002;2首都医科大学附属北京朝阳医院病理科,北京 100200; 3苏州高新区人民医院病理科,江苏 苏州 215000)
食管癌是世界上死亡率居第六位的肿瘤[1]。我国是食管癌高发地区,2015年预估发病人数和死亡人数分别占全部恶性肿瘤的第3位和第4位[2]。食管鳞状细胞癌(ESCC)是食管癌最常见的组织学亚型,我国90%的食管癌都是鳞状细胞癌[3]。近年来,尽管诊断和治疗方法有飞跃式的发展,但是ESCC 晚期患者的生存率仍较低,其五年生存率仅为10%[4-6]。因此,需要寻找食管鳞癌早期诊断标志物,以利于早期诊断及以此为靶点进行个体化治疗。
“你传颜师父的二十四字诀也就罢了,为什么又将‘骊山谱’画给曲风,这小子的棋力最近本来就退步了,你还帮着他偷懒!”在袁安等入谷之前,曲风是棋圣最得意的弟子,谷中的访客来寻王积薪下棋的,多半都是他对付去了。欲访棋王,先奏曲风。曲风如虎,积薪如狼。这都是江湖上的弈道传说了。其时积薪年过三十,纱帽白衣,身形精干,说话中气十足,平日不苟言笑,接着颜真卿责问上官星雨,辞色又比书圣要严峻很多。
烯醇化酶(ENO)是糖酵解中的一个关键酶,可以水解2磷酸甘油酸生成磷酸烯醇式丙酮酸[7]。ENO有三种亚型,即ENO-α (ENO-1),ENO-β (ENO-3),ENO-γ (ENO-2).其中,ENO1几乎在人体所有组织中都有表达,而ENO2主要在肌肉组织中表达,ENO3主要在神经组织中表达[7-8]。ENO1是一种多功能酶,它可以翻译成转录因子MBP-1,在细胞核内与c-MYC结合[9];它还可以作为纤溶酶原受体激活纤溶酶,使细胞外基质降解[10]。ENO1作为一种糖酵解酶,除在糖酵解途径发挥酶的作用外,还在恶性肿瘤的转移中发挥重要的作用[11]。研究发现,在神经胶质瘤中,ENO1 可作为潜在的癌基因促进肿瘤的增殖、侵袭和迁移[12]。ENO1还可以通过FAK介导的PI3K/Akt途径促进非小细胞肺癌的糖酵解、细胞增殖、侵袭和迁移[13]。另有研究发现,在胃癌细胞中,沉默ENO1后可抑制肿瘤细胞的增殖[14]。本研究主要通过免疫组化检测ENO1在食管鳞癌组织中表达,分析ENO1与食管鳞癌患者临床病理因子的联系及患者预后,通过免疫荧光检测ENO1在食管鳞癌细胞中的定位,运用CCK8、Western bolt检测ENO1对食管鳞癌细胞增殖、凋亡的影响。
1 材料与方法
1.1 材料来源
随机选取石河子大学医学院第一附属医院、乌鲁木齐自治区人民医院、喀什第一人民医院、伊犁州新华医院和友谊医院及奎屯医院各病理科 2000-2016 年间石蜡包埋组织,其中50例食管癌旁正常组织,20例食管低级别上皮内瘤变(Low-grade intraepithelial neoplasia of the esophagus,LGIN),20例高级别上皮内瘤变(High-grade intraepithelial neoplasia of the esophagus,HGIN),50例食管鳞癌组织(Esophageal squamous cell carcinoma,ESCC),同时收集患者的个人信息、肿瘤分化程度、淋巴结转移以及TNM分期等临床病理因子及随访资料。
1.2 免疫组织化学染色
对组织蜡块进行5 μm连续切片,67 ℃烤干,常规脱脱蜡、脱二甲苯、脱酒精,放与枸橼酸修复缓冲液中高温高压修复8 min,室温冷却至40 ℃,3%双氧水孵育10 min,滴加鼠抗人单克隆抗体覆盖组织(稀释度1∶51200),4 ℃孵育过夜。次日置于37 ℃温箱复温30 min,滴加鼠兔通用型生物素化二抗,DAB显色,苏木素复染30 s,酸酒精分化5 s,脱水封片。根据抗体说明书阳性组织做阳性对照,PBS溶液代替一抗为阴性对照,空白对照组不滴加一抗。
1.3 结果判定
ENO1阳性反应主要位于细胞浆、细胞膜,阳性表达呈深棕、棕褐色。免疫组化评分采用半定量积分,在光镜下每高倍镜视野阳性细胞百分数:阳性细胞所占百分比≤5%,为0分,6%~25%为1分,26%~75%为3分,76%以上为4分;根据细胞着色强度:无着色为0分,黄色为1分,棕黄色为2分,棕色为3分;着色面积和着色强度的乘积即为阳性强度:0-1分为阴性(-),2-4为为弱阳性(+),5-8分为中等强度阳性(++),9-12分为强阳性(+++)。所有切片采用双盲法由两位病理学专家阅片,意见不一致时请第三位病理学专家阅片,最终确定免疫组化评分结果。其中,阴性对照组和空白对照组均不着色。
1.4 免疫荧光
用浓度为80 nmol/L的ENO1 siRNA转染Eca109、EC9706细胞,72 h后提取蛋白,每孔10 μL蛋白上样,10%聚丙烯酰胺凝胶电泳,半干转转膜,5%脱脂奶粉室温封闭2 h,鼠抗人ENO1(1∶1000稀释,santa),Bax(1∶2000稀释,abcam),caspase3(1∶1000稀释,Cell Signaling Technology)鼠抗人β-actin(1∶1000)4 ℃过夜,TBST洗膜10 min×3次,山羊抗鼠IgG室温孵育2 h(1∶10000,中杉金桥),TBST洗膜10 min×3次,滴加ECL化学发光底物(碧云天)显色。
1.5 细胞转染
在六孔板铺20万个细胞,待细胞长至70%左右时,配置转染试剂,siRNA(上海生工合成,序列为5′-GCAUUGGAGCAGAGGUUUAdTdT-3')加入无血清培养基后混匀,加入lip8000转染试剂(碧云天)混匀,加入细胞中。
1.6 CCK8实验
按照贫困村退出标准,对各村的排水、道路、供电、供气、便民服务中心、警务室、村办公场所、幼儿园和活动广场等基础设施进行了完善。
1.7 Western blot实验
24孔板细胞爬片,接种1000个细胞,待细胞贴壁后,用37 ℃预温的pbs清洗3 min×3次,4%多聚甲醛固定,5%BSA 37 ℃封闭1 h,加一抗(ENO1 1∶100)后置湿盒过夜,次日复温后暗室中加FITC二抗(1∶80,ZF0314,碧云天),DAPI染核5 min,抗荧光淬灭剂封片后用荧光倒置显微镜观察。
1.8 统计学方法
所有统计学数据均采用SPSS22.0,计算各组阳性率,组间比较采用独立样本t检验,不同组间的差异性分析采用卡方检验。箱式图均采用Graphpad 5.0软件。
ENO1蛋白主要表达于食管鳞癌细胞的胞浆,少量胞核、胞膜表达(图1)。ENO1蛋白在食管正常组织、LGIN、HGIN、ESCC中的高表达率依次为12%(6/50)、50%(10/20)、70%(14/20)、66%(33/50),ENO1蛋白在ESCC、HGIN、LGIN中的表达明显高于正常组织(7.02±2.9931/6.95±2.6848/4.05±3.0349 VS 2.00±2.2039,P值均小于0.001),ENO1在ESCC、HGIN中的表达明显高于LGIN(7.02±2.9931/6.95±2.6848 VS 4.05±3.0349,P值均小于0.01,*P<0.05,**P<0.01,***P<0.001),结果见图2A和表1。并且,ENO1 在不同免疫组化评分区段的分布也有显著不同,正常组织主要分布于“0-1”,“2-4”区段,LGIN主要分布在“2-4”和“5-8”区段,HGIN和ESCC主要分布在“5-8”和“9-12”区段(图2B)。
2 结果
2.1 食管正常组织、LGIN、HGIN、ESCC中ENO1的表达
规则库是知识库的重要部分,用于存放施工升降机导轨架设计的工程规则[6]。对于设计过程的知识和设计的约束都采用嵌入式源程序法方式表达规则知识。采用基于规则的表达方式将施工升降机零件的相关设计准则和设计方案用KF语言描述出来嵌入到Dfa文件中。对于施工升降机导轨架的标准节的选取部分规则如下:

图1 ENO1蛋白在正常组织、LGIN、HGIN、ESCC中的表达Fig.1 ENO1 expression of NETs, LGIN, HGIN and ESCC
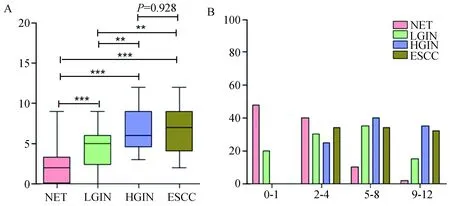
图2 ENO1蛋白在食管不同病变进展期的免疫组化评分及分布情况Fig.2 The immunohistochemical score and its distribution in different lesions of esophagus
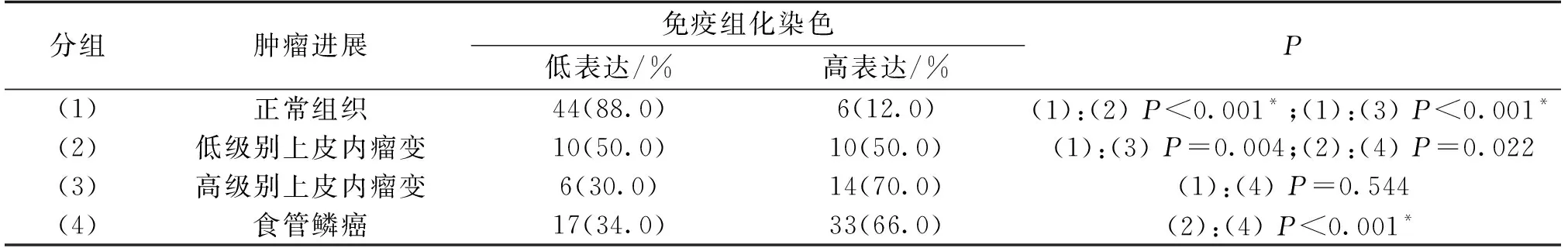
分组肿瘤进展免疫组化染色低表达/%高表达/%P(1) 正常组织44(88.0)6(12.0)(1):(2) P<0.001*;(1):(3) P<0.001*(2)低级别上皮内瘤变10(50.0)10(50.0)(1):(3) P=0.004;(2):(4) P=0.022(3)高级别上皮内瘤变6(30.0)14(70.0)(1):(4) P=0.544(4)食管鳞癌17(34.0)33(66.0)(2):(4) P<0.001*
2.2 ENO1蛋白表达与食管鳞癌患者临床病理资料的联系
按照免疫组化评分(IS),将50例ESCC分为ENO1高表达组(IS≤4)和ENO1低表达组(IS>4)。如表2所示,ENO1蛋白高表达与淋巴结转移(P=0.008)和TNM(P=0.002)分期相关,差异具有统计学意义。但是,ENO1蛋白的表达与患者的性别(P=0.524)、发病年龄(P=0.863)、分化程度(P=0.089)和浸润深度(P=0.074)等临床病理参数的关系无统计学意义。
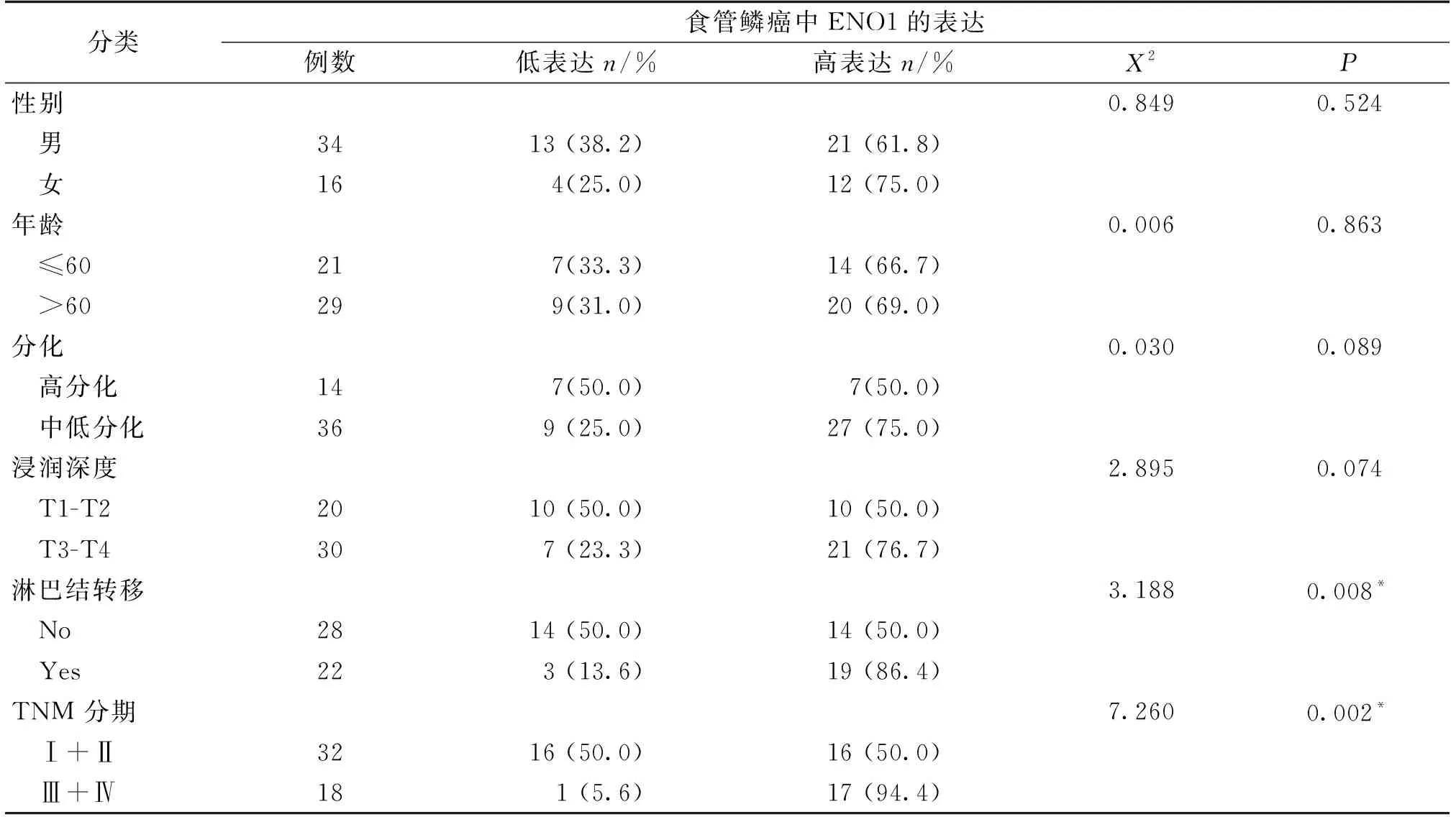
表2 ENO1蛋白与食管鳞癌患者临床病理资料的联系Tab.2 The association between ENO1 expression and clinicopathological characterisitics
2.3 ENO1蛋白表达与食管鳞癌患者预后的关系
食管鳞癌是一个多阶段的演变过程,即从食管炎症、LGIN、HGIN,最终发展为食管鳞癌[22]。因此,我们研究了ENO1在食管正常组织、食管低级别上皮内瘤变、高级别上皮内瘤变、食管鳞癌中的表达。本研究首次在食管鳞癌组织中运用免疫组化的技术检测ENO1蛋白的表达。经统计结果显示,ENO1蛋白在食管正常组织、食管低级别上皮内瘤变、食管高级别上皮内瘤变、食管鳞癌中的高表达率分别为12%(6/50)、50%(10/20)、70%(14/20)、66%(33/50)。从食管正常组织到食管低级别上皮内瘤变再到食管鳞癌,ENO1的表达逐渐增加,在HGIN达到峰值,这说明ENO1在食管癌前病变过程中就出现明显升高趋势,随着食管疾病严重程度的加深,ENO1的表达也随之升高,过表达的ENO1与食管鳞癌的进展呈显著正相关。文献报道指出,ENO1在肝癌组织中的蛋白表达和mRNA水平明显高于癌旁组织[23],神经胶质瘤中ENO1的表达高于正常脑组织[12],与我们的研究结果一致,提示ENO1在食管鳞癌发展进程中发挥重要的作用,可能成为食管早期病变的标志物。
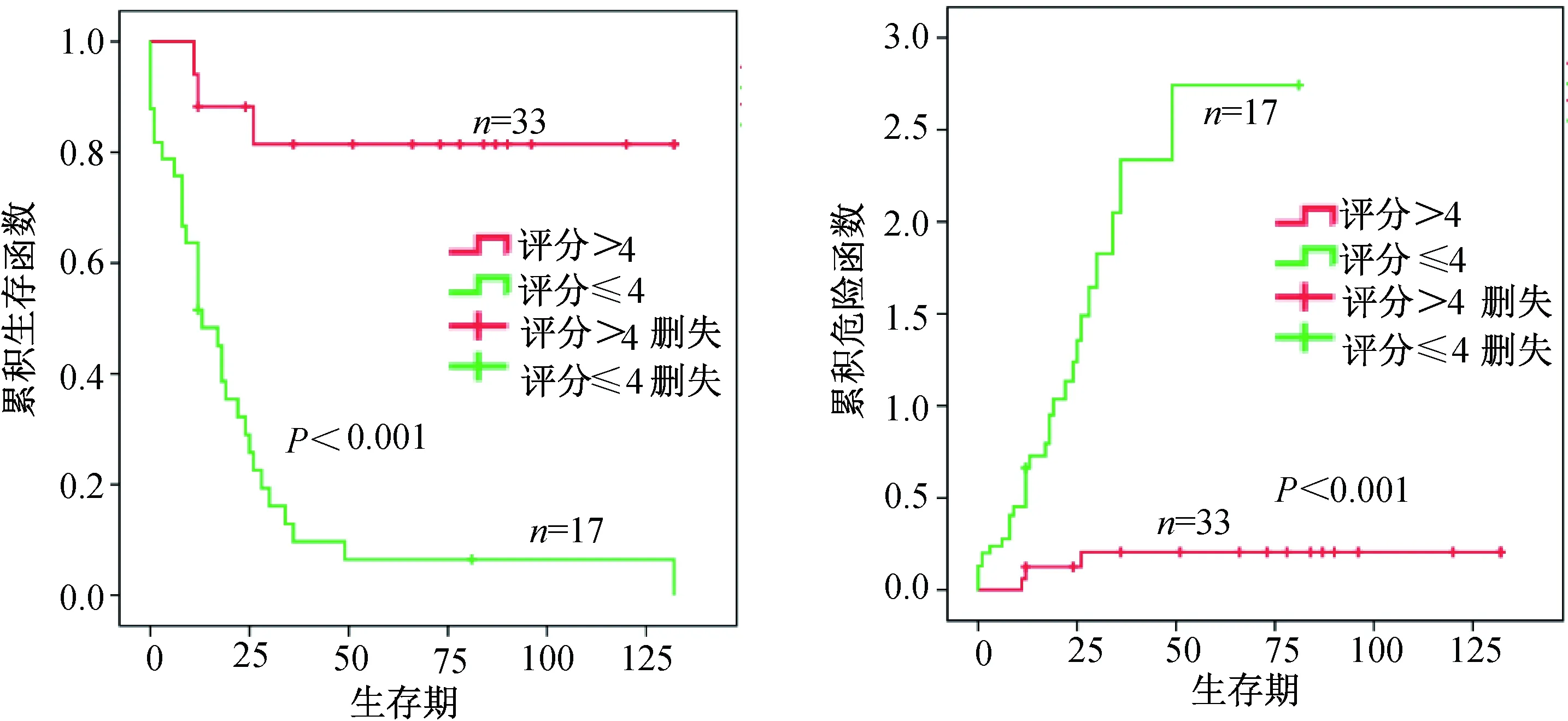
图3 ENO1蛋白的表达与食管鳞癌患者预后的生存分析Fig.3 Kaplan-Meier survival curves between ENO1 expression and ESCC patients
2.4 ENO1 在食管鳞癌细胞中的定位
在Eca109、EC9706细胞系中,运用免疫荧光染色对ENO1蛋白进行定位。结果显示,ENO1蛋白主要表达在胞浆(图4)。
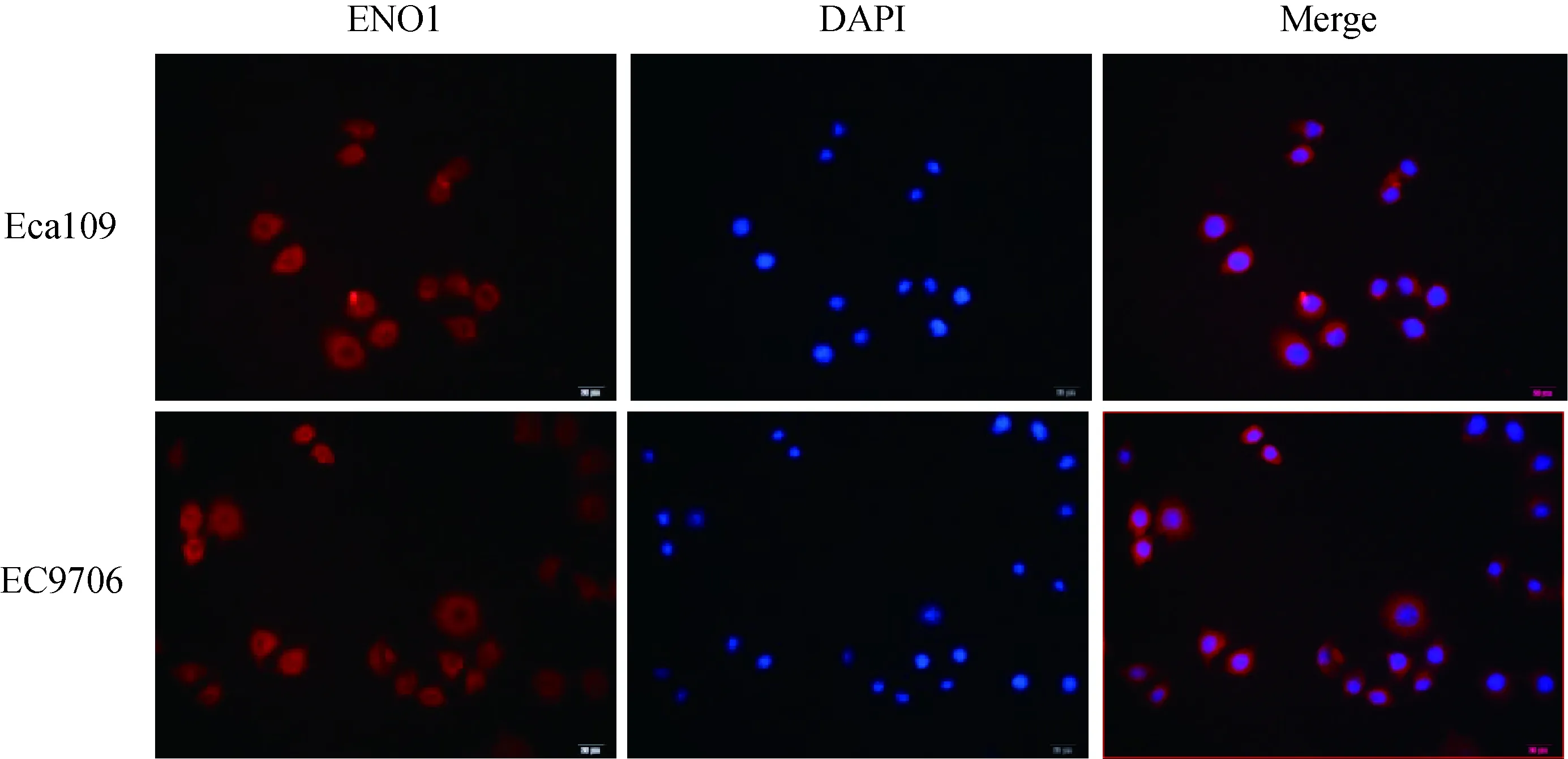
图4 食管鳞癌细胞系中ENO1蛋白的免疫荧光定位Fig.4 Immunofluorescence localization of ENO1 in ESCC cell lines
2.5 ENO1 siRNA干扰后对食管鳞癌细胞增殖和凋亡的影响
结果如图7所示,与对照组相比,转染ENO1 siRNA后,凋亡蛋白表达明显升高,提示ENO1可以抑制食管鳞癌细胞的凋亡。
结果如图5所示,转染ENO1 siRNA后,ENO1蛋白表达明显减少,80 nmol/LsiRNA作用72 h对ENO1的干扰效果最明显;用CCK8实验检测干扰ENO1后对Eca109、EC9706细胞增值能力的影响。
结果如图6所示,ENO1 siRNA处理Eca109、EC9706细胞后,与对照组相比,ENO1 siRNA处理组食管鳞癌细胞的生长明显受到抑制;我们在Eca109、EC9706细胞系中转染ENO1 siRNA后检测凋亡相关分子Bax、Caspase3的表达。
在96孔板中每孔接种3000个细胞,每组4个复孔,并在调零孔加入培养基,分别在0、24、48、72 h后每孔加入10 μL CCK8(上海同仁),37 ℃孵育两小时,用酶标仪检测450 nm处OD值,重复检测3次取均值。
分别用20、40、60、80 nmol/L浓度的ENO1 siRNA转染Eca109细胞,分别在48、72 h后检测ENO1 蛋白的表达。

图5 不同浓度siRNA转染Eca109细胞后ENO1的表达Fig.5 Expression of ENO1 transfected with various concentration of siRNA

图6 敲低ENO1表达显著降低食管鳞癌细胞的增殖活性Fig.6 Knockdown of ENO1 expression significantly reduces the proliferative activity of esophageal squamous carcinoma cells

图7 食管鳞癌细胞系中转染ENO1 siRNA后凋亡蛋白的表达Fig.7 Silencing ENO1 expression significantly reduced the proliferation activity of esophageal squamous cell carcinoma cells
3 讨论
早在1956年,德国化学家Warburg发现在肿瘤中存在一种特殊的现象-Warburg效应,即在氧充足的情况下,肿瘤中氧化磷酸化水平下降,优先利用糖酵解来产生ATP,也称为有氧糖酵解[15-16]。有氧糖酵解称为癌症的重要标志之一,它使得癌细胞在缺氧环境的早期迅速获能,以满足恶性肿瘤生长所需的生物合成和能量[16]。随着Warburg效应的提出,有氧糖酵解在肿瘤中的研究也越来越多。例如,在乳腺癌、胰腺癌细胞中沉默ENO1后可诱导癌细胞生长阻滞[17]。在肝细胞癌中,miR-125a/HK2调节细胞的能量代谢,促进糖酵解过程从而促进癌细胞的生长[18]。在膀胱癌中,miR-145通过沉默KLF4和PTBP1负向调节Warburg效应,使糖酵解过程减弱,癌细胞的生长速度明显下降[19]。总而言之,在恶性肿瘤中,糖酵解水平增强,为癌细胞的快速生长提供所需能量。目前,碘染色技术在食管癌早诊中被广泛运用。正常食管鳞状上皮中含有大量糖原,遇碘后发生反应可以变为棕红色,但是由于食管发生癌变后,细胞内的糖原含量减少,遇碘后颜色变浅或不变色[20],碘染色技术可以有效地提高食管癌早诊率。另研究表明在食管癌中存在糖代谢异常,且葡萄糖代谢受致癌基因的调控来调节糖酵解途径[21]。那么我们推断,在食管癌中可能存在糖酵解水平的异常。ENO1是糖酵解中的关键酶,我们首次研究了ENO1在食管不同病变进展期的表达,并分析ENO1与食管鳞癌患者临床病理资料的联系及生存预后,并研究了ENO1对食管鳞癌细胞增殖凋亡的影响。
通过Kaplan-Meier生存分析比较食管鳞癌患者中ENO1蛋白的表达与生存间的关系,结果如图3所示,ENO1高表达的患者生存时间明显低于低表达患者,差异具有统计学意义(P<0.001)。
企业签约服务模式的正常运转需要船舶污染物接收单位提供保障,而目前一些港口由于到港船舶少、污染物接收量少,导致船舶污染物接收单位业务来源不稳定,接收单位存在“吃不饱”或者“没饭吃”的现象。同时部分船舶污染物接收单位缺少自有仓库和出海码头。地方政府应注重船舶污染物接收处理等海洋环境保护工作的特殊性公益属性,建议相关政府部门对该类环保企业进行大力扶持,在码头、岸线的利用上给予政策支持或资金倾斜;还可考虑采取专项基金补贴、税费减免等优惠政策,扶持船舶污染物接收处置企业的经营发展。
另外,我们分析了ENO1蛋白表达与食管鳞癌患者临床病理特征的关系,分析结果显示,ENO1蛋白表达与淋巴结转移相关,ENO1蛋白在发生淋巴结转移患者中的表达高于未发生淋巴结转移的患者。此外,ENO1的表达与食管鳞癌的TNM分期 相关,其中Ⅲ+Ⅳ期的阳性率表达高于Ⅰ+Ⅱ期。与本实验结果相符,在神经胶质瘤中,ENO1蛋白的表达与TNM分期相关[12],进一步证实了ENO1高表达与食管癌的发生发展和侵袭相关。ENO1的表达与患者的性别、年龄、分化程度、浸润深度无关。有研究发现过表达的ENO1可促进非小细胞肺癌细胞的转移、侵袭和迁移能力[13]。在头颈部鳞癌中,ENO1可能是导致肿瘤侵袭和转移的重要分子[24]。根据我们的发现及其在其他不同肿瘤中确立的肿瘤促进作用,ENO1可能促进食管鳞癌患者的肿瘤进展。淋巴结转移和TNM分期是癌症进展的重要标志。此外,ENO1及其下游信号通路可能促进肿瘤的发展。有研究报道,沉默ENO1后通过使胶质瘤细胞中的PI3/Akt途径失活从而抑制细胞生长、迁移和侵袭[13]。还有研究表明,ENO1在结肠癌组织中高表达,并通过AMPK/mTOR通路促进结肠癌细胞的增殖和转移[12]。因此,ENO1的表达可能在食管鳞癌的发展中发挥重要作用。另外,我们研究了ENO1的表达与食管鳞癌患者总体生存率之间的关系,分析结果显示,ENO1高表达组的患者生存期明显低于ENO1低表达的患者(P<0.01)。与我们的研究相一致的是,在头颈部鳞癌中,ENO1高表达的患者总体生存率低于ENO1低表达患者[25]。ENO1的高表达在肿瘤的发展过程中起到了非常重要的作用,有研究显示ENO1也称为非小细胞肺癌的诊断标志物[26]。在非霍奇金淋巴瘤患者中,通过Kaplan-Meier生存分析显示,ENO1高表达与较差的总体存活率显着相关[7]。这些研究提示ENO1可能成为食管鳞癌诊断和预后的早期诊断标志物。
小学生处于低龄时期,却具有一定的好胜心。将竞赛元素融入合作学习过程中,可以让学生在团结与竞争的双重作用下参与到教学活动之中。而语文学科的竞赛活动有许多种,教师可以结合实际的教学内容来选定竞赛内容和竞赛形式,让学生在小组竞赛过程中充分展现自己的能力,激发自身的潜能,并且体验合作学习的快乐,增加对语文学习与知识探索的兴趣。比如在《精彩的马戏》的教学中,教师就可以引导学生分成几个小组,然后各自选择一种动物进行马戏的表演,比一比谁的更精彩。学生在亲自表演的过程中,可以更好地理解课文内容,并领悟马戏这一表演的精粹,与文本真正深入地进行交流,从而高效地理解与掌握文本内容。
有研究报道,ENO1除了行使糖酵解中催化酶的作用外,还可以促进肿瘤的增殖、侵袭和迁移[7,12,27]。为了研究ENO1是否促进食管鳞癌细胞的生物学行为,我们用ENO1 siRNA转染Eca109和EC9706细胞,CCK8检测食管鳞癌细胞的增殖能力,结果显示,与对照组相比,沉默ENO1后,食管鳞癌细胞的增殖能力明显受到抑制。另外,在沉默ENO1后,用Western blot检测凋亡相关分子的变化,结果显示,沉默ENO1后凋亡蛋白的表达水平明显升高,表明ENO1可以抑制食管鳞癌细胞的凋亡。分析原因可能是由于ENO1作为糖酵解中的关键酶,高表达的ENO1可以提高糖酵解水平,从而增强Warburg效应,使肿瘤细胞获取更多能量,增殖能力增强,凋亡能力减弱,从而促进肿瘤的发展。但是,ENO1是否通过提高食管鳞癌的糖酵解水平来产生肿瘤细胞生长所需的ATP,来促进食管鳞癌细胞的增殖、抑制其凋亡,需要进一步进行研究。
光谱衍射效率可以根据图的纵坐标的光强衍射强度与基准光强度的相对比值,可得到在特定波长下的光谱衍射效率,其计算公式为其中I0为原始光谱的总强度,I(为经衍射后的光谱强度,Imin为噪声强度[8]。运用MATLAB对衍射强度信息编程计算,最终得到光谱衍射效率,其部分光谱衍射效率如图9所示。
综上所述,ENO1在食管鳞癌中高表达且可以促进食管鳞癌的发生发展,表明ENO1可能作为食管鳞癌早期诊断的预后分子,然而,ENO1在食管鳞癌中的具体作用机制尚不清楚,有待于进一步研究。

