消肿止痛合剂通过VEGF-Dll4/Notch信号通路减轻大鼠血管内皮细胞缺氧损伤*
刘 涛, 何志军, 宋 渊, 李 岩, 陈 文, 李金鹏, 姚兴璋
(甘肃省中医院, 甘肃 兰州 730050)
皮瓣移植通常用于修复外伤、先天性缺陷、肿瘤切除或其它原因造成的伤口。局部皮瓣坏死是临床常见问题,尤其是皮瓣远端[1-2]。皮瓣坏死主要由血液灌注不足或再灌注损伤引起,并造成组织和血管的一些有害变化。常见的缺血因素,如手术技术和处理不当、吸烟和糖尿病,可能会危及皮瓣的生存。坏死皮瓣的处理非常耗时,需要反复更换敷料,甚至需要二次重建手术[3-4]。因此,寻找更好的药物和方法,改善皮瓣血管内皮细胞功能是提高皮瓣成活率的重中之重。中医药已经在临床广泛应用于治疗各种缺血性疾病,但对皮瓣缺血坏死目前基础研究较少[5]。本实验观察了消肿止痛合剂对体外培养大鼠皮瓣血管内皮细胞功能及血管内皮生长因子(vascular endothelial growth factor,VEGF)-Delta样配体4 (Delta-like ligand 4, Dll4)/Notch信号通路的影响,以期了解消肿止痛合剂的作用机制并对临床做出指导。
材 料 和 方 法
1 实验动物及药品
SD雌性大鼠3只,购自甘肃中医药大学动物SPF级实验中心,许可证号为SCXK(甘)2017-0025。 消肿止痛合剂由甘肃省中医院制剂科生产,生产批号为20051122。
2 试剂与仪器
抗VEGF-A、Notch和Dll4抗体(Abcam);抗β-actin 抗体(Bioworld);VEGF受体抑制剂axitinib和Notch通路阻断剂MK-0752(Selleck);HRP标记的山羊抗兔 II 抗(中山金桥);SDS-PAGE凝胶制备试剂盒、蛋白浓度测定试剂盒、RIPA 蛋白裂解液、5×SDS 上样缓冲液和脱脂奶粉(索莱宝);PI染料(Sigma)。倒置相差显微镜和荧光显微镜(OLYMPUS); 电泳仪和酶标仪(Bio-Bad);紫外分光光度计和CO2细胞培养箱(Thermo); 台式高速冷冻离心机(Heraeus);实时荧光定量PCR仪(ABI)。
3 方法
3.1大鼠皮瓣血管内皮细胞的分离与培养 取200 g 左右的SD大鼠3只,用10%的水合氯醛麻醉并脱颈处死后,浸泡于75%的乙醇30 min。于背部皮下切取血管蒂末端及其长入区,得到血管组织并将其剪为约1 mm×1 mm的碎块,置于无菌PBS缓冲液中清洗3次。将血管组织置于培养瓶中,加入5 mL 0.25%胰蛋白酶,37 ℃水浴消化15 min后,弃去上清液,沉淀用无菌PBS清洗3次后,加入0.1%的Ⅱ型胶原酶5 mL,37 ℃水浴消化15 min后,收集上清液并加入含10%胎牛血清的DMEM培养液。向沉淀中加入0.1%的Ⅱ型胶原酶5 mL,重复上述消化过程并收集合并消化液。将收集的消化液于200目细胞筛过滤,将滤液于1 000 r/min离心10 min后,弃去上清并利用含10%胎牛血清的DMEM培养液重悬细胞,将细胞置于10 cm培养皿中,于37 ℃、5% CO2的环境中培养。每3 d更换1次培养液,待细胞铺满培养皿后进行传代培养[6]。
3.2消肿止痛合剂最佳药物浓度筛选 将消肿止痛合剂利用PBS稀释后制备成药物原液,利用0.2 μm的细胞滤器过滤除菌后,以103、104、105、106和107倍稀释至终浓度,加入细胞培养液,药物处理细胞1 d、3 d、6 d和9 d后,利用CCK-8法检测细胞活力,进而获得最佳药物处理浓度。
3.3分组、给药与造模 将细胞分为对照(control)组、缺氧(hypoxia)组、缺氧+消肿止痛剂组(hypoxia+detumescence组)、缺氧+消肿止痛剂+axitinib组(hypoxia+detumescence+AXI组)及缺氧+消肿止痛剂+MK-0752组(hypoxia+detumescence+MK组)。对照组细胞以常氧条件下进行培养;其它各组放置于三气培养箱中,持续95% N2和5% CO2混合气体进行缺氧处理[7]。缺氧及药物处理不同时间后,进行后续实验研究。
3.4ELISA检测 分别设正常组、缺氧组、缺氧+消肿组、缺氧+消肿+AXI组和缺氧+消肿+MK组。将细胞以1×108/L接种于6 cm培养皿中,培养24 h后,加入相应浓度的药物及阻断剂后,将细胞置于低氧环境中进行缺氧处理,分别处理6 h、12 h、24 h和48 h后,取出细胞,弃去培养液,无菌PBS清洗3次后,每皿加入300 μL含PMSF抑制剂的蛋白RIPA裂解液,置于冰板上裂解5 min后, 12 000 r/min、 4 ℃ 离心30 min,小心地吸取收集上清液并转入新EP管中,BCA法测定总蛋白浓度。调整蛋白浓度为一致后,按照ELISA检测说明书进行操作。
3.5死细胞与活细胞的检测方法 为了判断缺氧对血管内皮细胞存活率的影响,及检测消肿止痛合剂对血管内皮细胞的保护作用,采用细胞calcein-AM和PI双染色法判断缺氧后死活细胞数量。calcein-AM的乙酸甲基酯亲脂性很高,使其可透过细胞膜,通过活细胞内的酯酶作用,calcein-AM能脱去AM基,产生的calcein(钙黄绿素)能发出强绿色荧光,因此calcein-AM仅对活细胞染色;另一方面,作为核染色染料的PI不能穿过活细胞的细胞膜,它穿过死细胞膜的无序区域而到达细胞核,并嵌入细胞的DNA双螺旋从而产生红色荧光,因此PI仅对死细胞染色。具体操作过程如下:分别设对照组、缺氧组、缺氧+消肿组、缺氧+消肿+AXI组和缺氧+消肿+MK组。将细胞以1×108/L接种于6 cm培养皿中,培养24 h后,加入相应浓度的药物及阻断剂后,将细胞置于低氧环境中进行缺氧处理,分别处理6 h、12 h、24 h和48 h后,取出细胞,弃去培养液,加入0.25%的胰蛋白酶1 mL收集细胞,1 000 r/min离心后,弃去胰酶,加入PBS重悬细胞,调整细胞浓度为2×108/L,取细胞悬浮液1 mL后,加入calcein-AM和PI染液,37 ℃孵育30 min后,取染液50 μL滴于载玻片后,加盖盖玻片封片后,置于荧光显微镜检测。活细胞为绿色,死亡细胞为红色,统计后计算细胞死亡率。
3.6Western blot实验 分别设对照组、缺氧组、缺氧+消肿组、缺氧+消肿+AXI组和缺氧+消肿+MK组。将细胞以1×108/L接种于6 cm培养皿中,培养24 h后,加入相应浓度的药物及阻断剂后,将细胞置于低氧环境中进行缺氧处理,分别处理6 h、12 h、24 h和48 h后,取出细胞,弃去培养液,无菌PBS清洗3次后,每皿加入300 μL含PMSF抑制剂的蛋白RIPA裂解液,置于冰板上裂解5 min后, 12 000 r/min 4 ℃ 离心30 min,小心地吸取收集上清液并转入新EP管中,BCA法测定总蛋白浓度。根据蛋白浓度结果调整蛋白浓度为一致后,向已提取的蛋白中加入1×上样缓冲液,沸水浴10 min。各组取含20 μg蛋白质样品,12% SDS-PAGE分离蛋白后, 将蛋白转移至PVDF膜上,加入5%的脱脂奶粉封闭2 h,孵育抗VEGFA抗体(1∶1 000)、抗DLL4抗体(1∶1 000)、抗Notch-1抗体(1∶1 000)和抗β-actin抗体(1∶2 000),4 ℃过夜。次日用4 ℃预冷的TBST摇床漂洗4次,每次8 min,加入相应的 II 抗(1 ∶1 000稀释)后,室温摇床孵育1.5 h,利用 TBST漂洗4次,每次8 min,加入发光液1 min后,将PVDF膜进行曝光,所得图片采用Image-Pro Plus 6.0 软件进行扫描,利用β-actin校准后计算相应的灰度值。
4 统计学处理
采用SPSS 19.0统计学软件进行统计分析,计量资料采用均数±标准差(mean±SD)表示,各组间是否存在差异采用单因素方差分析(one-way ANOVA)分析,方差齐者两组间的差异比较用SNK-q检验,方差不齐者两组间的差异比较用Dunnett’s 检验法,以P<0.05为差异具有统计学意义。
结 果
1 缺氧处理后细胞内VEGF含量检测结果
缺氧处理6 h和12 h后细胞内VEGF含量的差异并无统计学显著性,然而与对照组相比,当缺氧24 h和48 h后,细胞内的VEGF含量显著增加(P<0.05)。当加入消肿止痛合剂后,VEGF含量进一步增加,且显著高于缺氧组(P<0.05)。当加入VEGF阻断剂后,消肿止痛合剂引起的VEGF含量增加的趋势被有效抑制,缺氧+消肿+AXI组的VEGF含量显著低于缺氧+消肿组(P<0.05);当加入Notch阻断剂后,消肿止痛合剂引起VEGF增加的趋势更加明显,然而,缺氧+消肿组与缺氧+消肿+MK组之间的差异并无统计学显著性,见图1。
2 缺氧处理后死细胞与活细胞染色的检测结果
缺氧处理1 d后,与对照组相比,缺氧处理组死亡细胞的差异无统计学显著性;其它各组死亡的细胞与对照组比较差异也无统计学显著性。缺氧处理2 d后,与对照组相比,缺氧组细胞的死亡率显著增加(P<0.05);与缺氧组相比,缺氧+消肿组细胞的死亡率显著降低(P<0.05)。缺氧处理3 d后,缺氧引起的细胞死亡进一步增加(P<0.05),与缺氧组相比,缺氧+消肿组的细胞死亡率显著降低(P<0.05);当利用VEGF阻断剂处理后,消肿止痛合剂缓解细胞死亡的能力被阻断,与缺氧+消肿组相比,缺氧+消肿+AXI组的细胞死亡率显著增加(P<0.05)。当利用Notch阻断剂处理后,消肿止痛合剂缓解细胞死亡的能力有进一步增强的趋势,然而与缺氧+消肿组相比,缺氧+消肿+MK组的细胞死亡率差异无统计学显著性,见图2~5。
3 缺氧处理后Western blot检测结果
缺氧24 h后,缺氧后细胞内VEGF-A、Notch和Dll4 的蛋白表达量显著增加(P<0.01),当利用消肿止痛合剂处理后,VEGF-A、Notch和Dll4的表达量进一步增加(P<0.05)。然而,当加入VEGF抑制剂后,消肿止痛合剂引起的VEGF-A、Notch和Dll4表达增加的趋势被显著抑制(P<0.05);当加入Notch抑制剂后,消肿止痛合剂引起的VEGF-A 表达增加的趋势更加明显,Notch和Dll4表达增加的趋势被有效抑制(P<0.05)。缺氧处理48 h后VEGF-A、Notch和Dll4表达量的结果与24 h类似,见图6、7。

Figure 1. Detection of intracellular VEGF content after hypoxia treatment. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vshypoxia group;&P<0.05vshypoxia+detumescence group.
图1 缺氧处理后细胞内VEGF含量检测结果
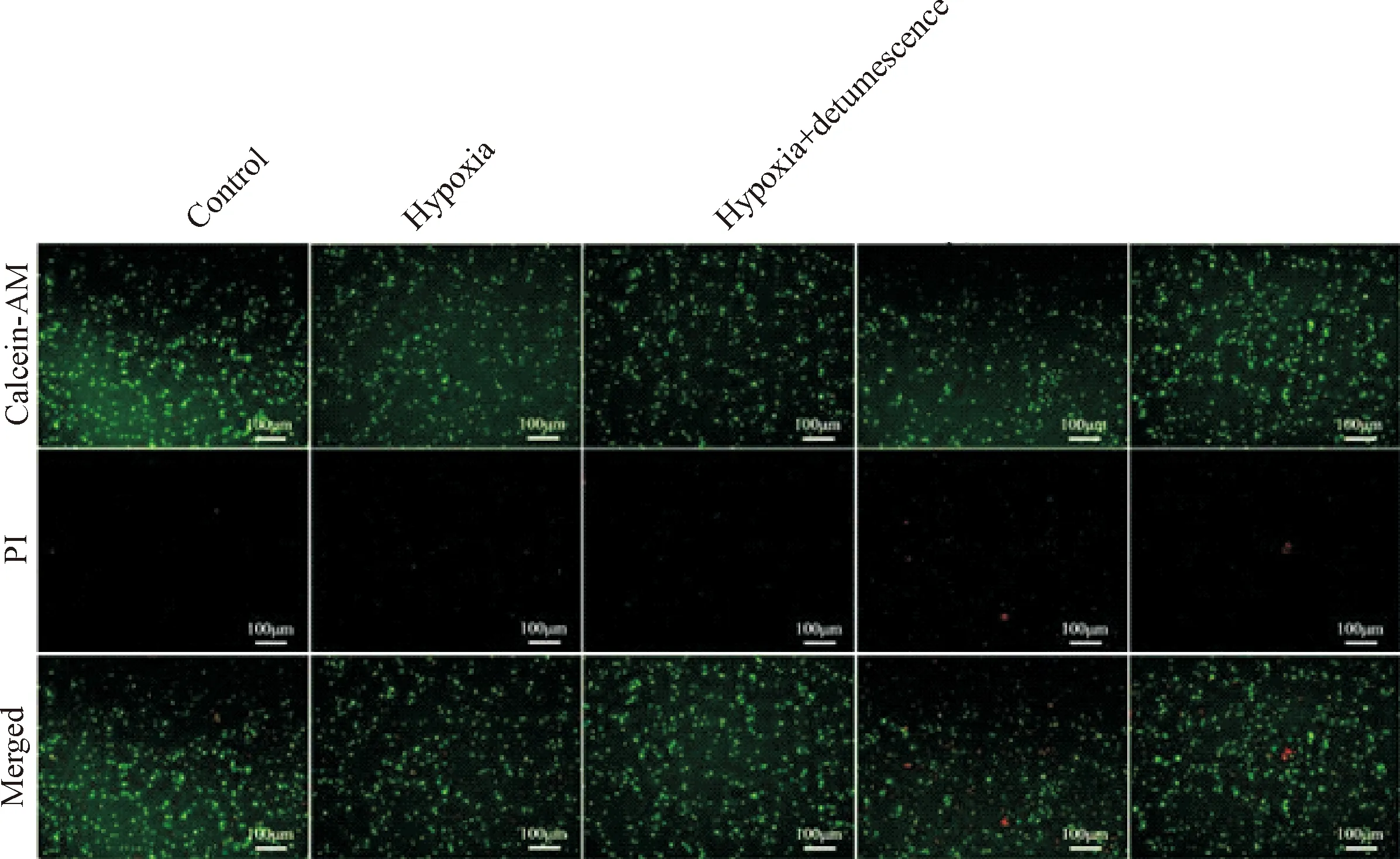
Figure 2. The staining results of dead and living cells 1 d after hypoxia treatment showed that the green cells were calcein-AM stained viable cells and the red cells were PI stained dead cells with a scale of 100 μm.
图2 缺氧处理1 d后死细胞与活细胞的染色结果
讨 论
皮瓣移植技术作为显微外科和矫形外科手术中重要的技术之一,可以有效解决皮肤大面积缺损,如开放性伤口皮肤缺损的覆盖,肿瘤切除后大创口的修复、骨髓炎以及畸形的治疗[7]。皮瓣的缺血再灌注损伤会导致其坏死,损伤模式复杂,涉及氧自由基的形成、血小板聚集、凋亡和白细胞/内皮相互作用,自由基诱导的凋亡和氧化应激是导致坏死的主要原因。减轻缺血缺氧后血管内皮损伤是防治皮瓣坏死的重要手段,也是中药治疗皮瓣坏死的作用靶点[8-9]。
消肿止痛合剂为甘肃省中医院内制剂,由李盛华教授根据多年临床经验研制,已在临床应用多年[10],由川芎、桃仁、红花、赤芍、生地、当归、三七、木香、青皮和泽兰等组成。方中君药当归、川芎活血祛瘀,消肿止痛,配桃仁、红花加强其破瘀血、生新血之力,共为臣药[11-12];合三七加强行瘀、镇痛、消肿功效;理血必先行血,气行则血行,故配合青皮、木香行气散结止痛,上三味共为佐药;辅生地、赤芍凉血消瘀。损伤早期组织处痉挛疼痛,有渗出、水肿病理变化,故配泽兰消散痈肿,减少其渗出,促使肿胀消退,诸药合用,共奏活血化瘀、消肿止痛之功。组方中的川芍、红花、赤芍和三七等药物均有单体实验研究证明对血管有保护作用并具有抗凝作用,有研究证明川芎提取物川芎嗪可扩张血管、增加冠脉血流及脑血流、抑制血小板聚集和降低血小板活性,为一种钙拮抗剂。
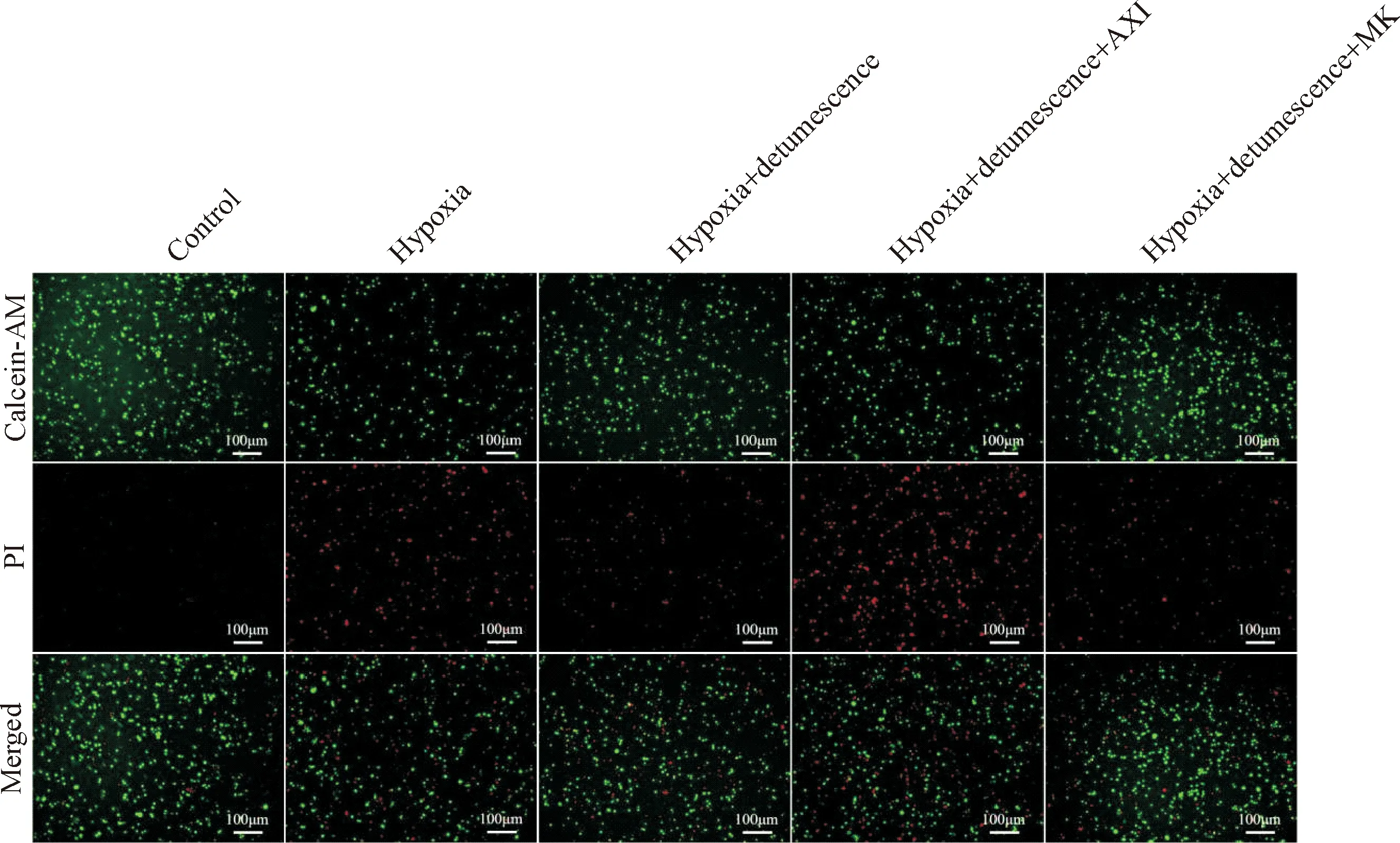
Figure 3. The staining results of dead and living cells after 2 d of hypoxia treatment showed that the green was calcein-AM stained viable cells and the red was PI stained dead cells with a scale of 100 μm.
图3 缺氧处理2 d后死细胞与活细胞的染色结果
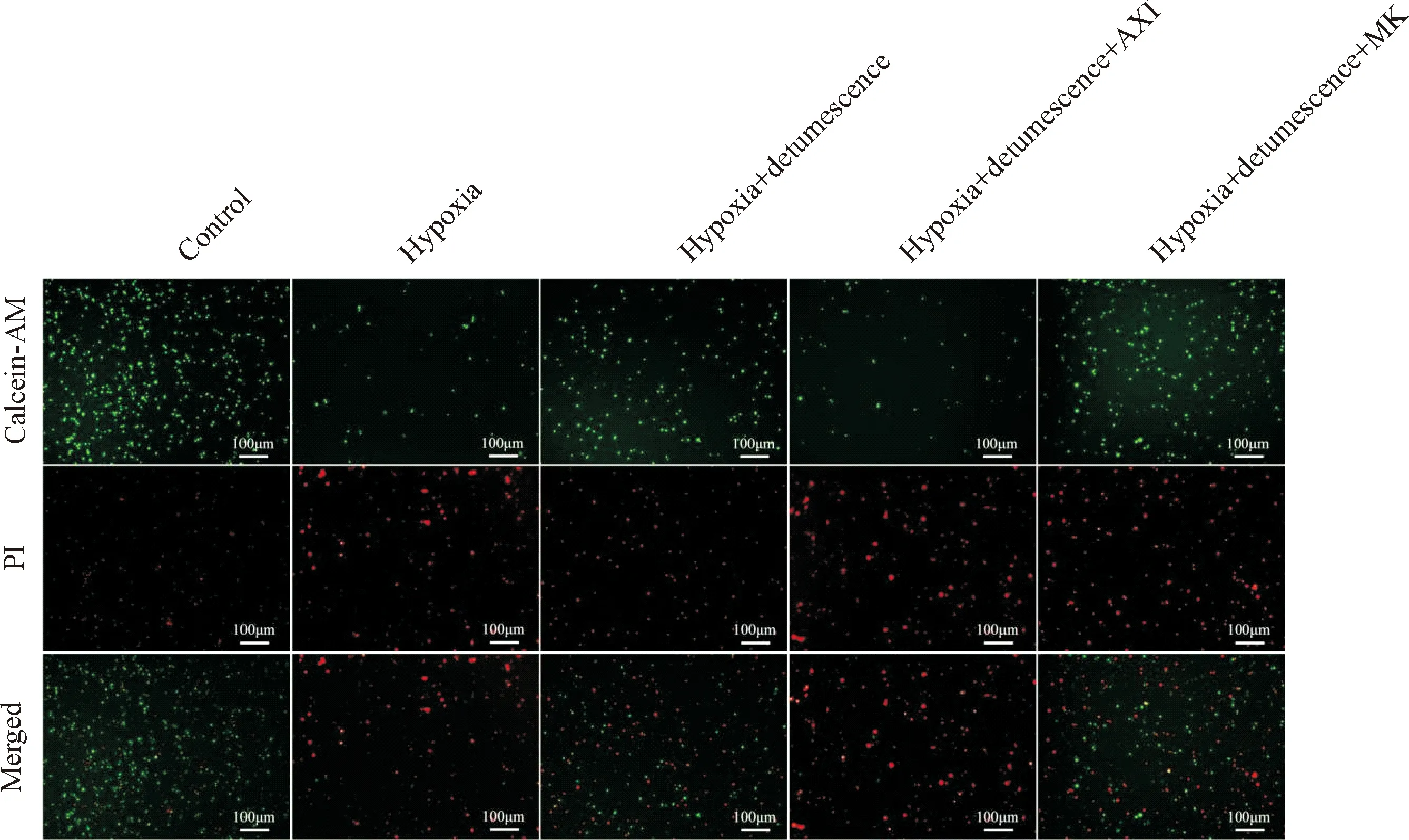
Figure 4. The staining results of dead and living cells after 3 d of hypoxia treatment showed that the green was calcein-AM stained viable cells and the red was PI stained dead cells with a scale of 100 μm.
图4 缺氧处理3 d后死细胞与活细胞的染色结果
VEGF是目前发现最强的促血管再生的细胞因子,能够促进缺血皮瓣的血运重建,从而提高皮瓣的存活率。在皮瓣中,VEGF由角质形成细胞和表皮成纤维细胞分泌,在皮肤血管结构中尤其活跃。此外,低氧角质形成细胞合成编码VEGF-121和VEGF-156的mRNAs,这些可溶性亚型通过几个细胞层和基底层扩散到目标(真皮血管内皮表面的受体)。Notch信号通路能够调控和维持正常胚胎发育组织稳态以及成体组织中的干细胞。研究发现,Notch信号通路在内皮细胞特化为顶端细胞和柄细胞的过程中起到重要调控作用[13-14]。Notch信号通路由细胞膜上表达的Notch受体、Notch配体(Dll4)及下游信号分子组成。Notch在柄细胞中的活性很高,而在顶端细胞中呈低水平表达;相反,Dll4在顶端细胞中表达较高。在血管生成中VEGF作为关键驱动因素,而 Notch信号有助于适当地协调响应[15-17]。作为血管形成正向调节因子的VEGF,通过诱导VEGF-A的表达而启动Dll4/Notch信号作为负反馈调节因素,有效预防过量血管的形成,因此,血管再生是在VEGF和Dll4/Notch信号系统的协同作用下共同完成的结果[18-19]。本研究结果表明,消肿止痛合剂可以明显上调VEGF-A、Notch和Dll4 mRNA的表达,激活VEGF-Dll4/Notch信号通路,降低细胞死亡率;为了证实消肿止痛合剂是通过VEGF-Dll4/Notch信号通路减轻缺氧所致大鼠皮瓣血管内皮细胞损伤,实验进一步采用VEGF受体抑制剂和Notch通路阻断剂干预细胞,结果显示,VEGF受体抑制剂可引起VEGF-A、Notch和Dll4蛋白表达增加的抑制,Notch通路阻断剂引起Notch和Dll4蛋白表达增加的趋势被有效抑制,VEGF-A蛋白表达继续增加。这些结果表明,消肿止痛合剂可显著增加细胞内VEGF的含量,从而在缺氧环境中对血管内皮细胞起到保护作用,然而VEGF进一步增加会引起细胞内Dll4-Noth含量的增加,进而抑制VEGF过度表达,引起血管过度生长。因此,调控VEGF-Dll4/Notch通路各分子的表达成为皮瓣缺血治疗的一种新途径[20]。
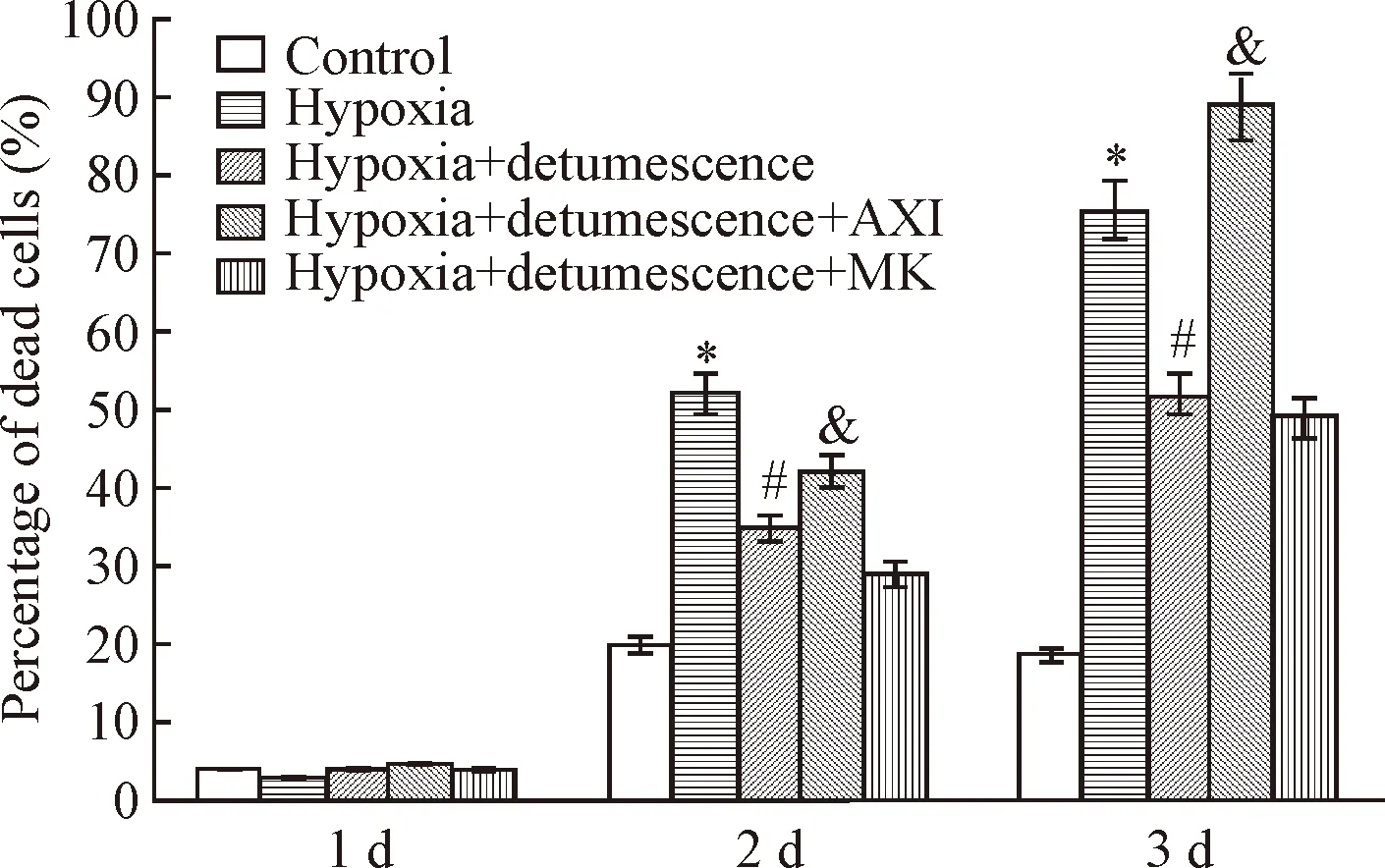
Figure 5. Statistical results of dead cells after hypoxia treatment. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vshypoxia group;&P<0.05vshypoxia+detumescence group.
图5 缺氧处理后死细胞的统计结果
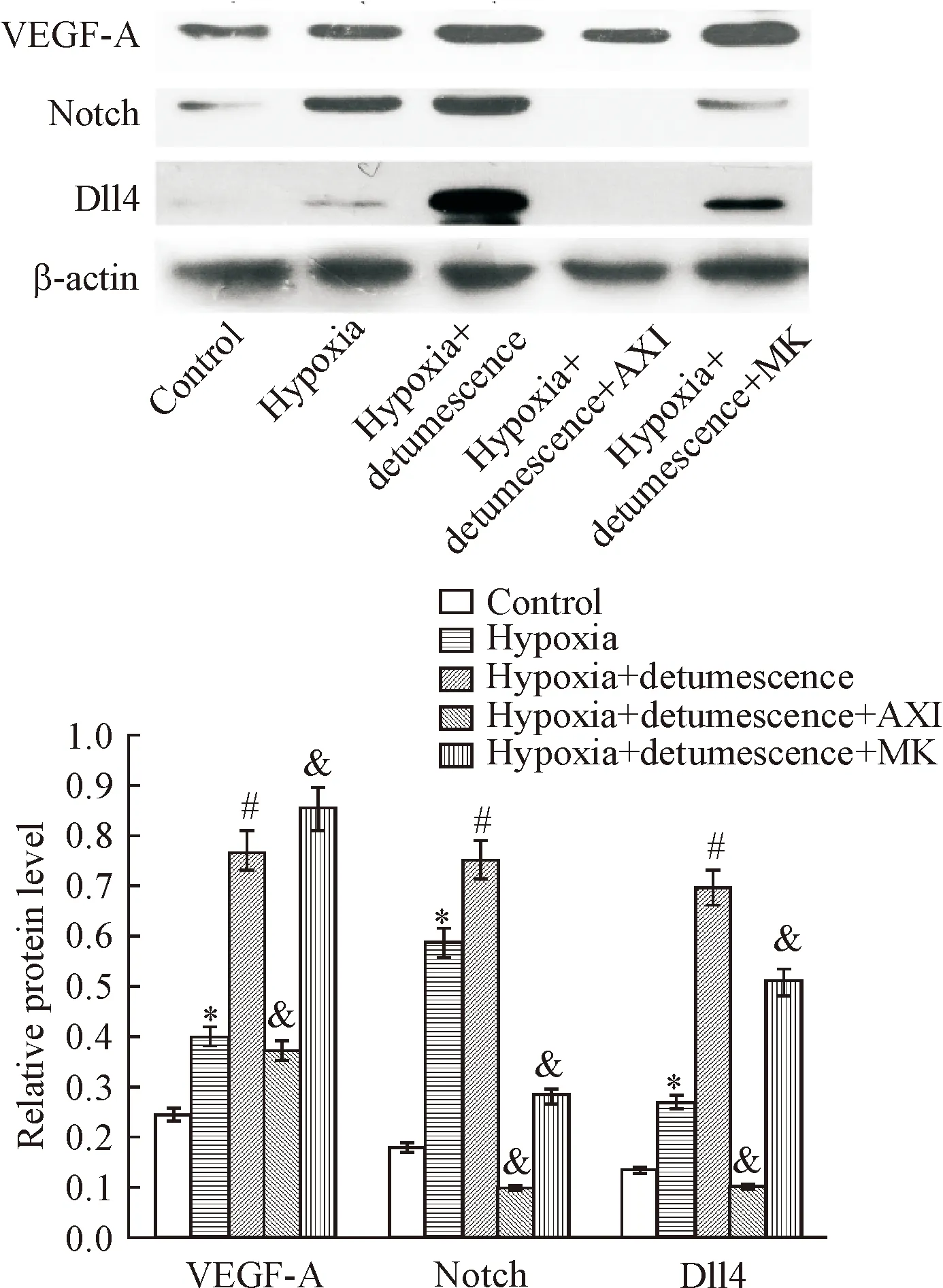
Figure 6. The protein expression of VEGF-A, Notch and Dll4 in cells after 24 h of hypoxia treatment. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vshypoxia group;&P<0.05vshypoxia+detumescence group.
图6 缺氧处理24 h后细胞VEGF-A、Notch和Dll4蛋白表达结果
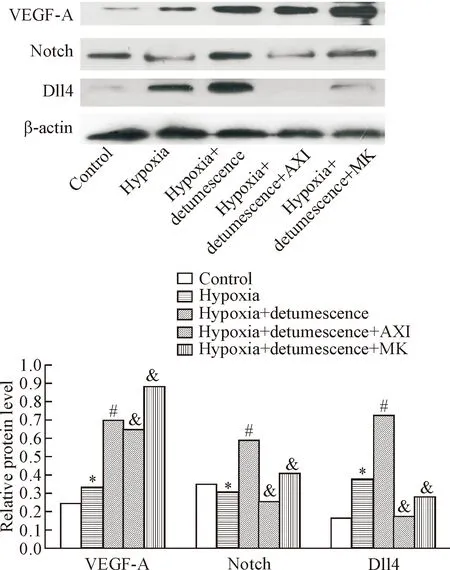
Figure 7. The protein expression of VEGF-A, Notch and Dll4 in cells after 48 h of hypoxia treatment. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vshypoxia group;&P<0.05vshypoxia+detumescence group.
图7 缺氧处理48 h后细胞VEGF-A、Notch和Dll4蛋白表达结果
本实验结果显示,消肿止痛合剂能减轻由缺氧所致大鼠皮瓣血管内皮细胞损伤,抑制血管内皮细胞死亡,上调VEGF-A、Notch和Dll4的蛋白表达,推测其可能是通过调控VEGF-Dll4/Notch信号转导通路来发挥治疗作用。其具体作用机制还有待进一步研究。

