肿瘤免疫治疗的研究现状及应用
王贝茹 张思远 魏陈秋
【摘要】 与以往通过常规手术、放疗、化疗不同,肿瘤免疫治疗是一种通过激活机体自身免疫系统来对抗肿瘤的治疗方式。近年来,抗肿瘤免疫因其疗效显著而备受瞩目。目前,抗肿瘤免疫治疗已包括多种治疗策略,主要有免疫检查点抑制疗法、过继免疫细胞治疗、肿瘤疫苗等多种治疗手段,是较为经典且值得深入研究的科研方向。因此,本文对临床应用较为经典的肿瘤免疫疗法的研究现状及应用加以概括和评述。
【关键词】 免疫治疗; 免疫检查点抑制; 过继免疫细胞疗法; 肿瘤疫苗
doi:10.14033/j.cnki.cfmr.2019.22.079 文献标识码 A 文章编号 1674-6805(2019)22-0-03
【Abstract】 Different from conventional surgery,radiotherapy and chemotherapy,tumor immunotherapy is a method of anti-tumor therapy by activating the bodys autoimmune system.In recent years,anti-tumor immunity has attracted much attention because of its remarkable effect.At present,anti-tumor immunotherapy has included a variety of treatment strategies,including immunological checkpoint inhibition therapy,adoptive immune cell therapy,tumor vaccine and other treatment methods,which is a more classical and worthy of further research direction.Therefore,the research current situation and application of classical tumor immunotherapy in clinic are summarized and reviewed.
【Key words】 Immunotherapy; Immune checkpoint inhibitors; Adoptive immunotherapy; Tummor vaccine
First-authors address:Wannan Medical College,Wuhu 241000,China
近年來,恶性肿瘤的发病率逐年提高,对人类的健康产生威胁。传统的治疗方法首要包括手术、放疗、化疗,但这三种治疗方式除直接杀伤肿瘤细胞以外,也对人体的正常组织细胞造成难以控制的损伤,使得肿瘤患者在治疗过程中要承受很大的痛苦,且治疗效果欠佳。因此,许多国内外医学和科研工作者在孜孜不倦地寻求一种新的治疗方法来弥补传统治疗上的不足。随着近代生物化学、医学免疫学、细胞分子生物学等有关学科理论和应用的迅速发展,肿瘤免疫治疗的临床应用得到了深入研究,为肿瘤患者的治疗带来新的希望。而应用当前的肿瘤免疫疗法主要包括靶向免疫检查点治疗、过继性免疫细胞疗法以及肿瘤疫苗等多种方法[1]。因肿瘤免疫治疗手段具有较高的疗效性和安全性,其已经成为国内外肿瘤治疗领域当中颇具研究前景的方向之一。本文就经典抗肿瘤免疫疗法的研究现状及应用进行综述,以期能够为相关研究提供新的思路。
1 肿瘤免疫治疗的研究现状
肿瘤免疫治疗是指通过激活机体的细胞免疫系统和体液免疫系统的内在能力,从而直接靶向攻击肿瘤细胞,达到控制肿瘤发展和杀灭肿瘤的目的。借此,肿瘤免疫治疗成为继手术治疗,放疗和化疗之后的一种新型治疗方法[2]。这种疗法同时联合手术、放疗、化疗等治疗手段可以明显提高恶性肿瘤患者的存活率,在实践中呈现出常规放化疗方法无可比拟的优势。
美国科学家詹姆斯·艾利森(James P Allision)和日本免疫学家本庶佑(Tasuku Honjo)教授在2018年被授予诺贝尔生理学或医学奖,以表彰他们在癌症免疫治疗方面所做出的贡献,他们的研究发现创立了癌症疗法的一个全新理念,给肿瘤患者带来了生存的希望[3]。目前,肿瘤免疫治疗在黑色素瘤、卵巢癌、结直肠癌、肺癌等恶性肿瘤的治疗中都已经取得了重大突破[4-5]。
近年来,随着国际上肿瘤免疫治疗水平的快速发展,我国也随之进入了研究抗肿瘤免疫治疗的热潮[6]。在国内应用于临床的肿瘤免疫疗法中,主要有:抗体靶向治疗药物、肿瘤疫苗、过继免疫细胞疗法等治疗手段。但由于我国起步较晚,肿瘤免疫治疗水平与国外相比仍有较大进步空间。例如:针对免疫检查点的靶向治疗目前尚缺乏与之相关的临床数据,过继免疫细胞回输治疗规模几乎均局限于实验室层面,而对于肿瘤疫苗相关的临床研究仍亦缺乏大量的能够佐以证明的临床研究数据[7];另外,对于如何增强肿瘤疫苗的免疫原性、如何制备同时激活CD4+T细胞与CD8+T细胞的肿瘤疫苗、如何克服肿瘤的免疫逃逸、如何结合不同的免疫效应细胞以获得高效免疫应答等[8],都是肿瘤免疫治疗急需解决的问题。
2 肿瘤免疫治疗的主要分类
2.1 免疫检查点治疗
通过阻断肿瘤免疫检查点的方法是近年来治疗癌症较为有效的策略之一,现已经成为肿瘤研究和治疗领域的热点。随着免疫学等相关学科研究的逐渐发展,人们发现T细胞表面具有许多的共刺激分子和共抑制分子,共同精准调控T细胞的活化[9]。靶向免疫检查点治疗的基本原理就是通过采用共抑制分子或配体的拮抗剂以及其他药物来阻断信号通路,解除肿瘤患者的免疫抑制,进而刺激细胞毒性T细胞的活化,增强其杀伤肿瘤细胞的能力[10]。在2018年诺贝尔医学奖得主发现免疫检查点疗法以前,其临床发展的进展都不大,但是目前关于“免疫检查点疗法”的新型应用,从根本上改变了我们对如何治疗癌症的看法。
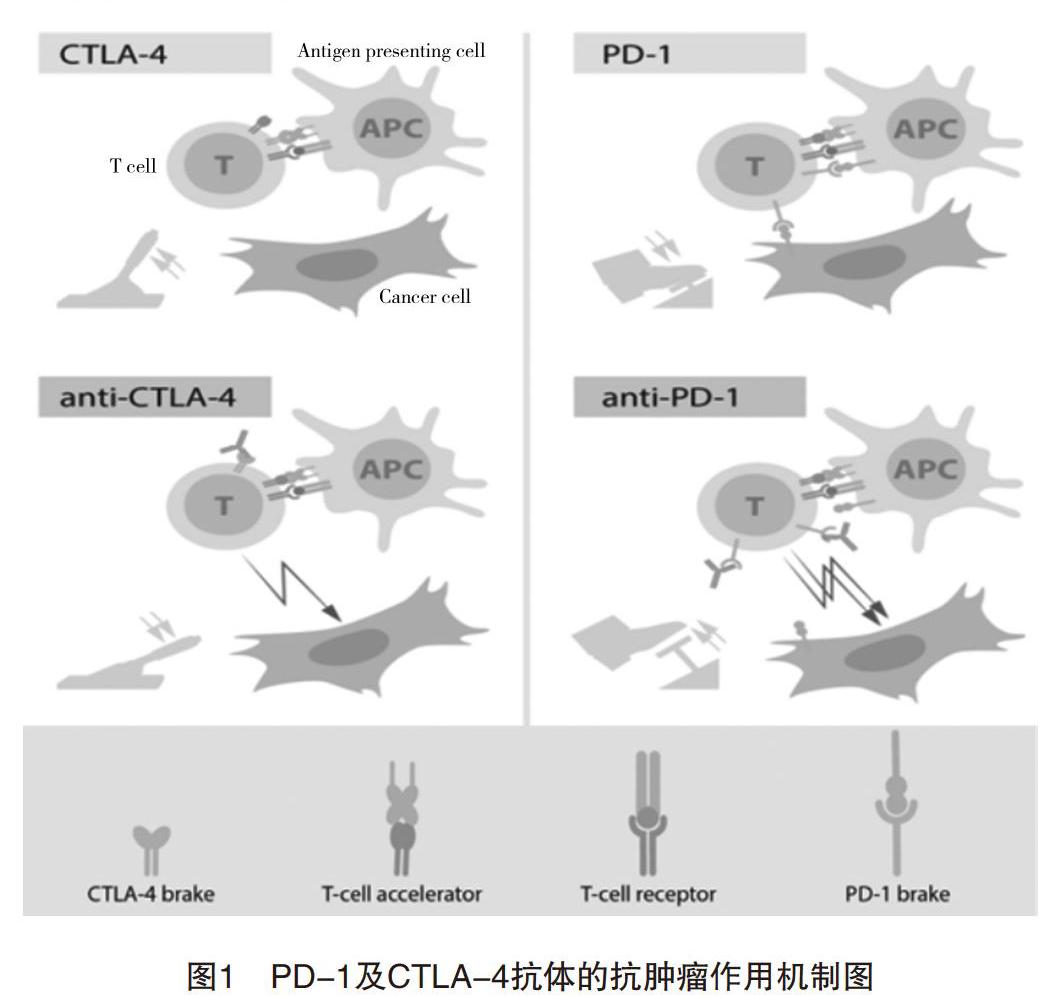
众所周知,死亡程序受体1(programmed cell death 1 receptor,PD-1)和细胞毒T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)是目前研究较多的免疫检查点,而且PD-1/PD-L1(programmed death-ligand 1,PD-L1)疗法已经在晚期黑色素瘤、肺癌、膀胱尿路上皮癌、胃癌等多种肿瘤的治疗中取得显著临床进展[11]。PD-1在肿瘤浸润性淋巴细胞(TILs)等活化的T淋巴细胞表面可高表达,而在未活化的初始T细胞表面几乎不表达,其被视作一种T细胞制动器,可以与癌细胞表面的配体PD-L1结合,减少TNF-a、IL-6等细胞因子的产生,从而进一步抑制细胞毒性T细胞杀伤肿瘤细胞的能力;与此同时,还会减少T淋巴细胞的生存寿命,最终抑制T细胞介导的细胞免疫反应[12-13]。CTLA-4也是一种表达于活化T细胞表面的发挥抑制作用的免疫调节性受体,其抗肿瘤作用机制与PD-1类似[14],主要概述为:CTLA-4作为另外一种T细胞制动器,可以抑制T细胞的活化,CTLA-4阻断剂通过阻断CTLA-4从而重新活化T细胞,活化的T细胞能够有效地攻击癌细胞,而CTLA-4阻断剂又是通过抑制CTLA-4与CD80或CD86分子的结合阻断抑制性信号通路的,维持了T细胞的增殖与活化状态。由此看来,PD-1/PD-L1及CTLA-4等免疫检查点的抑制性免疫调节作用,就等同于“开车踩油门的同时也在踩刹车”,因此,如能通过药物阻断该信号通路就等同于“松开刹车后汽车前进得更快”,可以显著抑制肿瘤的发展[15]。两位获奖者的发现就是通过松开免疫细胞的刹车使人得以利用自身免疫系统来攻击癌细胞(图1)[3]。
目前,关于CTLA-4抗体和PD-1抗体的联合疗法,也已经有多项临床试验正在进行。初步试验结果表明双抗联合治疗的有效率及生存期得到全面提高,并且治疗效果优于PD-1或CTLA-4单独的使用;也有资料表明,PD-1抗体联合CTLA-4抗体,将在不久后获得批准,成为中危、高危患者全新的首选治疗方案。
2.2 过继性免疫细胞治疗
肿瘤的过继性免疫治疗(adoptive cellular immuno-therapy,ACI)是近十多年肿瘤免疫治疗中较为活跃的研究领域[16],其主要原理是将自体或异体的免疫效应细胞在体外诱导分化、修饰、扩增,把筛选出的具有抗肿瘤活性的效应细胞回输给患者体内,达到治疗患者体内肿瘤细胞的目的[17],此类疗法包括淋巴因子激活的杀伤细胞(lymphokineActivated killer,LAK)、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)、树突状细胞(dendritic cell,DC)、细胞因子诱导的杀伤细胞(cytokine induced killer,CIK)、自然杀伤细胞(natural killer,NK)、T细胞受体(T cell receptor,TCR-T)、嵌合抗原受体(chimeric antigen receptor,CAR-T)等[18-19]。因为具有特异性高、对机体产生的不良反应小等特点,目前已在多种恶性肿瘤及血液病的治疗中取得显著效果[20-21]。此外,ACI对机体免疫功能低下的患者,如大剂量放疗、化疗、病毒感染所导致的免疫细胞数量下降及免疫功能受损的患者更为适合[22]。
2.3 肿瘤疫苗
肿瘤疫苗的原理是通过肿瘤细胞、肿瘤相关蛋白或者多肽及表达肿瘤抗原的核酸等,将肿瘤抗原引入患者体内,借此,激活机体T细胞和B细胞以识别并作用于特定类型的肿瘤细胞,从而达到抑制肿瘤细胞生长、转移和复发的目的[23]。如今其已在治疗黑色素瘤、肺癌和卵巢癌等实体瘤中取得较为理想的临床效果[24]。根据肿瘤疫苗的临床应用可以将其分为两类:一类是预防性肿瘤疫苗,可以降低或消除肿瘤的发病率,现已研发出的是宫颈癌疫苗。另一类是治疗性肿瘤疫苗,较多应用于肿瘤治疗,又可与手术、放疗和化疗等相結合用于肿瘤的辅助治疗。而根据来源和构建载体的不同,肿瘤疫苗可划分为肿瘤抗原肽段、基因修饰多肽疫苗、质粒DNA疫苗、病毒及细菌载体疫苗和树突状细胞疫苗等[25]。但肿瘤疫苗免疫原性较低,常常需要寻找合适的免疫佐剂联合使用以增加诱导机体免疫应答的成功率,因此肿瘤疫苗仍有很大的进步空间。
3 小结与展望
抗肿瘤免疫疗法在恶性肿瘤治疗中取得了理想的效果,但仍可能会面临诸多疑难和困惑,其原因在于目前对于肿瘤免疫的机制了解还不够透彻,今后研究还需要揭示新的细胞、分子及调控机制。随着更多临床经验的积累和科学研究的进一步开展,我们期待对肿瘤免疫疗法的认知有更加深层次的认知,并且有理由相信,这种新颖的治疗方法可以更加安全、更加有效、适用范围更加广泛地应用于肿瘤患者,从而成为真正意义上的新型疗法。
参考文献
[1]陈祥,钱程,曹雪涛.肝细胞癌的免疫逃逸和免疫治疗研究热点与发展趋势[J].中国肿瘤生物治疗杂志,2017,24(1):73-82.
[2]许标波,贺毅憬,王韦力,等.肿瘤免疫检查点抑制剂临床治疗的研究进展[J].中国临床药理学与治疗学,2016,21(2):218-224.
[3]李丹,王晓霞,李斌.免疫疗法可望治愈肿瘤——解读2018年诺贝尔生理学或医学奖[J].自然杂志,2018,40(6):21-24.
[4] Yao S,Zhu Y,Chen L.Advances in targeting cell surface signalling molecules for immune modulation[J].Nature Reviews Drug Discovery,2013,12(2):130-146.
[5] Padmanee S,James P A.The future of immune checkpoint therapy[J].Science,2015,348(6230):56-61.
[6]韩岩梅,曹雪涛.准确把握肿瘤免疫治疗发展趋势,促进我国肿瘤免疫治疗规范健康发展[J].中国肿瘤生物治疗杂志,2017,24(1):2-5.
[7]任军,黄红艳.靶向免疫检查点的肿瘤免疫治疗现状与趋势[J].中国肿瘤临床,2014,(7):415-419.
[8]王旻钰,单风平.肿瘤免疫治疗的研究现状[J].微生物学杂志,2015(2):98-102.
[9]郭静,曲鑫建,伍会健.肿瘤免疫疗法中免疫检查点的研究进展[J].生理科学进展,2017,48(4):287-293.
[10]田宏,金锷,郭晓钟,等.免疫检查点抑制剂治疗胰腺癌的进展[J].中华胰腺病杂志,2018,18(6):420-423.
[11]任中华.PD-1/PD-L1在结直肠癌中的研究进展[J].中国肿瘤生物治疗杂志,2017,24(10):1134-1138.
[12] Fife B T,Pauken K E,Eagar T N,et al.Interactions between PD-1 and PD-L1 promote tolerance by blocking the TCR-induced stop signal[J].Nature Immunology,2009,10(11):1185-1192.
[13] Mary E K,Spencer C L,Indira G,et al.Tissue expression of PD-L1 mediates peripheral T cell tolerance[J].The Journal of Experimental Medicine,2006,203(4):883-895.
[14] Buchbinder E I,Desai A.CTLA-4 and PD-1 Pathways:Similarities,Differences,and Implications of Their Inhibition[J].American Journal of Clinical Oncology,2016,39(1):98-106.
[15]李汉忠,张玉石,郑国洋.肿瘤免疫治疗:回顾与展望[J].协和医学杂志,2018,9(4):289-294.
[16]陈勇伟,王坚.肿瘤过继性细胞免疫治疗[J].医学研究杂志,2014,43(9):161-165.
[17]刘建成,马洁.肿瘤免疫治疗的研究进展[J].癌症进展,2014,41(6):518-521.
[18] Tran E,Robbins P F,Lu Y C,et al.T-Cell Transfer Therapy Targeting Mutant KRAS in Cancer[J].New England Journal of Medicine,2016,375(23):2255-2262.
[19] Beatriz M,Carreno V,Magrini M,et al.Cancer immunotherapy:A dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen-specific T cells[J].Science,2015,348(6236):803-808.
[20] Schmeel F C,Schmeel L C,Gast S M,et al.Adoptive Immunotherapy Strategies with Cytokine-Induced Killer(CIK) Cells in the Treatment of Hematological Malignancies[J].International Journal of Molecular Sciences,2014,15(8):14632-14648.
[21] Riddell S R,Sommermeyer D,Berger C,et al.Adoptive Therapy With Chimeric Antigen Re0eptor-Modified T Cells of Defined Subset Composition[J].The Cancer Journal,2014,20(2):141-144.
[22] Courtney Humphries.Adoptive cell therapy:Honing that killer instinct[J].Nature,2013,504(7480):S13-S15.
[23] Giuroiu I,Weber J.Novel Checkpoints and Cosignaling Molecules in Cancer Immunotherapy[J].The Cancer Journal,2017,23(1):23-31.
[24]衛丽,马萍.肿瘤疫苗临床试验研究现状[J].中华肿瘤防治杂志,2014,21(5):395-400.
[25]司春枫,鲁美钰,周玲,等.肿瘤疫苗免疫策略研究进展[J].现代肿瘤医学,2016,24(15):2478-2482.
(收稿日期:2019-03-28) (本文编辑:郎序莹)

