再议电解质溶液中的竞争反应
刘 宇
(四川省泸县二中 646106)
竞争反应是指在一个体系中,如果两个化学反应都有可能发生,并且消耗的反应物有相同的,那么两个反应为竞争反应.竞争反应实际是对底物的争夺.电解质溶液中的这些竞争反应往往是不均等的,由于性质的差异有的是先后进行反应,有的是主次差异反应.
一、复分解反应之间的竞争
溶液中的复分解反应,即是溶液中反应物电离出离子的重新组合过程,离子重新组合后生成沉淀、气体、水等弱电解质,均导致溶液中离子的总浓度下降.
例1 (2015年福建高考节选)25℃,两种酸的电离平衡常数如表:

Ka1Ka2H2SO31.3×10-26.3×10-4H2CO34.2×10-75.6×10-11
H2SO3溶液和NaHCO3溶液反应的主要离子方程式为____.




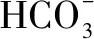
二、氧化还原反应之间的竞争
在体系中,多个氧化剂与多个还原剂发生氧化还原反应时,氧化(还原)性强者先发生反应,反应完后氧化(还原)性次之的紧接着反应,以此类推直至氧化(还原)剂反应完全为止.
例2 向含S2-、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( ).


答案:C
解题思路还原性:S2->I->Fe2+>Br-,所以发生反应的顺序:




知识积累单质的氧化(还原)性规律与对应阴(阳)离子的还原(氧化)性相反.即可依据金属活动性顺序表金属单质还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>Cu>Hg>Ag>Pt>Au,对应阳离子氧化性:K+ 例3 AgNO3是中学化学常见试剂,已知:AgNO3见光易分解,Ksp(AgI)≈1×10-16,Ksp(AgCl)=1.8×10-10. 有同学认为:Ag+有较强的氧化性,I-有较强的还原性,两者混合应发生氧化还原反应: (1)则相应的离子反应方程式为:____. (2)而实验中未观察到相应现象,你认为原因是:____,如何设计实验证明两者能发生氧化还原反应:____. (2)两种溶液混合后先生成沉淀,使得Ag+和I-浓度降低,降低Ag+和I-的氧化性和还原性(或者Ag+和I-发生的反应程度较低);设计以石墨为电极,两侧分别装KI和AgNO3电解液,以盐桥相连的原电池(加入淀粉) 解题思路(1)氧化剂Ag+被还原成Ag,还原剂I-被氧化成I2,依据氧化还原反应方程式的配平原则即可配平离子方程式; (2)结合上述信息可知,Ag+与I-可发生沉淀反应与氧化还原反应的竞争反应,但实验现象表明氧化还原反应并不显著,即该反应后于沉淀反应发生,导致Ag+和I-浓度降低,降低Ag+和I-的氧化性和还原性降低反应程度或者本身Ag+和I-的沉淀反应为主反应,氧化还原反应为次反应;结合分析,可将该体系设置成原电池反应,将Ag+和I-隔离,去除沉淀反应,即可发生氧化还原反应,或者结合生成的I2量少,加入淀粉确定其生成. 解题技巧在本题的解答中,题干信息只是表明Ag+和I-之间的沉淀反应和氧化还原反应存在竞争关系,同时氧化还原反应进行的程度不高,但并未指明该竞争反应的发生是先后关系还是主次关系,因此提供合理的解释均可,题目属于开放性试题. 电解质溶液中电极周围可能存在多个粒子能在电极上得失电子完成放电,一般认为得失电子能力强者先于放电反应. 例4 已知:放电顺序:Ni2+(高浓度)>H+>Ni2+(低浓度).工业上处理含镍酸性废水并得到单质 Ni 的原理如图所示.下列说法不正确的是____. A.碳棒上发生的电极反应: B.为了提高 Ni 的产率,电解过程中需要控制废水 pH C.电解过程中,B 中 NaCl 溶液浓度将不断增大 D.若将图中阳离子膜去掉,将 A、B 两室合并,电解反应总方程式不会发生改变 解题思路题干中明确的“放电顺序:Ni2+(高浓度)>H+>Ni2+(低浓度)”就是几率问题的具体呈现,在电解质溶液中一般认为放电顺序为H+>Ni2+(低浓度),但当c(Ni2+)较大[远大于溶液中c(H+)]时,Ni2+阻挡了H+与电子的接触,此时Ni2+先于H+放电.结合图示,碳棒为阳极(失电子),即是由OH-失电子形成O2,A项正确;结合上述分析,当溶液中c(H+)>c(Ni2+)时,H+先放电,因此必须控制溶液pH,保证c(Ni2+)>c(H+),B项正确;A池中由于OH-放电阴离子浓度下降,Na+通过阳离子膜进入B池,同理C中Cl-通过阴离子膜进入B池,B 中 NaCl 溶液浓度将不断增大,C项正确;将阳离子膜去掉,此时碳棒上Cl-先于OH-放电,电池反应随之发生变化,D项错误. 解题点拨电解质溶液中的离子在电极上得失电子先后顺序与该粒子得失电离能力强弱(氧化性或者还原性)有关,如阳离子在阴极得电子的先后顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+,但这是在离子放电几率均等的情况下的顺序,即在几率不等的情况下,得失电子几率大的离子先放电. 不难发现,在具体的试题中,有的竞争反应有据可循,是粒子的性质差异导致的先后反应或者主次反应的发生,但也有的试题只是呈现出反应的差异,并未指明差异的原因,解题时只需结合题意给予合理的解释和答案即可.三、复分解与氧化还原反应之间的竞争

四、电解质溶液中粒子放电反应的竞争



