实时荧光PCR检测巴西孢子丝菌的实验方法的建立
张明瑞 周盈 李福秋 姚春丽 杨鑫 龚杰 赵飞
(1.吉林大学第二医院皮肤科,长春 130022;2.长春市中心医院,长春 130051;3.中国疾病预防控制中心传染病预防控制所,北京 102206)
孢子丝菌病(sporotrichosis)是由孢子丝菌复合体(Sporothrixcomplex)感染皮肤、皮下组织、黏膜和局部淋巴系统所引起的慢性感染性疾病[1]。病程较长,皮损可固定于局部,或沿淋巴管走行,严重者可通过血行系统播散,引起内脏器官的感染,也有报道称吸入的孢子可直接引起肺部感染[2]。随着分子检测手段的不断发展,通过对基因序列的种系研究表明,申克孢子丝菌是由多个亲缘种构成的复合体[3],其中球形孢子丝菌(Sporothrixglobosa)、申克孢子丝菌(Sporothrixschenckiisensustricto)、巴西孢子丝菌(Sporothrixbrasiliensis)以及卢里艾孢子丝菌(Sporothrixluriei) 是临床感染中最常见的致病菌,其余孢子丝菌多为环境菌株,例如墨西哥孢子丝菌(Sporothrixmexicana)[4]。研究表明,不同种之间在致病力及药物敏感性方面存在明显差异[5-8]。因此,在孢子丝菌病的诊断及治疗过程中,对病原菌鉴定到种是十分必要的。本研究拟建立一种快速、灵敏和特异的巴西孢子丝菌实时荧光PCR检测方法,精准鉴定巴西孢子丝菌,为实验室检测、流行病学调查以及临床快速诊断提供有力的技术支持。
1 材料与方法
1.1 菌株与DNA提取
实验菌株:巴西孢子丝菌、球形孢子丝菌、申克孢子丝菌各1株,常见致病真菌其他种属28株(见表1)。其中,申克孢子丝菌标准株CBS498.86T,巴西孢子丝菌标准株CBS 120339T,由中国医学科学院皮肤病研究所医学真菌保藏中心惠赠,其余菌种来源于北京大学真菌和真菌病研究中心菌种保藏中心;3株表皮常见细菌的核酸,由中国疾病预防控制中心传染病预防控制所诊断室惠赠。
上述所有菌种均经过形态及分子鉴定至种水平。健康志愿者皮肤组织1份,BALB/c小鼠组织1份。上述菌种及组织标本使用QIAamp DNA Mini Kit (QIAGEN 51306) 试剂盒按操作手册提取核酸,提取的核酸-20℃冰箱保存。
1.2 主要试剂、仪器及实验动物
2×Taqman PCR MasterMix (Solarbio);Nuclease-free water (Promega);Potato Dextrose Agar 培养基(BD 211550);QIAamp DNA Mini Kit (QIAGEN 51306)。Real-time PCR仪C1000 Thermal Cycler (BIO RAD); Nanodrop2000C (Thermo)。BALB/c小鼠,雌性,6~10周龄,体重25~30 g。

表1 文中涉及的DNA及菌株列表
1.3 引物与探针
对NCBI数据库中孢子丝菌所有种属ITS基因序列进行比对,选取巴西孢子丝菌特异性序列,使用Primer Express Version软件设计引物及TaqMan探针,并进行手动调整,荧光标记为Cy5,引物及探针序列见表2。引物及探针序列由上海生物工程股份有限公司合成。
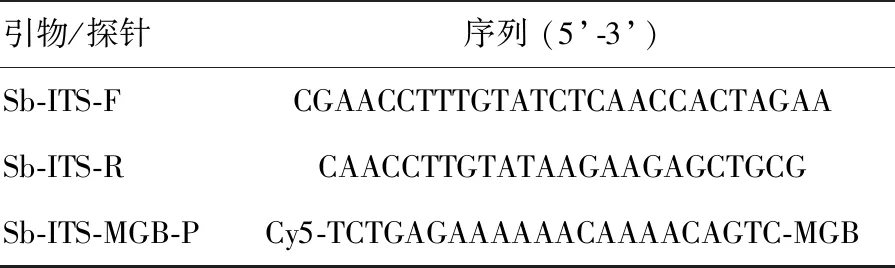
表2 引物及探针序列
1.4 实时荧光PCR扩增条件优化
体系退火温度从55℃~62℃进行梯度优化,确定扩增的最优退火温度。优化检测体系:2×Taqman PCR MasterMix 12.5 μL,上游引物Sb-ITS-F(25 μmol/L) 0.2 μL,下游引物Sb-ITS-R(25 μmol/L) 0.2 μL,探针Sb-ITS-MGB-P(25 μmol/L) 0.1 μL,DNA模板 5.0 μL,Nuclease-free water 补至25.0 μL。体系使用BIO-RAD C1000 Thermal Cycler real-time PCR仪进行扩增。扩增条件:95℃预变性10 min,1个循环;95℃变性15s,58℃退火30s,45个循环。
1.5 实时荧光PCR体系特异性、灵敏度以及检测限的测定
使用35种其他常见病原菌、人及小鼠基因组(见表1)进行体系特异度验证。将巴西孢子丝菌标准株(CBS 120339T)核酸进行10倍浓度梯度稀释(浓度从2ng/μL~0.2fg/μL,共计8个梯度浓度),进行灵敏度及检测下限的测定。
1.6 感染动物模型建立、组织培养及核酸提取
将巴西孢子丝菌标准株(CBS 120339T)转种至PDA培养基活化培养,30℃,培养14 d。生理盐水冲洗培养基表面,收集菌液,无菌纱布过滤,除去菌丝及培养基成份,3500 r/min,离心收集孢子。弃上清,沉淀用少量无菌生理盐水重悬,孢子悬液在显微镜下用血球计数板计数,调整菌液孢子浓度至107cells/mL。使用一次性无菌注射器吸取0.2 mL孢子悬液,腹腔注射感染BALB/c小鼠。感染14 d后脱颈处死,取脏器(脑、肝、肺、脾、肾、淋巴结)匀浆,取100 μL进行核酸提取及荧光PCR检测,再取稀释100倍后匀浆液100 μL接种在含有氯霉素的PDA培养基。
1.7 结果判读
荧光PCR检测每次须设立无模板对照(NTC)、阴性对照(NEG)和阳性对照(POS),只有NTC(-)、NEG(-)、POS(+),判定为有效扩增。检测为有效扩增时,Ct值<40为阳性结果;Ct值>40为阴性结果。接种感染动物的6种组织匀浆的培养基置于30℃培养箱,培养7 d后观察,并设置阳性培养和空白对照。7 d后,有孢子丝菌菌落生长,为培养阳性结果;30 d后,仍无菌落生长则为培养阴性结果。
1.8 伦理声明
本实验中使用的人类基因组DNA及实验动物均经过吉林大学第二医院伦理委员会批准(批号:2018-018)。实验动物的使用符合实验动物福利和伦理的要求,符合国家科技部《关于善待实验动物的指导性意见》等法规的规定。
2 结 果
2.1 实时荧光PCR体系优化
通过对NCBI数据库孢子丝菌属ITS序列对比,共设计出3套引物及探针组合。3套体系对于非孢子丝菌属其他核酸均展示出良好特异性,但其中两套体系对于申克孢子丝菌重复验证时,有时会出现非特异性扩增。最终,1套不会引起属内的非特异性扩增的TaqMan MGB体系定为最终检测体系(见表2)。在55~62℃范围内的退火温度下,标准浓度核酸检测Ct值相差0.64,经重复试验,选用Ct值最小的58℃作为最适退火温度。
2.2 实时荧光PCR方法的特异性及检测限的评价
本方法对33种常见病原菌、人类基因组以及小鼠基因组检测结果均为阴性,特异性可达100%。 使用浓度从2 ng/mL~0.2 fg/mL的巴西孢子丝菌核酸扩增获得标准曲线及对数曲线见图1。按照优化的反应体系和反应条件进行荧光PCR,每个浓度梯度做3个平行样。结果显示,本实验中实时荧光PCR体系检测限为100 fg。
2.3 感染动物模型组织培养及荧光PCR检测结果
感染小鼠脏器匀浆培养,除脑组织外,培养结果全部阳性。对生长的真菌进行形态学及分子鉴定,均为巴西孢子丝菌,证明感染模型建立成功,并且孢子由腹腔播散,引起多脏器感染(见图2)。6种组织匀浆核酸荧光PCR检测结果,除脑组织阴性外,其余5种组织巴西孢子丝菌核酸检测结果均为阳性,Ct值30.55~38.78(见图3)。
3 讨 论
巴西孢子丝菌是孢子丝菌复合体中重要的临床致病菌,主要分布在巴西。其宿主除了人类之外,也可引起以猫等动物的感染。猫的口腔环境温度为37.7~39.1℃,pH值为7.5~8.0,十分有利于巴西孢子丝菌酵母细胞生长繁殖。通过感染动物的抓咬,巴西孢子丝菌不仅能够引起人类的感染,也可在动物之间传播,成为其主要的传播途径[9]。作为重要的人畜共患病,由巴西孢子丝菌引起的孢子丝菌病,常具有较重的临床表现,并且能够引起内脏及邻近骨的感染,甚至侵犯中枢神经系统,导致宿主死亡[10-12]。近些年,孢子丝菌病报道不断增多,尤其是临床表现严重的病例。在巴西,仅有记载的巴西孢子丝菌感染病例就超过4000例,并且由于孢子丝菌病不是必须上报的病种,其真实感染情况要远高于记载数据[9]。
目前孢子丝菌诊断方法中,组织标本培养仍然是金标准[13]。但由于培养耗时较长,通常需要2~4周,不适用于临床的快速诊断以及流行病学调查,因此基于核酸检测的分子诊断逐渐成为研究热点。目前应用于孢子丝菌检测及鉴定的分子手段主要包括“生物条形码”的扩增测序[3,14-18]、巢式PCR[19-20]、限制性片段长度多态性(restriction fragment length polymorphism, RFLP )[21]、滚环扩增(rolling circle amplification, RCA)[22]以及特异性引物PCR[23]等。上述检测方法中,除巢式PCR外,其余方法均能够直接鉴定到孢子丝菌种水平。但是基于普通PCR的测序或者再酶切等方法,往往耗时较长,并且RFLP以及RCA只能用于纯菌的检测。2015年,由Rodrigues[23]建立的特异性引物PCR,依据不同孢子丝菌特定区域特异性PCR产物片段大小,可检测并区分几种常见的孢子丝菌。其对巴西孢子丝菌的检测下限为100fg,并通过感染小鼠的内脏组织模拟临床标本,评估其检测组织中的病原菌的能力,是目前报道的最灵敏和特异的孢子丝菌PCR检测方法。荧光PCR技术凭借其灵敏度及特异性高,耗时短,重复性好、全封闭反应等重多优势,逐渐成为病原菌鉴定及诊断重要的工具,并且已经广泛且有效地运用在细菌(结核分枝杆菌)、病毒(HIV,HCV)以及一些真菌(曲霉)等病原微生物的诊断[24]。但是在孢子丝菌属的检测中应用较少。
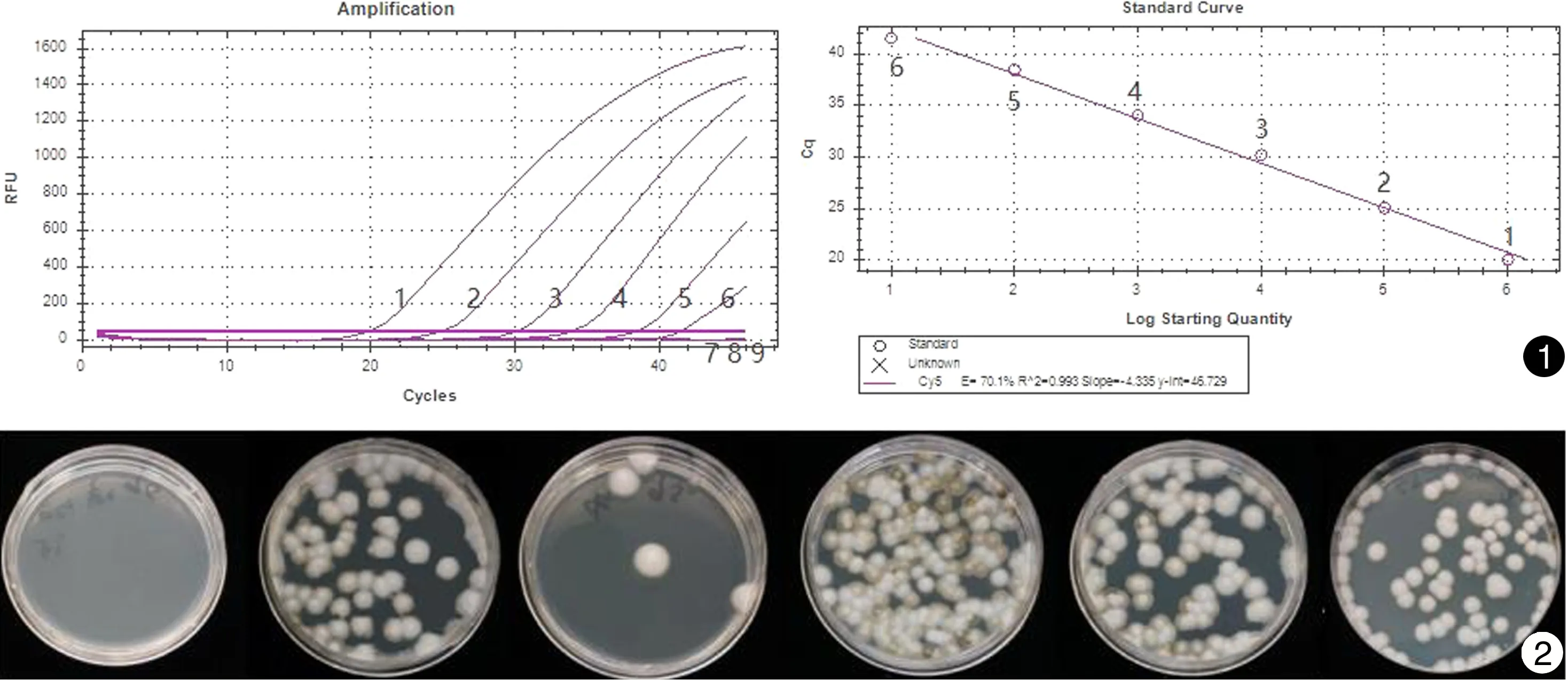
图1实时荧光PCR体系对巴西孢子丝菌标准浓度梯度核酸的扩增曲线(左)及模板浓度对数曲线(右)图2巴西孢子丝菌感染小鼠内脏组织培养结果(将内脏组织匀浆稀释100倍后,取100μL涂PDA平板,从左至右依次为脑、肝、肺、脾、肾、淋巴结)
Fig.1The amplification curves of the series gradient concentration templates (left) and standard curve of the real-time PCR assays(right).(1:10ng,2:1ng,3:100pg,4:10pg,5:1pg,6:100fg,7:10fg,8:1fg,9:NTC)Fig.2The culture results of tissues infected byS.brasiliensis.(left to right: brain, liver, lung, spleen, kidney and lymph nodes)
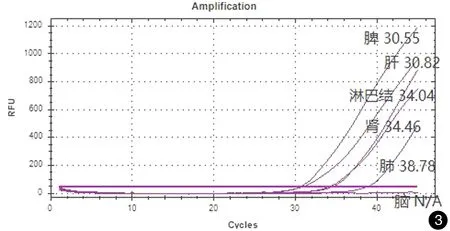
图3实时荧光PCR检测巴西孢子丝菌感染小鼠内脏组织匀浆Ct值(Ct值从小到大以此为脾30.55,肝30.82,淋巴结34.04,肾34.46,肺38.78,脑组织为阴性结果)
Fig.3The Ct values of tissues infected byS.brasiliensisdetected by real-time PCR.(spleen 30.55, liver 30.82, lymph node 34.04, kidney 34.46, lung 38.78, brain tissue was negative.)
内转录间隔区(ITS)通常包括ITS1、5.8S和ITS2,长度一般在500~750 bp。ITS区在进化过程中承受的自然选择压力比较小,能容忍更多的变异。其在绝大多数的真核生物中表现出广泛的多态性,在亲缘关系接近的物种中也能够表现出差异,即具有种内相对一致,种间差异明显的特征。因而广泛应用于真菌属内不同种间或近似属间的系统发育研究中。ITS序列具有高拷贝数的特点,在每个单倍染色体基因组中拷贝数超过200个,提高检测的灵敏度。孢子丝菌属中,巴西孢子丝菌的基因序列较保守,种间相似度很高,而申克孢子丝菌种内序列具有很多差异位点[25]。这些差异片段,很容易导致属内的非特异性扩增,增加了特异性引物及探针的设计难度。同时,实时荧光PCR要求其目的片段长度为100~150 bp,在较短的基因片段上,既要设计出能够扩增巴西孢子丝菌引物,同时也要设计出符合荧光PCR要求的探针,也是本研究的一个难点。通过软件比对以及手动调整序列,我们共获得3套候选的引物及探针组合。经验证后,得到1套含有TaqMan MGB探针的体系(见表2),这套体系灵敏度及特异性良好,检测下限为100 fg。虽然与特异性引物检测方法的检测下限相同,但是本研究方法无论从操作步骤、检测时间、结果读取以及污染风险方面,均具有明显的优势。为进一步验证本研究方法对组织中巴西孢子丝菌感染的检测情况,实验构建了小鼠感染模型,并与组织培养进行对比。结果显示,荧光PCR结果与金标准-培养方法对不同组织的检测结果一致。目前国内尚未发现巴西孢子丝菌,因此本实验方法只能通过标准株构建,并通过感染动物模型进行验证。缺乏临床菌株的验证,是本研究的不足之处。
综上所述,本实验成功建立巴西孢子丝菌的实时荧光检测方法,并进行了感染动物模型验证。该方法可以为流行病学研究及监测,甚至临床诊断提供技术支持。

