两种血清隐球菌荚膜多糖抗原检测方法在肺隐球菌病中的应用研究
黄进宝 李红艳 兰长青 吕骁 林志来 王新航 张宏英 邹盛华 翁恒
(1.福建医科大学教学医院福建省福州肺科医院呼吸内科;2.影像科;3.检验科,福州 350008)
肺隐球菌病(pulmonary cryptococcosis,PC)的传统诊断方法主要包括真菌病原体检测和肺组织病理活检,由于呼吸道标本的隐球菌检出率低,并且培养周期较长[1],并不能满足临床的诊断需要,目前确诊仍主要依赖病理学。近年来,新生隐球菌荚膜多糖抗原(cryptococcal capsular polysaccharide antigen,CrAg)检测作为一种无创检验方法,在协助快速诊断隐球菌感染方面已取得了明显进展,但目前研究主要集中于隐球菌脑膜炎(cryptococcal meningitis,CM)患者,在PC中的研究并不多,且多数观察例数较少[2-5],缺乏代表性。本研究采用酶联免疫分析法(enzyme-linked immuno sorbent assay,ELISA)和侧流免疫层析法(Lateral flow assay,LFA)两种方法对疑似PC患者的血清CrAg进行检测,探讨ELISA 检测CrAg的最佳截断值(cut-off),并比较ELISA和LFA的诊断效率。
1 对象与方法
1.1 研究对象
采集2016年1月至2018年6月福建省福州肺科医院109例疑似PC患者的血液,采用ELISA和LFA两种方法对血清CrAg进行检测。根据2010年国内隐球菌感染诊治专家共识PC诊断标准[6],经肺组织病理学检查或肺穿刺液病原学检测确诊为PC53例,其中男性33例,女性20例,年龄15~80岁,其中21例存在一种或一种以上基础疾病(其中16例存在免疫抑制基础疾病),包括乙肝或乙肝病毒携带者、糖尿病、鼻咽癌放疗后、乳腺癌术后放化疗后、直肠癌术后、恶性淋巴瘤化疗后、膜性肾病激素治疗后、视神经脊髓相关性视神经炎激素治疗后、陈旧性肺结核、结核性胸膜炎治疗史、隐性梅毒、低球蛋白血症、高血压病、高脂血症、高尿酸血症。肺部其他病变56例,其中男性34例,女性22例,年龄17~92岁,包括肺结核19例(其中2例合并结核性脑膜炎),肺炎17例,肺肿瘤8例,肺脓肿4例,机化性肺炎3例,间质性肺炎合并肺奴卡菌病1例,尘肺2例(其中1例合并肺炎),非结核分支杆菌肺病2例(其中1例合并肺曲菌球),其中15例同时存在一种或一种以上肺外基础疾病,包括乙肝病毒携带者、糖尿病、视神经脊髓相关性视神经炎、右侧颌下肿物、甲状腺肿物、阴道肿物、高血压病、高尿酸血症、高脂血症。
1.2 仪器和试剂
隐球菌荚膜多糖定量检测酶联免疫层析法试剂盒,由丹娜(天津)生物科技有限公司提供。侧流免疫层析法试纸条(CrAg LFA)为美国Immuno-Mycologics,Inc公司产品,已由美国食品药品监督管理局(FDA)批准。BACTEC9120全自动血培养仪购自美国BD公司。
1.3 血清标本采集
采集患者空腹肘静脉血约3 mL,1600×g离心10 min取血清,血清标本保存于-80℃冰箱备用。
1.4 血清CrAg检测方法
ELISA检测方法[7]配制工作洗涤液;取待测血清标本、标准曲线组样本各300 μL,分别加入100 μL样本处理液混匀,放入水浴锅100℃加热3 min后,4℃,10000 g离心10 min;分别取60 μL加入混合板孔,再加入酶标抗体60 μL混合,封板,37℃下孵育30 min;然后每孔转移100 μL至酶标板孔,设空白对照l孔,加入样本稀释液100 μL,封板,37℃下孵育30 min;揭开封板膜,洗涤酶标板,每孔每次加入不少于300 μL的洗液,洗涤5次,再每孔加底物溶液100 μL,37℃避光孵育15 min后每孔加50 μL终止液,加样顺序与加底物顺序相同,混匀后在450 nm处读吸光度(A)值。各孔A值减去空白对照A值后分析。以荚膜多糖浓度为横坐标,A值为纵坐标,作Logistic回归分析得到标准曲线方程,计算样本中荚膜抗原浓度(μg/L)。血清CrAg浓度阳性截断值初定为8 μg/L。
LFA法 将1滴样本稀释液加入到无菌试管中,取40 μL血清样本混合,将隐球菌抗原检测试纸条的白端没人样本液中,10 min后读取结果。出现两个条带(检测条带和对照条带)为阳性;仅出现对照条带为阴性;若对照条带未出现,说明检测失败,重新检测。
1.5 统计学处理
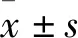
2 结 果
2.1 LFA和ELISA检测PC组与非PC组血清CrAg的结果比较(见表1)
应用LFA方法,PC组血清CrAg检测阳性率明显高于非PC组,两者比较差异有统计学意义(P<0.05)。应用ELISA方法,PC组血清CrAg浓度为[11.43(5.92,47.96)] μg/L,其中CrAg≤3.2 μg/L的例数明显低于非PC组,而CrAg≥5.0 μg/L的例数则明显高于非PC组,两者比较差异均有统计学意义(均P<0.05)。

表1 LFA和ELISA检测PC组与非PC组血清CrAg的结果比较
注:LFA:侧流免疫层析法;ELISA:酶联免疫分析法,CrAg:新生隐球菌荚膜多糖抗原;PC:肺隐球菌病;*:P< 0.05
2.2 ELISA检测血清CrAg的最佳截断值
采用ELISA检测血清CrAg时不同截断值所对应的敏感度、特异度、约登指数、PPV及NPV见表2。应用ROC曲线分析显示曲线下面积0.939(95%可信区间0.892~0.985,P=0.024),见图1。其中截断值为3.54 μg/L时约登指数最高,视为最佳截断值,对应的敏感度、特异度、PPV及NPV分别为94.3%、80.4%、82.0%和93.8%。
2.3 LFA和ELISA检测血清CrAg诊断PC效率的比较(见表3)
LFA诊断PC的敏感度、特异度、PPV和NPV分别为83.%、98.2%、97.8%和85.9%。
当血清CrAg以4.0 μg/L为截断值时,ELISA和LFA的诊断敏感度(88.7%和83.0%)比较差异无统计学意义(P>0.05),但ELISA特异度(82.1%)明显低于LFA(98.2%),两者比较差异有统计学意义(P<0.05)。
当血清CrAg分别取5.0 μg/L、6.0 μg/L和7.0 μg/L为截断值时,ELISA和LFA的诊断敏感度及特异度比较差异均无统计学意义(均P>0.05)。

图1酶联免疫分析法检测血清隐球菌荚膜多糖抗原的受试者工作特征曲线图
Fig.1Receiver Operating Characteristic (ROC) curve of serum cryptococcal capsular polysaccharide antigen detected by ELISA
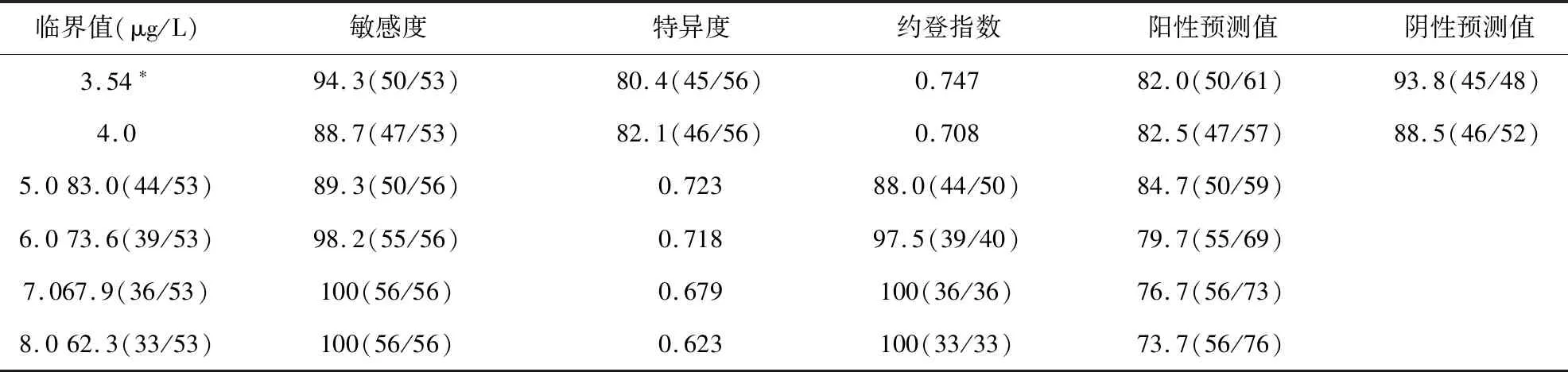
表2 ELISA检测血清CrAg不同截断值诊断PC的效率(%)
注:ELISA:酶联免疫分析法;PC:肺隐球菌病;*受试者工作特征曲线所得最佳截断值;括号内为例数

表3 LFA和ELISA检测血清CrAg诊断PC效率的比较
注: LFA:侧流免疫层析法;ELISA:酶联免疫分析法;CrAg:新生隐球菌荚膜多糖抗原;PC:肺隐球菌病;括号内为例数;a:与LFA比较;b:ROC曲线所得最佳截断值;c:P< 0.05;—:采用Fisher确切概率法,无统计值
当血清CrAg取8.0 μg/L为截断值时,ELISA的诊断敏感度(62.3%)明显低于LFA(83.0%),两者比较差异有统计学意义(P<0.05),但两者特异度(100%和98.2%)比较差异无统计学意义(P>0.05)。
2.4 血清CrAg检测出现假阴性和假阳性结果的患者基础疾病情况
应用LFA检测,PC组9例(17.0%)出现假阴性,其中1例合并恶性淋巴瘤和乙肝,1例合并乙肝病毒携带者和高脂血症,非PC组1例(1.8%)出现假阳性(弱阳性),基础病为肺结核;应用ELISA检测(以血清CrAg≥5 μg/L定为阳性),PC组8例(15.1%)出现假阴性,其中1例合并恶性淋巴瘤和乙肝,1例合并乙肝,非PC组6例出现假阳性,但所有结果均小于7 μg/L,其中仅1例大于6 μg/L。基础疾病包括肺结核3例(其中1例同时LFA假阳性,合并颌下肿物和高尿酸血症,1例合并尘肺),尘肺合并高脂血症和高尿酸血症1例,机化性肺炎2例(其中1例合并高脂血症和高尿酸血症)。
2.5 PC患者血清CrAg动态监测结果
14例患者在抗真菌治疗过程中监测血清CrAg浓度变化,治疗前荚膜抗原浓度为[19.33(7.11,43.46)] μg/L,治疗后6个月荚膜抗原浓度为[8.09(5.39,11.90)] μg/L,较前明显下降,两者比较差异有统计学意义(Z=-1.976,P=0.048)。其中8例治疗后6个月同时应用LFA复查血清CrAg,仅1例(12.5%)转为阴性,其余7例(87.5%)仍呈阳性。有两例在治疗前荚膜浓度分别为8.0 μg/L和8.9 μg/L,在治疗过程中均出现荚膜抗原浓度一度升高,前者在第3个月升至10.15 μg/L,后者在治疗第6个月升至12.87 μg/L,但肺内病灶均吸收改善,经继续治疗后再度出现下降,第9个月复测均低于5.0 μg/L。
3 讨 论
荚膜是新生隐球菌重要的毒力因子,荚膜多糖能够脱离菌体,分布于菌体所生长的外界环境中[8],因此对体内的CrAg进行检测可协助隐球菌感染的诊断。目前报道的血清CrAg检测方法主要包括乳胶凝集试验(latex agglutination test,LA)和LFA[2-5,9,10]。国内有研究表明[7],ELISA检测脑脊液CrAg诊断CM的敏感度和特异度均达100%,与LA和LFA的诊断价值相当。国外也有报道显示[11],ELISA检测人免疫缺陷病毒(human immunodeficiency virus,HIV)感染患者血清和脑脊液CrAg对诊断隐球菌感染有很好的敏感度和特异度,与LA诊断效果类似。目前有关ELISA检测血清CrAg在非HIV感染宿主PC患者中的诊断价值国内外少有文献报道。
本研究结果显示,PC患者的血清CrAg阳性率和荚膜抗原浓度均明显高于非PC患者,LFA和ELISA两种检测方法的诊断结论一致。其中应用LFA诊断PC的敏感度和特异度分别为83.%和98.2%,与付雅婕等[12]和胡群等[13]的研究结果一致,但敏感度明显低于Baughman等[14]的报道,考虑与后者均为HIV患者,而本组均为非HIV患者,且大部分患者无确切免抑制基础疾病,释放入血的隐球菌抗原较少有关[13]。同时,ELISA检测的ROC曲线分析显示,ELISA对PC患者同样有较高的诊断价值,3.54 μg/L为最佳截断值,其敏感度和NPV均较高,分别达94.3%和和93.8%,但特异度较低(80.4%)。随着诊断截断值升高,ELISA诊断PC的特异度明显提高,当CrAg≥7 μg/L时特异度可达100%,但敏感度明显下降,当 CrAg≥8 μg/L时ELISA的诊断敏感度仅62.3%,明显低于LFA(P<0.05)。当以5.0 μg/L为截断值时,ELISA和LFA均有较好的敏感度和特异度,并且两种诊断方法效率相当。
目前的研究多集中于CrAg对隐球菌感染的诊断作用,有关CrAg协助疗效判断的研究较少[7,13]。季淑娟等[7]对CM患者抗真菌治疗前后的脑脊液CrAg进行半定量对比检测发现,LA和ELISA两种方法均显示随着治疗时间延长,患者的脑脊液荚膜抗原浓度总体逐渐下降,与临床转归相符。胡群等[13]的研究也显示,采用LFA对HIV阴性PC患者的血清CrAg进行半定量动态监测,患者的抗原滴度随着病情好转逐渐下降。本研究采用ELISA监测PC患者血清CrAg含量变化,结果同样表明,患者经过抗真菌治疗后隐球菌抗原含量整体呈明显下降趋势,与患者的临床症状改善和肺部病灶吸收好转大体一致,提示ELISA检测方法有助于判断PC临床转归。虽然LFA、LA和ELISA 3种检测方法均可对抗原含量进行半定量测试有助于疗效判断,但LA和LFA两种方法是通过对阳性标本进行反复稀释,以抗原滴度高低来表示抗原含量[7,13],不仅操作繁杂,而且对操作人员的检测经验要求高,而ELISA则是根据标准曲线方程,计算出样本中的荚膜抗原浓度,以具体的抗原含量来表示,类似定量检测,检测结果更为直观,能更好的反映不同标本间的抗原浓度差异及不同时间点的抗原含量变化,比LFA和LA更有优越性[15]。此外,本研究也显示,PC患者治疗后采用LFA定性检测复测血清CrAg多数结果仍呈阳性,考虑与死亡的隐球菌菌体仍可释放荚膜多糖抗原,而机体清除抗原较慢有关[16],因此LFA定性检测不适用于判断PC疗效。
在荚膜抗原检测干扰因素方面,既往研究表明[17],LFA检测血清CrAg特异度高,很少出现交叉反应,主要在血清曲霉菌半乳甘聚糖检测阳性标本中发现存在交叉阳性。在本实验中,LFA特异度同样高达98.2%,仅1例肺结核出现假阳性,但ELISA检测出现6例假阳性(以检测值≥5 μg/L为阳性),其中3例为肺结核,而有文献报道应用LA检测结核患者的血清CrAg同样存在假阳性[18],提示应用LFA和ELISA检测血清CrAg时,肺结核对检测结果可能造成干扰从而出现假阳性,尚需要进一步研究证实。
总之,通过本研究表明,当血清CrAg取3.54μg/L时为ELISA检测的最佳截断值,但当取5.0 μg/L为截断值时,ELISA同时有较好的敏感度和特异度,且和LFA的诊断效率相当,两种方法均有助于对PC的快速临床诊断,值得临床推广应用。与LFA定性检测相比,ELISA可动态监测血清CrAg的浓度变化,有助于PC的疗效判断和预后评估。

