枣树根部内生细菌的分离及对3种枣病原真菌拮抗活性研究
邱志伟,陈有忠,于奥安,朱伟垚,杨俊林,陈招荣
(天津农学院 园艺园林学院,天津 300384)
枣(Ziziphus jujubeMill)原产于我国,是我国特有的且重要的干果和特色经济树种之一,是山区丘陵区发展农村经济的支柱产业,与杏、桃、李、栗并称为“五果”,是我国第一大干果树及第七大果树,在经济果树中占有重要地位[1-2]。天津地区的枣树种植历史可追溯至600多年前,被广泛种植于海河下游地区,其中以金丝小枣、冬枣等优良品种为代表,具有耐旱、耐涝、耐盐碱、经济效益高等特点,成为天津地区经济作物中不可或缺的一部分。早在1984年天津静海就获得了“中国金丝小枣之乡”的美誉,在出口、加工制品等方面具有很大的发展潜力[3]。在种植中,枣树病虫害种类多、分布广、危害严重是导致产量减少、品质下降的主要原因。据调查,当前天津地区对枣树危害较重的病虫害有十余种,其中病害以枣炭疽病、缩果病、枣疯病、枣锈病等为代表[4]。目前,主要使用化学药剂进行防治,化学防治易导致病原菌产生抗药性,随之出现食品安全、环境污染等问题,所以无公害的生物防治已经成为新趋势,天津农学院研究开发的TJ生防菌剂,田间试验表明对瓜类白粉病有着很好的防治效果[5]。
近年来,随着研究的不断深入,植物内生菌作为潜在生防资源和外源基因载体及其所发挥的重要的生态和生理作用,在农业及医学领域中展现出巨大的研究价值,如何利用内生菌逐渐成为国内外研究的热点。研究表明,从植物各部位可分离出很多内生菌,经过筛选部分内生菌对植物病害有很好的拮抗作用,为生物防治各种病害提供了基础[6-10]。目前,在枣树根部有益内生菌筛选及其用于枣类病害生物防治这一领域研究不多,有着巨大的研究开发潜力。本研究拟从枣树根部组织分离出内生细菌,进行形态和分子鉴定,并分别以枣黑点、枣链格、枣轮纹的病原菌为靶标,筛选出具有拮抗作用的内生细菌,为进一步利用内生细菌进行生物防治提供基础。
1 材料与方法
1.1 试验材料
试验所用枣树根部组织均采自于天津农学院东校区二教小花园。采集的新鲜材料带回室内4 ℃冰箱保存备用。
抑菌测试菌株:枣黑点病病原菌仁果茎点霉(Phoma pomirumThum)和细交链格孢菌(Alternaria alternateKeissler)和枣轮纹病原菌葡萄座腔菌(Botryosphaeria dothidea)由天津农学院植物病理学重点实验室提供。
培养基:马铃薯葡萄糖琼脂培养基(PDA)、LB培养基[11]。
1.2 试验方法
1.2.1 内生细菌的分离纯化
将采集到的枣树根部组织用清水洗净泥沙及表面附着物,称取0.02 g放入超净工作台风干水分,依次用75%乙醇溶液、3%次氯酸钠进行表面消毒,再用无菌水冲洗3~4次,取最后一次清洗的水涂布于LB平板检测消毒是否彻底。消毒完全后的样本在超净工作台风干后,剪碎置于无菌研钵中,加入1 mL无菌水研磨成浆液。将研磨液转移至无菌试管中,1 000 r/min离心1 min去除大部分根部组织,取上清液进行梯度稀释10-1~10-3,每个梯度取100 μL菌液涂布于LB平板中,28 ℃培养箱倒置培养。待内生细菌长出之后,用平板划线法反复纯化,在平板表面得到单菌落,4 ℃下保存备用。
1.2.2 革兰氏染色
参考张娴[12]的方法进行革兰氏染色。
1.2.3 内生细菌的初步鉴定
挑取内生细菌的单菌落放于装有液体 LB的试管中,放置于 33 ℃的摇床(200 r/min)摇培10 h。然后用 EasyPure®Bacteria Genomic DNA Kit试剂盒提取DNA,方法步骤参考试剂盒说明书;提取出DNA后以此为模板进行PCR扩增,引物为细菌通用的 27F(5'-AGAGTTTGATCCTGGC TCAG-3')/1 492 R(5'-TACGGTTACCTTGTTACG ACTT-3')。PCR 扩增体系,体系:PCR Mix 25 μL,引物 27F 1 μL,引物 1 492R 1 μL,模板 DNA 2 μL,重蒸水21 μL,总体积50 μL。扩增条件:预变性95 ℃ 5 min;变性 94 ℃ 45 s;退火 53 ℃ 40 s;延伸72 ℃ 45 s;变性、退火、延伸循环20次;终延伸72 ℃ 10 min;4 ℃保存。用凝胶电泳法检测PCR反应结果,取3 μL PCR产物与1 μL 6×DNA Loading Buffer 混合后加入1%琼脂凝胶点样孔中,在110 V的电压下进行电泳。待DNA跑至凝胶中央时结束,Goldview染色10 min,观测。将扩增后的DNA产物送至北京华大基因公司进行测序。测序结果利用NCBI中的BLAST软件对测序结果进行序列同源性对比搜索。
1.2.4 拮抗活性内生细菌的筛选
采用对峙培养法,将在PDA平板上活化培养5 d的病原菌,用直径6 mm的无菌打孔器在菌丝生长外缘打取菌饼若干,放置于新的PDA平板中央,将从枣根部组织分离得到的内生细菌点接在距离中央2.5 cm处的相对对角线上,每个平板点接4种内生菌,每个处理重复2次,置于28 ℃培养箱中倒置培养5 d后,观察是否存在抑菌带。
2 结果与分析
2.1 内生细菌的分离结果
分离操作中最后一次清洗的水涂布于 LB固体培养基上培养观察,平板并未长出菌落,说明材料表面消毒完全。分离得到的内生细菌根据形态差异进行平板划线纯化,最终获得18个差异菌株,对其命名为Z1~Z18。
2.2 革兰氏染色结果
将Z1~Z18进行革兰氏染色,对其进行初步分类鉴定。革兰氏染色颜色呈紫色为阳性菌,呈红色为阴性菌,如图1所示。

图1 Z4号、Z12号菌革兰氏染色镜检结果
18株内生细菌革兰氏染色结果如表1,其中12个菌株为革兰氏阴性菌,占鉴定总数的2/3,而革兰氏阳性菌为6个菌株,为1/3;可以看出枣内生细菌大部分为革兰氏阴性菌,内生菌中革兰氏阳性菌和阴性菌的比例与前人研究结果一致[13]。
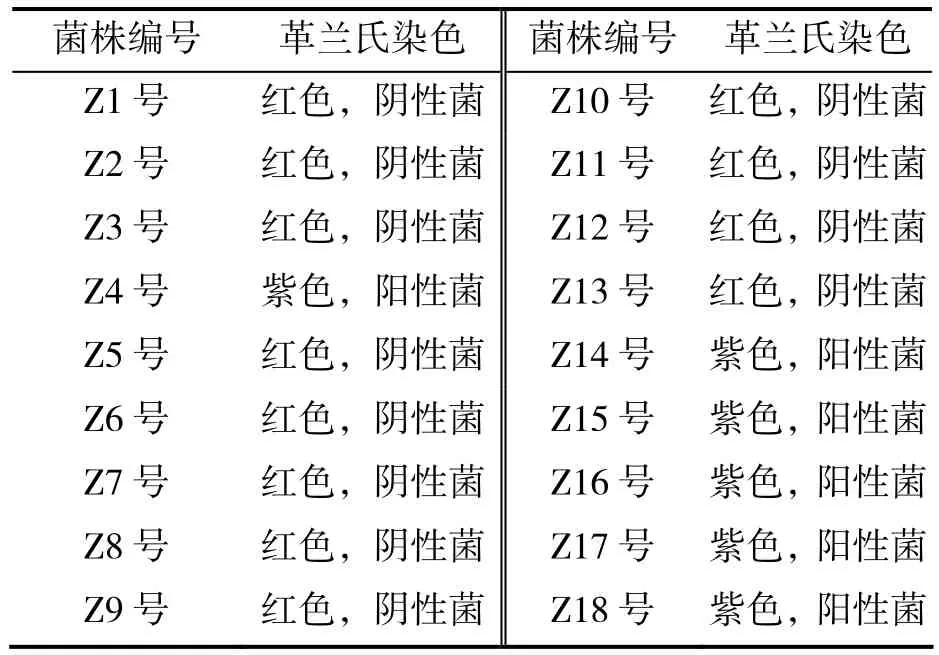
表1 革兰氏染色结果
2.3 内生细菌的16S rDNA序列及同源性分析
将提取出来的内生细菌总DNA作为模板,使用细菌通用引物27 F/1 492 R扩增,经1.0%的琼脂糖凝胶上点样电泳,均获得了约1.5 kb的目的条带(图2~图3),结果说明,成功扩增了内生细菌的16S rRNA基因的DNA片段。
将内生细菌的16S rRNA基因片段的PCR产物或PCR产物连接载体的阳性克隆菌液送至华大基因公司测序,得到18个菌株的16S rRNA基因的DNA片段序列。
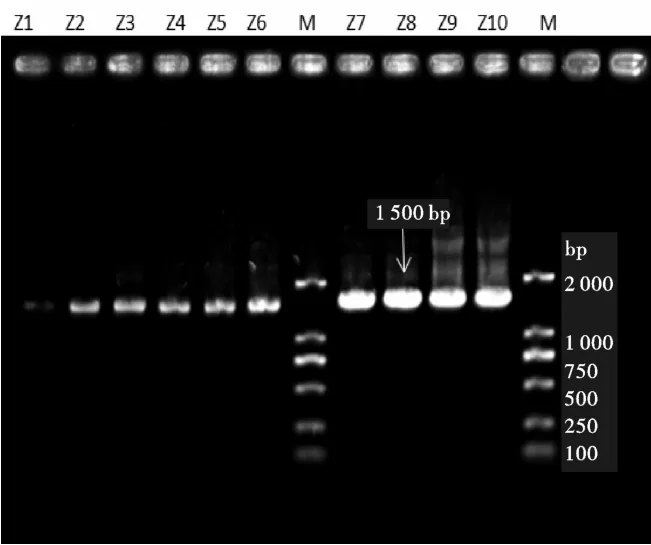
图2 从左到右Z1~Z6号,Z7~Z10号菌PCR扩增的电泳结果

图3 Z11~Z18号菌PCR扩增的电泳结果
利用NCBI中的BLAST软件对测序结果进行序列同源性比对搜索,结果18个菌株均找到与其相似度最高的菌株(见表2),分属于6个属,分别为金黄杆菌属(Chryseobacterium)1株、假单胞菌属(Pseudomonas)5株、芽孢杆菌属(Bacillus Cohn)6株、志贺氏菌属(Shigella Castellani)1株、埃希氏菌属(Escherichia coli)3株、寡养单胞菌属(Stenotrophomonas)2株。优势菌群是芽孢杆菌属(Bacillus)。大部分枣树的内生细菌与NCBI存在序列的同源性超过97%。
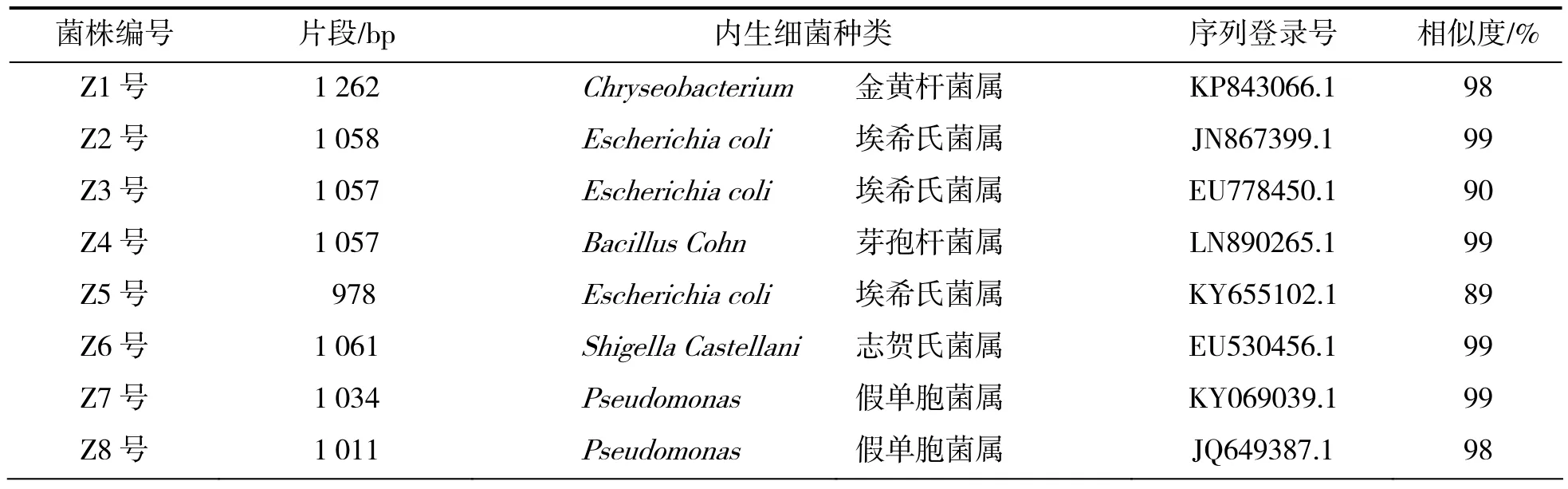
表2 Z1~Z18内生细菌鉴定结果
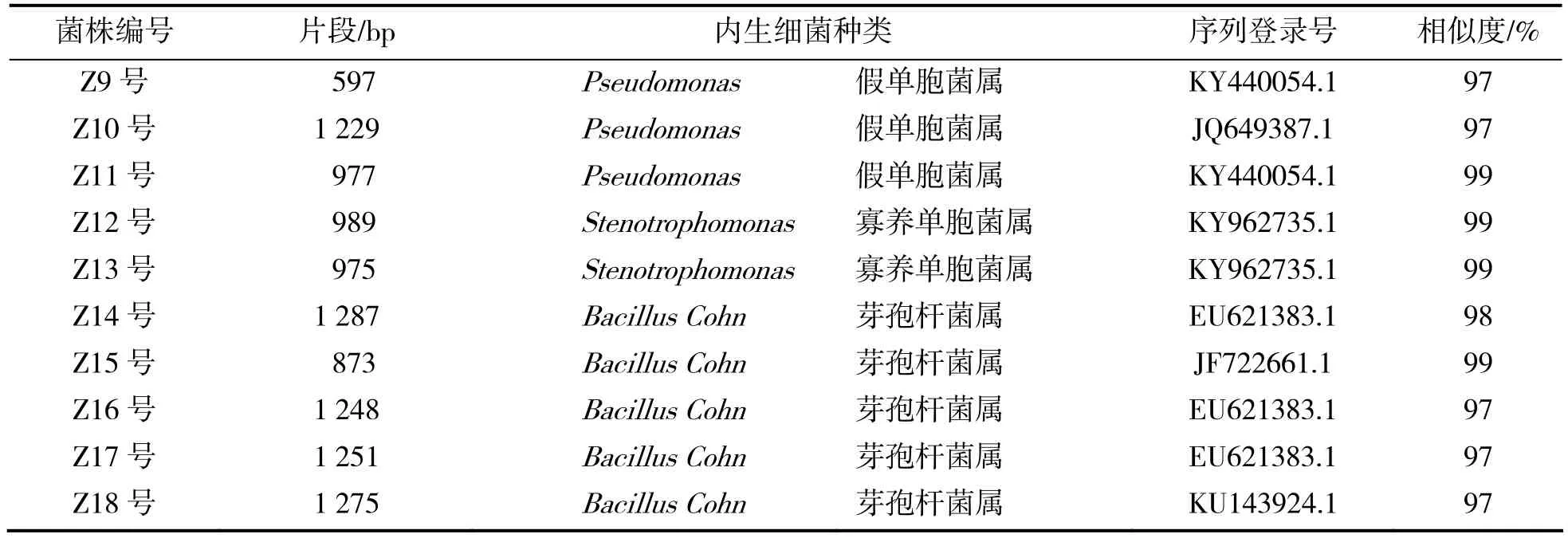
续表2
利用MEGA7.0对分离的内生细菌的16S rRNA基因序列以及在 NCBI上比对同源性最高的序列进行序列比对,删去前后未被匹配上的碱基,以邻近相接法(Neighbor-joining法)对18株分离得到的内生细菌以及与 NCBI中比对得到的同源性最高的序列进行聚类,采用1 000同源性最高的序列进行聚类,采用1 000个重复做Bootstrap检验,构建系统发育树,结果见图4。
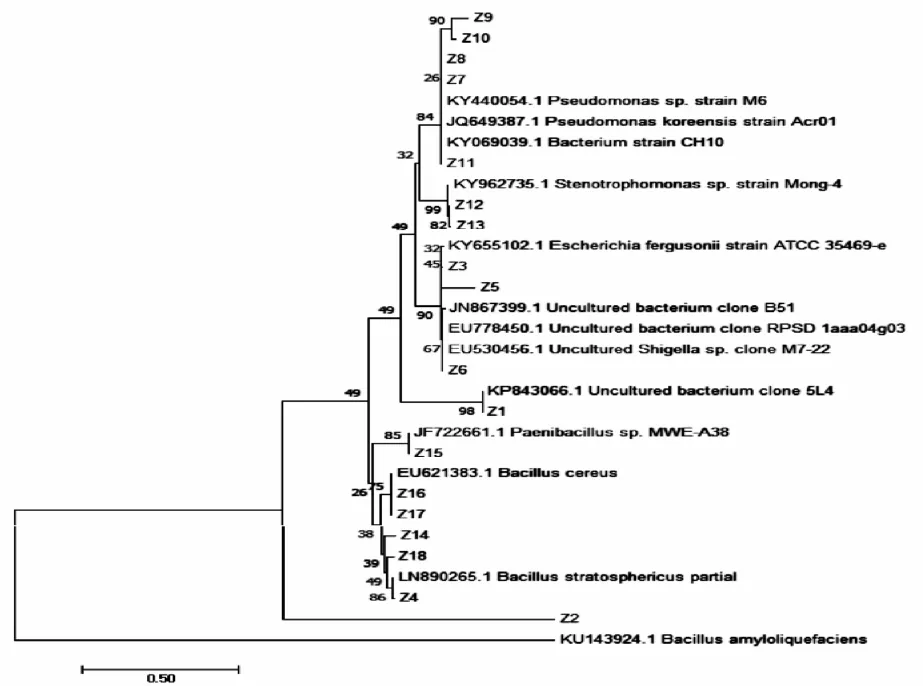
图4 Z1~Z18与NCBI中同源性最高序列构建系统发育树
2.4 拮抗内生细菌筛选
对峙培养5 d后,枣黑点、枣轮纹、枣链格病原菌菌丝不断扩展,Z1~Z17内生细菌逐渐被包围、覆盖,即说明这些内生细菌对上述3种病原菌无拮抗作用,如图5。而Z18号菌对上述3种病原菌对峙培养显示有着不同程度的拮抗作用,抑菌带一直存在,且越来越明显。其中,Z18号菌对枣轮纹病原菌的抑制作用最明显,抑菌圈的直径最大,而对枣黑点、枣链格病原菌的抑制作用相对较小,两菌落逐渐靠近,但无覆盖,见图6。
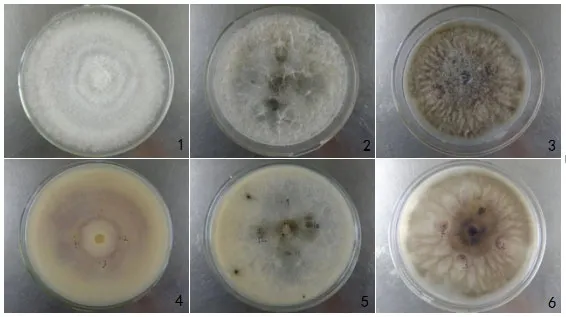
图5 某些内生细菌对枣主要病原菌无拮抗作用
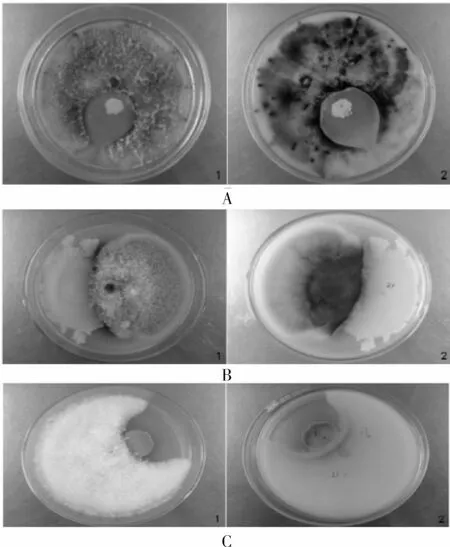
图6 Z18号菌对三种病原菌的拮抗作用
3 结论与讨论
通过对枣树根部内生细菌的分离与筛选,得到一株对枣黑点、枣轮纹、枣链格病原菌有拮抗作用的菌株Z18。利用传统分类方法和 16S rRNA序列测定对菌株进行了鉴定,菌株Z18初步鉴定为芽孢杆菌,革兰氏染色呈阳性。
芽孢杆菌抗逆性较强,是植物病害的生物防治中应用最广泛的细菌。目前,芽孢杆菌用于林木抗病促生在国内已有一定研究,如蔡丽等从凤凰单丛茶分离筛选出具有抑菌活性的甲基营养型芽孢杆菌,对梨果黑斑病菌、核桃叶枯病菌、红枣黑斑病菌、立枯丝核菌的菌丝具有较强的抑制作用[14]。芽孢杆菌产生的抗菌活性物质主要包括脂肽类、聚酮类及抗菌蛋白等,芽孢杆菌易于在田间定值,也便于分离、培养以及保存;已有研究显示芽孢杆菌已经成功的在生产实践中应用于生物防治[15]。刘伟成等[16]利用芽孢杆菌B08的菌悬液及灭菌后的发酵液经过田间小区防治试验显示均具有较好的防病作用,对小麦赤霉病抑制效果明显而持久。由此可见,筛选枣内有益内生菌并利用其开发对环境友好、高效、专一的生物农药,对克服化学防治的负面影响,保证枣高质增产具有重要的意义。
本试验表明了在枣根部存在可利用的内生细菌,给生物防治枣类真菌性病害以及植原体病害的生物防治提供材料。由于拮抗菌株Z18是从枣根部组织分离得到,且所有的试验均在实验室完成,Z18号菌株在植物活体条件下对本试验 3种病原菌的拮抗作用是否呈正相关,Z18的各种理化性质以及拮抗机理尚不明确,本研究后续将进行拮抗菌回接活体植株的试验,对生物防治枣黑点、枣轮纹、枣链格病原菌引起的枣类病害提供科学依据。

