鼠抗人CD28单克隆抗体的制备及体外生物学活性的初步研究①
沈立军 孔 永 颜天铭 王玉玉 王 婧 邱玉华
(苏州大学基础医学与生物科学学院免疫学系,苏州215123)
T细胞表达的CD28是迄今公认的经典共刺激信号B7/CD28通路的重要组成分子[1,2],在T细胞对抗原的特异性免疫应答中,CD28分子作为受体与APC表达的天然配体B7-1、B7-2相互作用后,介导T细胞活化所需的协同刺激信号。该信号能增加IL-2分泌促进活化、存活以及延缓T细胞失能[3,4]。对该信号进行靶向调控,可促进机体对肿瘤的排斥和肿瘤细胞的杀伤,从而具有潜在的应用价值。
本研究利用本室构建保存的鼠抗人CD28单克隆抗体杂交瘤细胞株,制备CD28单抗,采用Protein A免疫亲和层析法获得纯化抗体,以此为基础进行分子和细胞水平的研究,分析其与重组及天然CD28的结合活性,结合动力学特性,以及对T细胞增殖的影响,以评价该抗体的体外生物学活性,并为后续体内研究提供研究材料和参考数据。
1 材料与方法
1.1材料
1.1.1试剂、仪器 RPMI1640培养基、胎牛血清购自Hyclone;ProteinA亲和层析柱购自Merck;人CD28-小鼠IgG2a-Fc、人CD28-His购自ACROBiosystems;Zeba Spin Desalting Columns(7K MWCO)、EZ-Link Sulfo-NHS-LC-Biotin、SA-HRP、小鼠抗人CD3激发抗体购自Thermo;TMB显色液购自KPM;PE标记的小鼠抗Biotin抗体购自Biolegend;Histopaque-1077淋巴细胞分离液、降植烷(Pristane)购自Sigma-Aldrich;CellTiter-Glo Lumine-scent Cell Viability Assay购自Promega。Biacore(T200)、蛋白纯化仪(AKTA explover 100)、Series S Sensor Chip CM5购自GE公司;尼龙毛柱购自Polysciences;高效液相色谱仪购自Waters;流式细胞仪(FACSAriaⅢ)购自BD;酶标仪购自Molecular Devices。
1.1.2细胞株及实验动物 能稳定分泌鼠抗人CD28单抗的杂交瘤细胞株6E8由本实验室制备并保存;Jurkat购自ATCC,由苏州大学医学部免疫学系本课题组保存并常规传代培养;3~5周龄健康雌性裸鼠(BALB/c-nu)购自上海实验动物中心,饲养在苏州大学动物管理中心SPF级动物房。
1.2方法
1.2.1杂交瘤细胞6E8的复苏和抗体的制备与纯化 取保存的杂交瘤细胞6E8,进行复苏培养和扩增。收集生长旺盛的杂交瘤细胞注入已经过Pristane致敏的裸鼠腹腔中,1×107个/只,轻轻按摩裸鼠腹部,使杂交瘤细胞充分分散在裸鼠腹腔,7~10 d后当腹部隆起时,抽取腹水。经3 000 r/min,离心10 min,收取上清。将上清以PBS稀释1倍约35 ml后采用Protein A亲和免疫层析法对抗体进行纯化,0.25 ml/min上样,经柱平衡和洗脱共收集洗脱液约10 ml。洗脱液调整pH值至7.1,并经0.22 μmol/L 过滤除菌后,测定OD280 nm进行浓度定量后分装并于-80℃保存。
1.2.2分子筛高效液相色谱法(SEC-HPLC)分析纯度、降解和聚体 流动相为0.01 mol/L PBS缓冲液(pH7.2);流速0.5 ml/min;柱温为室温;检测波长280 nm,上样量30 μg。用Waters高效液相分析仪系统工作站对实验结果进行数据处理,用面积归一化法计算出其纯度及降解、聚体比例。
1.2.3ELISA检测抗体与重组人CD28的结合活性 采用EZ-Link®Sulfo-NHS-LC-Biotin试剂按照操作说明对小鼠抗人CD28单克隆抗体进行Biotin偶联标记。将人CD28-小鼠IgG2a-Fc 1 μg/ml,50 μl/孔包被酶标板2~8℃过夜后,弃去包被液,洗板,0.5%BSA-PBS封闭2 h,洗板后加入100 μg/ml起始1∶5 梯度稀释的Biotin标记CD28抗体50 μl/孔,置室温反应1 h。反应完毕洗板,加入50 μl/孔 200 ng/ml SA-HRP置室温反应1 h,洗板后加入TMB进行显色反应,读取OD450 nm值,并采用Softmax软件进行四参数曲线拟合,计算EC50值。
1.2.4流式细胞术(FCM)检测抗体与Jurkat细胞膜表达的天然人CD28结合活性 收集对数期生长旺盛的Jurkat细胞,以PBS离心洗涤细胞2次,1 000 r/min,5 min。用PBS重悬细胞并计数后分于流式分析管中,1×106个/管,离心去除上清后分别加入100 μl/管梯度稀释(62.5、31.3、15.6、7.8、3.9、2.0 μg/ml)的CD28 抗体,同时设置对照组。4℃条件下孵育30 min,用PBS洗2遍,再加入PE标记的小鼠抗Biotin抗体0.5 μg/管,100 μl/管,4℃避光条件下孵育30 min。再次洗涤后,用500 μl/管PBS重悬细胞进行流式细胞仪检测,所有数据经FlowJo软件进行分析,采集不同剂量抗体组细胞平均荧光强度并采用Softmax软件进行四参数曲线拟合,计算EC50值。
1.2.5表面等离子共振技术(SPR)检测抗体与人CD28结合动力学特性 将人CD28-His稀释至1 μg/ml,流穿偶联抗His抗体的Series S Sensor Chip CM5芯片,捕获时间为45 s,流速为10 μl/min。将CD28 抗体进行连续2倍稀释,共计10个浓度,即浓度为:1 000.0、500.0、250.0、125.0、62.5、31.3、15.6、7.8、3.9、0 nmol/L,将稀释完成的样品从低浓度到高浓度依次流穿芯片进行结合、解离,结合时间为60 s,解离时间为600 s,流速 30 μl/min,检测结束后选择Kinetics选项中1∶1 Binding模式进行曲线拟合,以时间为横坐标,响应值为纵坐标,确定其动力学常数。
1.2.6CD28抗体对外周血T细胞增殖的影响 设置以下实验组:①用羊抗鼠IgG(20 μg/ml)包被96孔细胞培养板,200 μl/孔,4℃摇动过夜,弃上清,用PBS洗3遍,加入 100 μl/孔激发型CD28单抗6E8(浓度为5 μg/ml);②用激发型CD28单抗6E8包被;③将L929-B7-1细胞经丝裂霉素处理后(每1×107细胞,离心弃上清,加入1 mg/ml时丝裂霉素溶液 50 μl,置于37℃、 45 min,洗涤3次),加入96孔培养板,5×104个/孔。 然后各实验组分别加入经E-花结实验获取的PBTC(CD3+T>95%),1×105个/孔,并调整体积至200 μl/孔。 设置相应对照组。各实验组均为多个复孔。部分孔2~3 d换液(原条件培养液),维持培养2周,逐日观察细胞的生长状态,用台盼蓝染色后计数活细胞总数并绘制生长曲线。

2 结果
2.1CD28抗体的制备、纯化及纯度分析 采用小鼠腹水诱生法制备单克隆抗体,10只裸鼠均形成腹水,收集的腹水产量平均为2.1 ml/只。经Protein A免疫亲和层析法对抗体进行纯化,共收集抗体洗脱液9.5 ml,经OD280 nm测定进行定量,为2.4 mg/ml,经计算腹水中抗体蛋白的得率为1.1 mg/ml。纯化后的抗体进行分子筛高效液相色谱法(SEC-HPLC)检测,结果表明其纯度为95.1%、降解和聚体比例分别为0.4%、4.5%。见图1。
2.2CD28抗体结合重组及Jurkat膜表达的天然人CD28活性分析 经ELISA检测,结果表明CD28抗体能够识别结合重组人CD28抗原(图2),其EC50值为19.8 μg/ml,同时流式细胞术检测(图3、4)也显示该抗体能够识别Jurkat细胞表达的天然人CD28分子,其EC50值为15.2 μg/ml,说明本抗体具有较好的抗原结合活性。
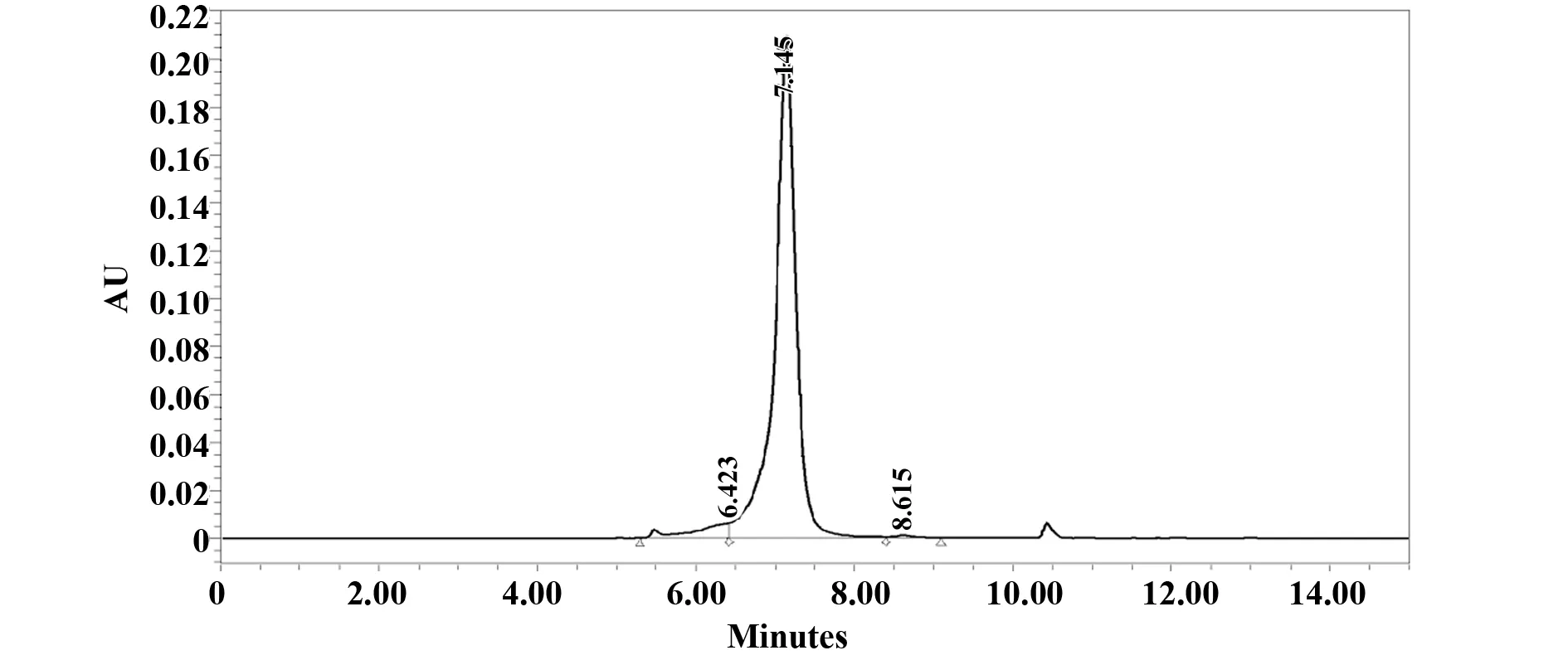
图1 分子筛高效液相色谱法(SEC-HPLC)分析CD28抗体纯度Fig.1 Purity of CD28 mAb was detected by SEC-HPLC
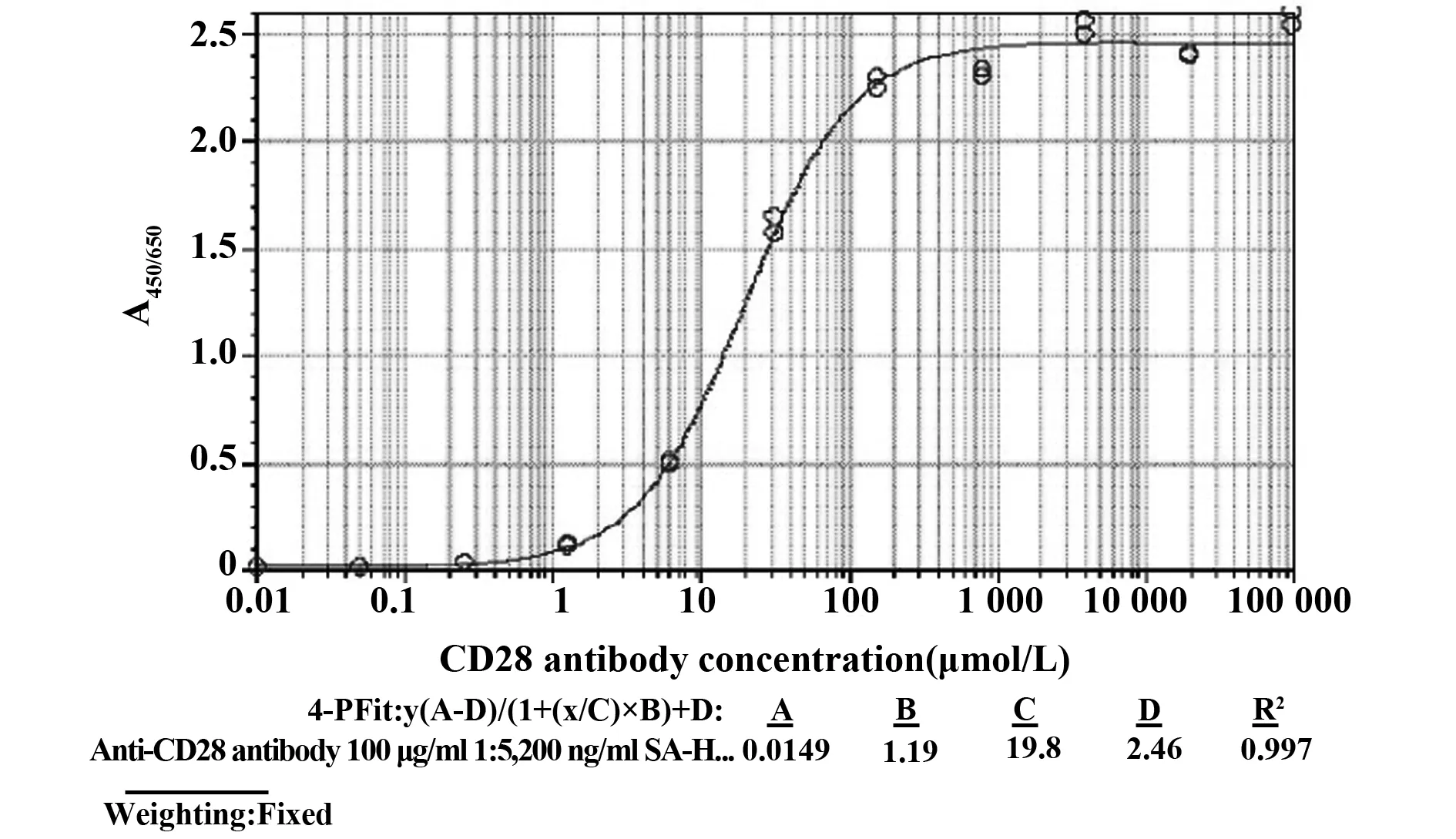
图2 ELISA检测CD28抗体与重组人CD28的结合活性Fig.2 ELISA of binding activity of CD28 mAb to human recombinant antigen of CD28
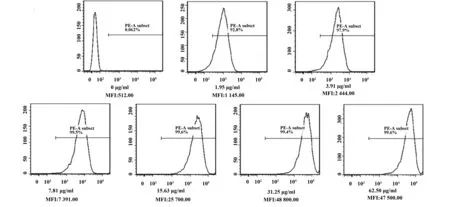
图3 FCM检测CD28抗体与Jurkat细胞表面CD28的结合(阳性率)Fig.3 FCM of binding activity of CD28 mAb to membrane CD28 of Jurkat(positive rate)

图4 FCM检测CD28抗体与Jurkat细胞表面CD28的结合(平均荧光强度)Fig.4 FCM of binding activity of CD28 mAb to membr-ane CD28 of Jurkat(average fluorescent intensity)
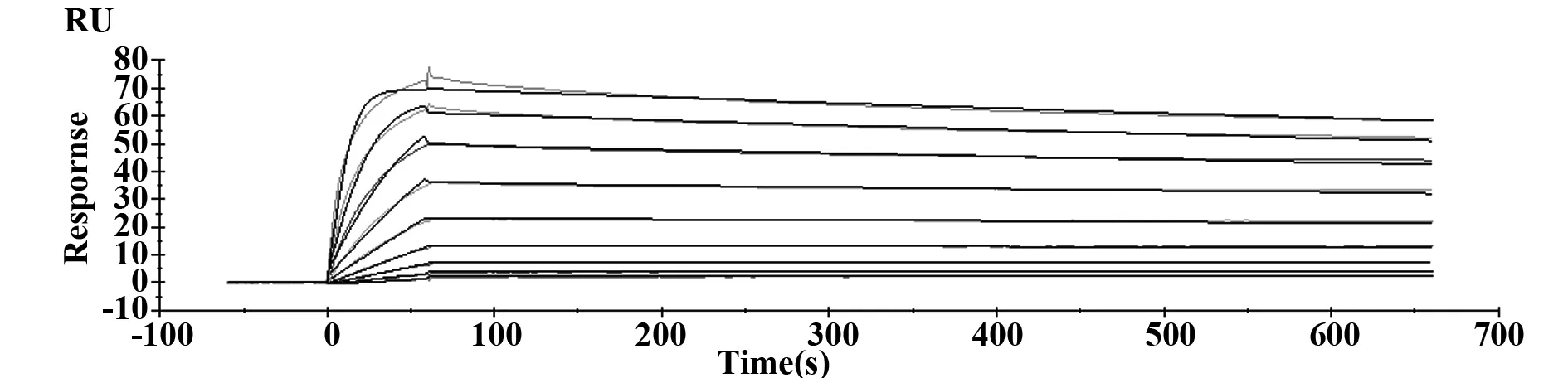
图5 表面等离子共振技术(SPR)检测抗体与人CD28结合动力学特性Fig.5 Kinetic assay on CD28 mAb to human CD28 antigen by SPR
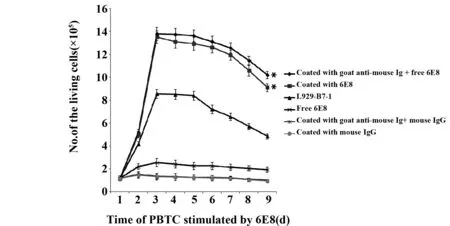
图6 6E8激发的PBTC的生长曲线Fig.6 Growth curve of PBTC stimulated by 6E8Note: *.P<0.05 vs L929-B7-1.
2.3CD28抗体结合人CD28动力学特性 抗原结合亲和力检测是评价抗体结合能力的重要指标,采用SPR技术分析了CD28与抗原的结合亲和力和动力学参数,结果显示本抗体结合CD28的亲和力为2.13×10-9M,结合常数为1.55×1051/Ms,解离常数为3.30×10-41/s,显示本抗体具有较好的亲和力(图5)。
2.4CD28抗体对外周血T细胞增殖的影响 结果显示(图6),直接包被或经羊抗鼠IgG先行包被后再加入游离6E8均能引发T细胞的活化与增殖。细胞活化的起始时间、 最大增殖强度及持续时间均较L929-B7-1刺激者强而持久(P<0.05)。
3 讨论
抗细胞膜型分子的单抗,根据其与相应抗原分子结合后产生的效应不同可分为三种类型:与抗原分子结合后能增强或阻断该分子介导的生物学效应,分别称为激发型或阻断型,抗原抗体交联后对抗原分子功能无影响者称为无功能型抗体。本研究在成功构建了稳定分泌激发性单抗CD28的杂交瘤细胞株6E8的基础上[5],运用SEC-HPLC及FCM对抗体的纯度及结合功能进行检测。经小鼠腹水诱生法制备单抗,采用免疫亲和层析进行纯化,获取抗人CD28单抗的纯化品。为研究该抗体的生物学特性,我们选取多种不同来源的CD28抗原与之结合,分析了抗人CD28对相应抗原分子的识别能力及介导的生物学效应。
杂质控制是单抗药物关键质量属性中保障药物安全性的重要指标,在满足如宿主DNA、宿主细胞蛋白、proteinA残留等单抗药物常见的工艺残留杂质符合安全标准和微生物安全的前提下,还需要控制与蛋白本身相关的杂质[6,7]。我们首先采用SEC-HPLC分析了CD28单抗的纯度。结果表明其纯度为95.1%、降解和聚体比例分别0.4%、4.5%,预示较低的免疫原性风险。进而将CD28抗体与人CD28-小鼠IgG2a-Fc及Jurkat膜表达的天然人CD28结合,其EC50值分别为19.8 μg/ml及15.2 μg/ml,说明本抗体能够识别、结合重组和天然表达的CD28,显示出良好的结合活性。
Biacore是基于 SPR 并用于实时观察生物分子相互作用的技术,其可得到很多传统技术难以提供的生物分子相互作用信息。目前,Biacore 技术在蛋白质组学、信号转导、新药开发、遗传学分析及食品检测等领域已显示出广阔的应用前景[8]。本实验使用Biacore(T200) 实时监测了抗体与抗原的结合和解离的过程,测得CD28抗体6E8的亲和力为2.13×10-9M,结合常数为1.55×1051/Ms,解离常数为3.30×10-41/s,显示本抗体具有较好的亲和力。
机体在肿瘤状态下,肿瘤特异性T细胞处于免疫耐受状态,CD28激发型单抗在体内外均可有效逆转 T 细胞的耐受,再次激发其抗肿瘤效应[9,10]。本试验在上述研究的基础上,又以羊抗鼠IgG预包被96孔细胞培养板后加入CD28单抗6E8,或者直接CD28单抗6E8预包被96孔细胞培养板,均可引发T细胞的活化与增殖效应。提示CD28单抗6E8为激发型单抗,其与T细胞CD28分子识别结合后,产生类似于天然配基B7分子的作用,刺激T细胞活化、增殖以及分化,从而介导免疫效应。
靶向CD28的单抗药物在开发和研究过程中亦有新的挑战出现,TeGenero公司开发的治疗白血病的CD28激发单抗TGN1412在药物Ⅰ期临床试验中部分受试者出现了严重的不良反应,这提示靶向抗体药物亦存在潜在的风险,也为我们开发创新性单抗药物提出了新的要求[11]。