生长抑素联合乌司他丁对术后早期炎性肠梗阻患者血清炎症细胞因子的影响
贺许良 曾良玉 黄 英 易小龙 张树友
术后早期炎性肠梗阻常见于腹部手术后1~3周,表现为肠壁炎性水肿及渗出、肠管蠕动减弱、肠内菌群移位及肠管粘连等,可导致多种炎症介质大量释放而引发或加重炎症反应,严重者甚至出现肠瘘、腹腔感染等而危及生命[1-2]。目前针对术后早期炎性肠梗阻以保守治疗为主,包括营养支持、胃肠减压、抑制肠液分泌、抗感染等。生长抑素可抑制胃、胰腺、肝脏等消化器官的外分泌功能,并抑制胃肠道的蠕动,被广泛用于术后早期炎性肠梗阻的治疗。乌司他丁可抑制多种消化酶的活性,并对多种炎症介质具有调节作用[3]。鉴于此,笔者将两者联合应用于术后早期炎性肠梗阻患者的治疗,并与单纯应用生长抑素治疗者进行了对比,现报告如下。
1 临床资料
1.1 一般资料
选取2015年5月至2017年10月长沙医学院附属株洲市人民医院收治的50例术后早期炎性肠梗阻患者作为研究对象,并按照随机数表法将其随机分为试验组 (25例)与对照组 (25例),其中试验组男性15例、女性10例,年龄27~76岁 [(54.3±13.7) 岁], 病程7~14 d [ (10.1±3.1) d], 手术类型为结直肠癌手术者4例、脾切除术者3例、阑尾切除术者6例、消化道穿孔修补术者4例、胆道手术者8例;对照组男性13例、女性12例,年龄33~75岁 [ (58.0±12.3) 岁], 病程7~14 d[(9.3±3.0)d],手术类型为结直肠癌手术者6例、脾切除术者5例、阑尾切除术者4例、消化道穿孔修补术者6例、胆道手术者4例。两组患者性别、年龄等一般资料对比,P均>0.05,差异无统计学意义,具有可比性 (表1)。本研究经长沙医学院附属株洲市人民医院伦理委员会批准,且所有患者均签署了知情同意书。
1.2 纳入标准
(1)符合文献 [2]中炎性肠梗阻的诊断标准者;(2)近7~14 d内行腹部手术治疗者;(3)对本研究知情,并自愿签署知情同意书者。
1.3 排除标准
(1)炎症已得到控制者; (2)符合肠扭转、绞窄性肠梗阻、肠系膜血管性疾病、腹腔脓肿等疾病的诊断标准者; (3)对本研究所用药物成分过敏者;(4)患有精神疾病,无法配合治疗者。
2 方法
2.1 治疗方法
试验组:在给予患者胃肠减压、抗感染、纠正水电解质紊乱等治疗的同时,静脉泵入生长抑素(广东天普生化医药股份有限公司生产,国药准字H19990134)3 mg、静脉滴注乌司他丁 (海南双成药业股份有限公司生产,国药准字H20067476)10万U,每天2次,1周后若肛门通气、排便等恢复正常,则逐渐停药。
对照组:在给予患者胃肠减压、抗感染、纠正水电解质紊乱等治疗的同时,静脉泵入生长抑素3 mg,每天2次,1周后若肛门通气、排便等恢复正常,则逐渐停药。

表1 两组患者一般资料对比Table 1 Comparison of general data between the two groups
2.2 观察指标及判定标准
分别于治疗前1 d及治疗第3、7天抽取空腹静脉血5 mL,采用酶联免疫吸附法检测血清中白细胞介素-6(IL-6)、白细胞介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)的水平,采用免疫透射比浊法检测血清超敏C-反应蛋白 (hs-CRP)的水平。
治疗第7天时,对比观察两组患者临床疗效:痊愈,症状和阳性体征消失,白细胞计数及X线检查结果均恢复正常;有效,症状和阳性体征减轻,白细胞计数虽降低但未恢复至正常水平,X线检查结果显示阳性体征有所好转;无效,症状和阳性体征无缓解或加重,白细胞计数无明显下降,X线检查结果显示阳性体征无改善;总有效率=(痊愈例数+有效例数) /总例数 ×100%[4]。
2.3 统计学处理
采用SPSS 17.0统计软件对所得数据进行统计学分析,其中计量资料以均数±标准差 (±s) 表示,组间比较采用t检验或t'检验,组内比较采用单因素方差分析;计数资料以频数或百分比表示,采用卡方检验或秩和检验;均以P<0.05为差异具有统计学意义。
3 结果
3.1 血清IL-6、IL-8、TNF-α及hs-CRP水平对比
治疗前1 d,两组患者血清IL-6、IL-8、TNF-α及hs-CRP水平对比,P均>0.05,差异无统计学意义,具有可比性;除治疗第3天,对照组患者hs-CRP水平与治疗前对比无明显变化,P>0.05,差异无统计学意义外,其他各时间点两组患者血清IL-6、IL-8、TNF-α及 hs-CRP水平组内两两对比,P均<0.05,差异具有统计学意义;治疗第3、7天,两组患者血清IL-6、IL-8、TNF-α及hs-CRP水平组间对比,P均<0.05,差异具有统计学意义(表2)。
3.2 临床疗效及不良反应发生情况对比
治疗第7天,试验组患者中痊愈16例、有效6例、无效3例,总有效率为88.0%;对照组患者中痊愈6例、有效11例、无效8例,总有效率为68.0%。两组患者临床疗效对比,P<0.05,差异具有统计学意义 (表3)。
治疗过程中,试验组患者中发生腹泻脱水者2例,不良反应发生率为8.0%;对照组患者中发生慢性脱水者1例、高热者2例、剧烈呕吐者2例、电解质紊乱者3例,不良反应发生率为32.0%。两组患者不良反应发生情况对比,P<0.05,差异具有统计学意义 (表3)。
表2 两组患者血清IL-6、IL-8、TNF-α及hs-CRP水平对比 (±s)Table 2 Comparison of the expression levels of serum IL-6, IL-8, TNF-α and hs-CRP between the two groups (±s)
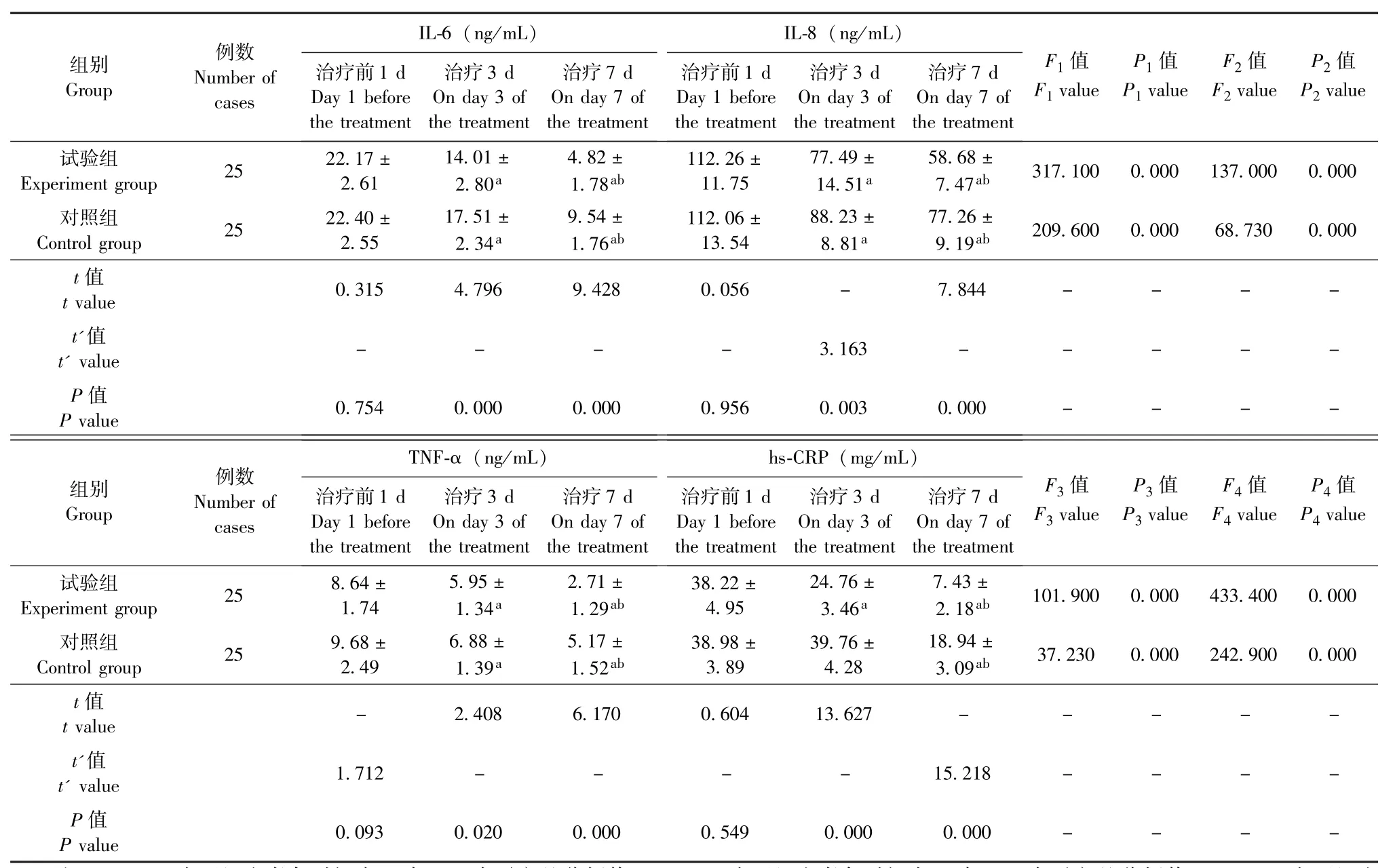
表2 两组患者血清IL-6、IL-8、TNF-α及hs-CRP水平对比 (±s)Table 2 Comparison of the expression levels of serum IL-6, IL-8, TNF-α and hs-CRP between the two groups (±s)
注:F1、P1为两组患者各时间点血清IL-6水平方差分析值,F2、P2为两组患者各时间点血清IL-8水平方差分析值,F3、P3为两组患者各时间点血清TNF-α水平方差分析值,F4、P4为两组患者各时间点血清hs-CRP水平方差分析值。两组患者各时间点血清IL-6、IL-8、TNF-α及hs-CRP水平组内两两对比,其中与治疗前1 d对比,aP<0.05,差异具有统计学意义;与治疗第3天对比,bP<0.05,差异具有统计学意义。两组患者治疗第3、7天,血清IL-6、IL-8、TNF-α及hs-CRP水平组间对比,P均<0.05,差异具有统计学意义Note: F1and P1were the ANOVA values of serum IL-6 at different time points in the two groups; F2and P2were the ANOVA values of serum IL-8 at different time points in the two groups; F3and P3were the ANOVA values of serum TNF-α at different time points in the two groups; F4and P4were the ANOVA values of serum hs-CRP at different time points in the two groups.The expression levels of serum IL-6, IL-8, TNF-α and hs-CRP at different time points were compared in pairs within each of the two groups,of which the results showed statistically significant differences as compared with that on day 1 before the treatment(aP <0.05) and as compared with that on day 3 of the treatment(bP <0.05).On day 3 and 7 of the treatment, the expression levels of IL-6, IL-8, TNF-α and hs-CRP were respectively compared between the two groups, and the results all showed statistically significant differences(P <0.05)
TNF-α (ng/mL)hs-CRP (mg/mL)例数Number of cases组别Group 治疗前1 d Day 1 before the treatment治疗3 d On day 3 of the treatment治疗7 d On day 7 of the treatment治疗前1 d Day 1 before the treatment治疗3 d On day 3 of the treatment治疗7 d On day 7 of the treatment F3值P3值F4值P4值F3value P3value F4value P4value Experiment group 25 8.64±1.74试验组5.95±1.34a 2.71±1.29ab 38.22±4.95 24.76±3.46a 7.43±2.18ab 101.900 0.000 433.400 0.000 Control group 25 9.68±2.49对照组6.88±1.39a 5.17±1.52ab 38.98±3.89 39.76±4.28 18.94±3.09ab 37.230 0.000 242.900 0.000 t值t value - 2.408 6.170 0.604 13.627 - - - - -t'值t'value 1.712 - - - - 15.218 - - - -P值P value 0.093 0.020 0.000 0.549 0.000 0.000 - - - -
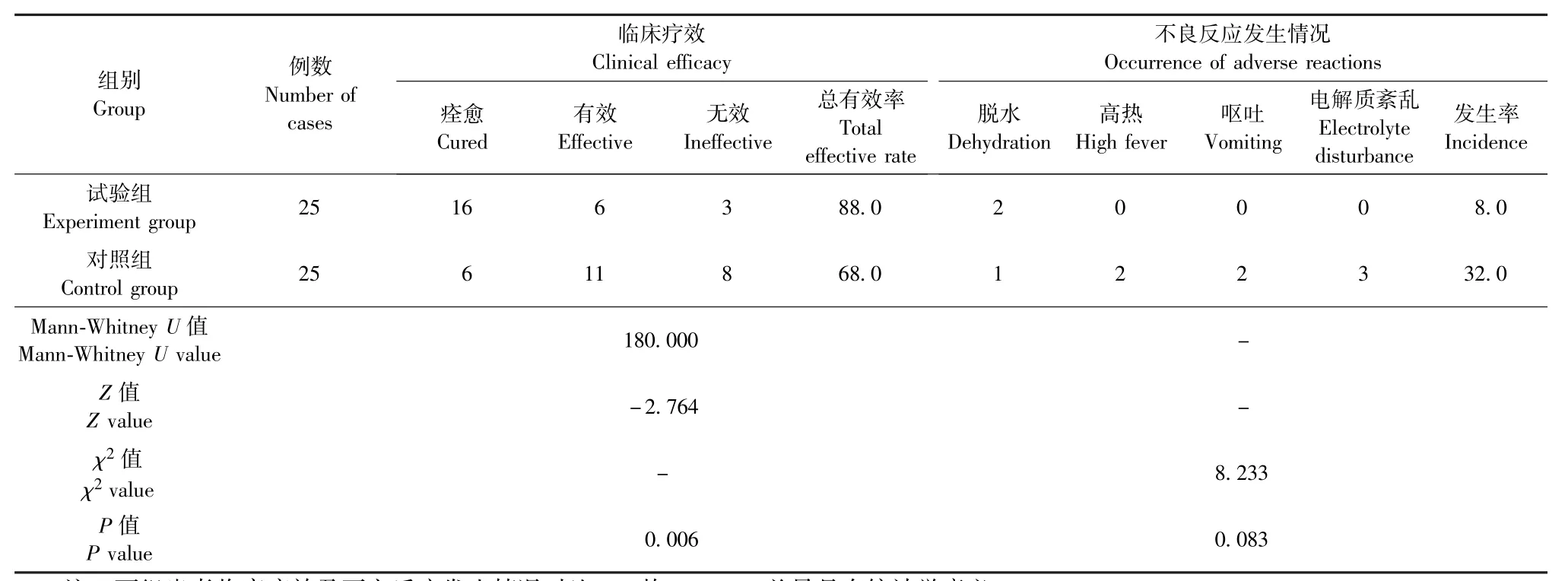
表3 两组患者临床疗效及不良反应发生情况对比 (例,%)Table 3 Comparison of clinical efficacy and the occurrence of adverse reactions between the two groups(n,%)
4 讨论
炎性肠梗阻是腹部手术患者早期发生的一种机械性和压力性因素同时作用而导致的粘连性肠梗阻,目前临床多以保守治疗为主,但临床疗效报道不一[5]。
梗阻肠管内细菌的移位、内毒素的释放等均可诱发多种炎症介质释放,其中TNF-α由巨噬细胞分泌,在肠道损伤过程中具有重要的推动作用,同时还可诱导IL-6、IL-8的产生而损伤血管内皮细胞。而生长抑素可明显抑制消化液的生成,从而改善肠壁微循环,促进肠黏膜功能恢复,减少肠管内液体和气体积聚,降低肠腔压力,减轻腹痛、腹胀等临床症状[6-7];同时还可通过减轻肠壁水肿、减少肠道菌群移位,保护肠黏膜的功能[8-9]。乌司他丁作为一种广谱蛋白酶抑制剂,可通过下调IL-6、IL-10、 TNF-α 等的水平而抑制炎症反应[10-12], 对以炎症/免疫机制为病理基础的多种疾病疗效较好;此外,其还可清除氧自由基,并改善组织器官微循环,保持多种膜的稳定性[13-14],在消化系统疾病及休克、肿瘤等恶性疾病的治疗中均有良好的疗效。因此,笔者于本研究中将生长抑素与乌司他丁联合应用于术后早期炎性肠梗阻患者的治疗,并与单纯应用生长抑素治疗者进行了对比。结果显示,除治疗第3天,单纯应用生长抑素治疗组患者的hs-CRP水平与治疗前对比无明显变化外,其他各时间点两组患者血清IL-6、IL-8、TNF-α及hs-CRP水平均呈现出逐渐下降的趋势,P均<0.05,差异具有统计学意义;治疗第3、7天,生长抑素联合乌司他丁治疗组患者的血清IL-6、IL-8、TNF-α及hs-CRP水平均明显低于单纯应用生长抑素治疗组患者,P均<0.05,差异具有统计学意义;治疗第7天,生长抑素联合乌司他丁治疗组患者的治疗总有效率为88.0%,明显高于单纯应用生长抑素治疗组患者的治疗总有效率68.0%,两组对比,P<0.05,差异具有统计学意义;治疗过程中,生长抑素联合乌司他丁治疗组患者的不良反应发生率为8.0%,明显低于单纯应用生长抑素治疗组患者的不良反应发生率32.0%,两组对比,P<0.05,差异具有统计学意义。此与王海燕等的研究结果一致[15]。
综上所述,生长抑素联合乌司他丁可有效提高术后早期炎性肠梗阻的治疗效果,降低患者的炎症反应程度及不良反应发生率,疗效显著,值得临床推广应用。

