不同品种香蕉种植地土壤微生物多样性及其对土壤理化性质的响应
邓大豪 邓涛 周游 汪军 杨腊英 郭立佳 黄俊生


摘 要 本研究以广西不同品种香蕉种植地土壤微生物为研究对象,利用扩增子测序技术、Spearman相关性分析、RDA分析等方法对土壤微生物丰度与多样性进行测定分析,阐述了香蕉及种植地土壤理化性质对土壤微生物丰度与多样性的影响。结果表明:香蕉土壤细菌样品OTU总量与真菌样品OTU总量比率大约是2∶1;香蕉枯萎病病原菌所在属Fusarium占属水平丰度5.132%~55.132%;Spearman相关性分析显示Fusarium与土壤理化性质无显著相关;真菌的丰度与多样性比细菌更易受到土壤的理化性质与营养元素的影响,单一土壤理化性质无法显著影响土壤微生物的群落结构和物种组成;土壤真菌在一定程度上体现香蕉品种的抗病性程度。
关键词 土壤微生物;扩增子测序;香蕉;抗病性中图分类号 Q143 文献标识码 A
Soil Microbial Diversity and Its Response to Soil Physical andChemical Properties under Different Banana Varieties
DENG Dahao1,2, DENG Tao1,2, ZHOU You1, WANG Jun1, YANG Laying1, GUO Lijia1,HUANG Junsheng1,2*
1. Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 2. Hainan University, Haikou, Hainan 570228, China
Abstract In this study, soil microorganisms in different banana growing areas in Guangxi were taken as the research object. Amplicon sequencing technology, Spearman correlation analysis, RDA analysis and other methods were used to determine and analyze the abundance and diversity of soil microorganisms. The effects of physicochemical properties of banana and soil on soil microbial abundance and diversity were discussed. The results showed that the ratio of total OTU of banana soil bacterial samples to that of fungal samples was approximately 2∶1.Fusarium, the genus of the pathogen of banana wilt, accounted for 5.132% to 55.132% of the genus abundance. Spearman correlation analysis showed that there was no significant correlation betweenFusariumand soil physicochemical properties.Fusariumhad no significant correlation with soil physical and chemical properties. The abundance and diversity of fungi were more easily affected by soil physical and chemical properties and nutrients than bacteria. The single soil physical and chemical properties could not significantly affect the community structure and species composition of soil microorganisms. To a certain extent, soil fungi reflect the degree of disease resistance of banana varieties.
Keywords soil microbes; amplicon sequencing; banana; disease resistance
DOI10.3969/j.issn.1000-2561.2019.09.026
土壤微生物是陸地生态系统的重要组成部分,对生态系统中物质转化和养分循环有重大影响,是土壤和植物中介者,影响着生态系统的结构与功能[1--4]。土壤微生物群落对环境条件的改变很敏感,环境条件包括植被组成、温度、降水等,环境条件的变化会导致微生物群落的结构变化,微生物群落的结构变化会导致土壤肥力及作物产率的变化[5--7]。因此,研究香蕉种植地土壤理化性质及香蕉抗病性对土壤微生物多样性的影响,对于防控香蕉枯萎病具有重要意义。
香蕉(Musa spp.)为芭蕉科(Musaceae)芭蕉属植物,起源于东南亚,在世界130多个国家广泛种植。香蕉既是重要经济作物和粮食作物,也是仅次于水稻、小麦、玉米的第4大粮食作物[8]。中国是世界香蕉原产地之一,有3000多年种植历史。目前,根据我国主要食用蕉假茎的颜色、叶柄沟槽、果实特征及经济性状,简单分为香牙蕉、大蕉、粉蕉、龙牙蕉和贡蕉5大类[9]。香蕉枯萎病(亦称巴拿马病)是由尖孢镰刀菌古巴专化型[Fusariumoxysporum f. sp.cubense (Foc)]侵染所致,对生产影响最大的Foc是侵染几乎所有栽培蕉的热带型4号生理小种(tropical race 4,TR4)[10]。一个多世纪以来,香蕉枯萎病一直是香蕉商业生产和自给农业种植的严重制约因素[11-13],不利于香蕉产业的健康可持续发展。香蕉枯萎病是一种典型的维管束和土传真菌病害,也是最具毁灭性的植物病害之一[14]。这种疾病侵袭了我国所有香蕉种植园的主要生产区域,病原体难以控制且在土壤中持久存在,迄今尚无有效的控制措施[15-16]。目前的主流研究方向是生物防治,即通过筛选能够抑制病原菌生长的有益菌,再将有益菌接种到土壤里面,以期实现生物防控土传病害的目的。
对香蕉及其土壤微生物的研究主要集中在复合菌剂、甘蔗渣、土壤熏蒸剂、堆肥、轮作等对香蕉、土壤酶活、微生物菌群结构等的影响[17-21]。张志红等[22]研究了不同肥料对土壤微生物功能多样性影响以及与防病关系,发现肥料防病效果与土壤微生物功能多样性变化趋势相反;李进等[23]研究了碱性肥料对土壤微生物多样性及香蕉枯萎病发生的影响,发现碱性肥料能有效防控香蕉枯萎病的发生;邓晓等[24]比较研究了香蕉枯萎病患病与健康蕉园土壤微生物群落功能多样性,发现患病样地土壤微生物群落功能多样性明显低于健康样地。同时,研究发现健康植株和不同感病级别植株根际土壤中的微生物数量均明显高于非根际,就细菌和放线菌来看,感病植株的根际效应最明显[25]。目前尚未有对香蕉种植地土壤微生物相对丰度和群落组成,优势细菌的功能、环境参数与细菌群落的相关性以及香蕉抗病性与土壤微生物关系的系统性研究。鉴于此,本文以广西香蕉种植地为研究区,利用扩增子测序技术对香蕉种植地土壤微生物群落功能多样性进行研究,以期揭示香蕉种植地土壤微生物群落丰度和组成、优势菌属的功能、土壤理化性质与微生物关系、香蕉抗病性与土壤微生物的关系,为后续防控香蕉枯萎病提供依据。
1 材料与方法
1.1样品采集
2018年7月,每个样地采用多点采样混合法,用采样器采集0~10 cm土壤样品并立即用聚乙烯无菌袋密封置于冰盒中带回实验室,充分混匀后分为2份,1份置于-40 ℃低温冰箱冷冻保存,在1周内用于土壤微生物DNA的提取和分析,另1份自然风干后研磨,用于土壤各理化指标的测定。样品WM11、WM12、WM21、WM22、WM31采自广西武鸣县培桂村,JS91、JS92、JS93采自广西隆安金穗。其中WM11、WM12、JS91、JS92、JS93为种植1年的抗病品种桂蕉九号;WM21、WM22为种植5年的较易感病品种桂蕉六号;WM31为种植5年的易感病品种桂蕉一号。
1.2方法
1.2.1 土壤理化性质的测定 取风干土壤,过2 mm筛,用于土壤理化性质的测定。直接用pH计测定土壤 pH,水土比2.5∶1;烧法测定土壤含水率(moisture content,MC)、有机质含量(organic substances content,OSC);浸提-蒸馏法(2 mol/L KCl)测定土壤铵态氮(ammonium nitrogen,NH4+-N)含量;钼锑抗比色法测定速效磷(available phosphorous,AP)含量;火焰光度计法(NH4OAc 浸提)测定速效钾(available potassium,AK)含量[26]。使用北京顺科达TR-8D土壤自动记录仪测定电导率(electrical conductance,EC)、盐度(salinity,SAL)、总溶解固体(total dissolved solids,TDS)。
1.2.2 土壤微生物DNA提取 香蕉种植地土样中微生物的DNA按照天根土壤基因组DNA提取试剂盒(DP336-02)说明书的方法进行提取。
1.2.3 16S rRNA和ITS rRNA基因的引物扩增及高通量测序 扩增16S rDNA的V3+V4区域,细菌的PCR引物是341F:5'-CCTAYGGGRBGCASCAG -3',806R:5'- GGAC T ACNNG GGTATC TAAT-3'。扩增ITS rDNA的ITS1-5F区域,真菌PCR引物是ITS5-1737F:5'-GGAAGTAAAAGTC GTA ACAAGG-3',ITS2- 20 43 R: 5'-GCTGCGTTC T TC ATC GATGC-3'。提取的土壤微生物DNA由北京諾禾致源科技股份有限公司进行扩增子测序。测序基于IonS5TMXL测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序。
1.3数据处理
IonS5TMXL下机数据为fastq格式,使用Cutadapt软件过滤和按barcode拆分样本后[27--29],进行97%的一致性的OTUs(operational taxonomic units)聚类和物种分类分析[30]。根据OTUs聚类结果,一方面对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况[31]-[32]。对OTUs进行丰度等分析,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等[33]。同时,结合环境因素进行RDA分析(redundancy analysis,RDA)和多样性指数与环境因子的相关性分析,得到显著影响组间群落变化的环境影响因子[34--36]。运用SPSS软件对香蕉抗病性与土壤微生物进行相关性分析。
2 结果与分析
2.1香蕉种植地微生物群落功能多样性指数分析
细菌和真菌测序深度指数均在0.99以上。细菌香农-威纳指数(Shannon-Wiener)在8.084到9.498之间,辛普森多样性指数(Simpson)在0.981以上,样品OTU总量(observed species)在1670到2302之间。真菌Shannon-Wiener指数在4.872~6.913,Simpson多样性指数在0.813以上,样品OTU总量837到1164之间。细菌样品OTU总量与真菌样品OTU总量比率大约是2∶1。
2.2香蕉种植地的优势菌
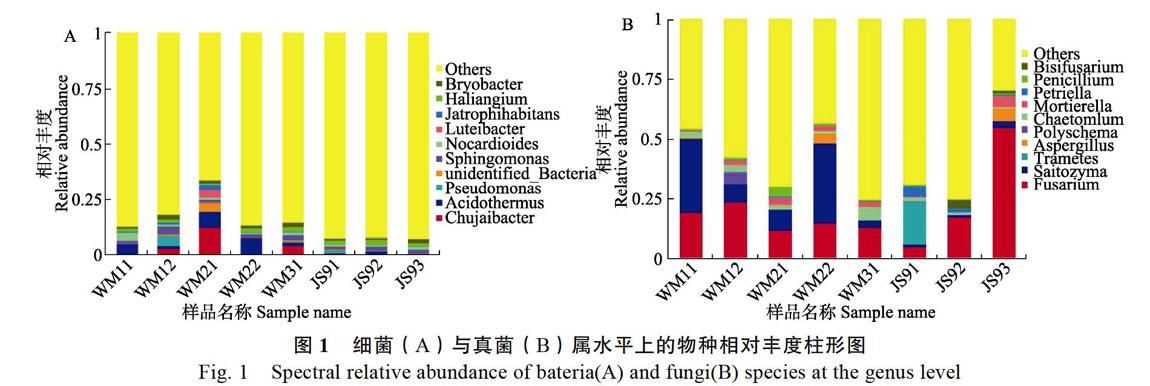
根据物种注释结果,选取每个样品最大丰度排名前10的物种,生成物种相对丰度柱形累加图(图1)。Proteobacteria(17.947%~45.014%)或Actinobacteria(16.359%~41.576%)在香蕉种植地丰度最高。门水平真菌Ascomycota占30%~ 75%,为最优势门。真菌Fusarium,Saitozy ma,Trametes为优势属。香蕉枯萎病病原菌所在属Fusarium占5.132%~55.132%。
2.3环境参数与菌群的相关性
Spearman相關性分析是用Spearman秩相关来研究环境因子与物种之间的相互变化关系,得到两两之间的相关性和显著性P值。细菌菌属与环境参数(表1)显著相关的有(图2A):Chujaibacter与电导率、盐度、总溶解固体显著正相关,Acid o ther mus与有机质含量显著负相关,Pseu d o monas与速效磷显著正相关。Jatrophiha bitans与pH极显著负相关。RDA分析反映菌群与环境因子之间的关系,细菌RDA的累计贡献率RDA1 26.12%,RDA2 15.94%(图3A)。影响按大小排序:盐度>电导率>总溶解固体>速效磷>pH>有机质含量>铵态氮。VPA分析(variance partitioning canonical correspondence analysis)研究各环境因子对微生物群落分布的解释率。细菌中,pH、Con.、Sal.、Tot.、Org.、N、P、K分别代表pH、电导率、盐度、总溶解固体、有机质、铵态氮、速效磷、速效钾。Env1为N、P、K一组,Env2为pH、Con.、Sal.、Tot.、Org.一组。Env1单独的解释量为18.02%,Env2单独的解释量为30.86%,两组环境变量的共同解释量为51.12%,结果表明Env2对样本分布的影响要大于Env1。
真菌Spearman相关性分析以下显著相关:Saitozyma与pH显著负相关,Trametes与速效磷显著正相关,Chaetomium与电导率、盐度、总溶解固体显著正相关,BisiFusarium与pH显著负相关(图2B)。Fusarium与环境参数无显著相关。真菌RDA分析的累计贡献率RDA1 18.89%,RDA2 16.68%(图3B)。真菌中,Env1单独的解释量为20.35%,Env2单独的解释量为41.84%,两组环境变量的共同解释量为37.81%,结果表明Env2对样本分布的影响要大于Env1。

3 讨论
土壤微生物的生物指标影响着土壤的理化性质与营养元素,包括土壤微生物的丰度、多样性等方面[23-24]。土壤微生物多样性和其种群结构调控着土壤各种非生物指标,包括土壤pH、电导率、盐度、总溶解固体、有机质含量等。土壤pH与抑病性呈负相关,微生物群落失衡可以体现在土壤物理指标[37]。本研究中香蕉种植地的土壤pH为5.26~7.35。采集土壤2个区域为强酸性,1个区域为酸性,5个区域为中性,存在土壤酸化的危险,降低抵御香蕉枯萎病的能力。平衡的土壤微生物群落是土壤健康的重要指标。一般来说,高质量的土壤具有较高的细菌多样性,但真菌多样性低于低质量的土壤[38]。WM21细菌种群水平失衡,属水平Chujaibacter(12.540%)与Acidother mus(6.847%)與其他显著不同,样品OTU总量最低,为1670,同时WM21真菌样品OTU总量较高,为1041,土壤有从细菌型向真菌型转化的趋势。WM21土壤酸化、盐渍化,导致土壤微生物群落结构的改变,具有香蕉枯萎病的潜在发生危险。
WM11为抗病品种桂蕉九号;WM21为较易感病品种桂蕉六号;WM31为易感病品种桂蕉一号。真菌样品OTU总量是WM31>WM21>WM11,说明在样品中越易感病,真菌样品丰度、多样性指数越大。WM11真菌门水平中相对丰度超过10%的有Ascomycota和Basidiomycota,Ascomycota (46.213%)>Basidiomycota(32.807%);WM21真菌门水平中相对丰度超过10%的有Ascomycota和Basidiomycota,Ascomycota (32.700%)>Basidiomy cota (12.925%);WM31真菌门水平中相对丰度超过10%的只有Ascomycota,Ascomycota(46.184%)> Basidiomycota(8.991%)。在样品中越易感病,真菌门水平中相对丰度中Ascomycota和Basidiom ycota相对丰度相差越大。WM11、WM21和WM31真菌属水平中相对丰度Others各占45.557%、69.865%和75.502%。在样品中越易感病,真菌属水平中相对丰度Others占比例越高。综上所述,感病品种和抗病品种的抗病性与土壤真菌关系较大,土壤真菌丰度、多样性指数在一定程度上体现香蕉品种的抗病性程度。
以往土壤微生物多样性的研究主要用稀释平板法、Biolog Eco 微孔板方法、变性梯度凝胶电泳等,揭示土壤理化性质与土壤微生物群落的关系[17-18, 20, 25]。第二代高通量测序技术提供了强有力的工具来研究微生物的群落结构和物种组成,更能克服传统方法的局限,灵敏地检测出环境微生物群落结构和物种组成与外界环境的细微关联[21]。邓超超等[39]研究耕作措施对陇中旱农区土壤细菌群落的影响时发现,秸秆覆盖处理不仅提高了土壤细菌群落的丰度和多样性,且特有细菌类群也相对较高,其中尤以免耕秸秆覆盖最为突出;尚天翠等[40]在研究新疆野生樱桃李林不同生态条件下土壤细菌数量变化及其影响因素时发现,土壤有机质含量和全氮含量与细菌数量正相关;刘艳霞等[41]在研究贵州省典型植烟生态区域根际土壤微生物群落多样性时发现,不同生态区域的微生物结构与土壤碳、氮、有机质含量及pH与土壤微生物区系都没有对应关系,土壤微生物结构是受多种因素综合影响和决定的。本研究中Fusarium与环境参数无显著相关,但香蕉枯萎病是典型的土传病害,带菌土壤是主要侵染来源之一,可能需要进一步研究到单个物种,才能通过扩增子测序方式研究热带型4号生理小种与环境关系。RDA分析主成分RDA1、RDA2,贡献率分别为18.89%和16.68%,表明并非单一土壤理化性质能够显著地影响土壤微生物的群落结构和物种组成,而是综合因素共同作用的结果。在VPA分析中,真菌与细菌结果相同,Env2对样本分布的影响要大于Env1,即pH、电导率、盐度、总溶解固体、有机质含量一组影响力要大于铵态氮、速效磷、速效钾一组,真菌更易受到Env2的影响,与曹志平等[42]研究结果相一致,即以细菌分解途径为主导的土壤,能够快速降解有机质含量,提高氮矿化率,养分供应迅速;以真菌途径为主的土壤有利于存贮有机质含量和固持氮,氮和能量转化较缓慢。比较而言,前人多研究香蕉枯萎病的防治方法,不曾研究香蕉土壤理化性质、抗病性对土壤微生物多样性影响及普遍变化规律,本文丰富了香蕉枯萎病的研究结果。在实际应用中,可以通过改变土壤微生物菌群结构来防治香蕉枯萎病,这对香蕉生产具有重要意义。
参考文献
- 张 静, 温仲明, 李鸣雷, 等. 外来物种刺槐对土壤微生物功能多样性的影响[J]. 生态学报, 2018, 38(14): 4964-4974.
- 王伟华, 刘 毅, 唐海明, 等. 长期施肥对稻田土壤微生物量、群落结构和活性的影响[J]. 环境科学, 2018, 39(1): 430-437.
- 王宝荣, 杨佳佳, 安韶山, 等. 黄土丘陵区植被与地形特征对土壤和土壤微生物生物量生态化学计量特征的影响[J]. 应用生态学报, 2018, 29(1): 247-259.
- 范 虹, 赵 财, 胡发龙, 等. 土壤含水量、种植模式和丁香酚对土壤微生物种群结构的影响[J]. 中国沙漠, 2019, 39(2): 13-18.
- 李 婷, 张 威, 刘光琇, 等. 荒漠土壤微生物群落结构特征研究进展[J]. 中国沙漠, 2018, 38(2): 329-338.
- 张 浩, 吕茂奎, 谢锦升. 红壤侵蚀区芒箕对土壤微生物群落结构的影响[J].生态学报, 2018, 38(5): 1639-1649.
- 刘亚军, 马 琨, 李 越, 等. 马铃薯间作栽培对土壤微生物群落结构与功能的影响[J]. 核农学报, 2018, 32(6): 1186-1194.
- 张 静, 孙秀秀, 徐碧玉, 等. 香蕉分子育种研究进展[J]. 分子植物育种, 2018, 16(3): 914-923..
- 杨 宇, 金 鑫, 李长江, 等. 香蕉不同生长期镁和锌营养特征研究[J]. 中国果树, 2018(3): 50-53..
- 王文华. 香蕉枯萎镰刀菌1、4号小种rDNA-ITS序列分析及4号小种遗传转化体系建立[D]. 儋州: 华南热带农业大学, 2007.
- Ploetz R, Freeman S, Konkol J, et al. Tropical race 4 of Panama disease in the Middle East[J]. Phytoparasitica, 2015, 43(3): 283-293.
- ODonnell K, Kistler H C, Cigelnik E, et al. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(5): 2044-2049.
- Viljoen A. The status of Fusarium wilt (Panama disease) of banana in South Africa[J]. South African Journal of Science, 2002, 98(7): 341-344.
- Ploetz, Randy. Panama disease: A classic and destructive disease of banana[J/OL]. Plant Health Progress. 2000, 10. DOI: 10.1094/PHP-2000-1204-01-HM.
- 张 磊, 郭 燕, 王云月, 等. 香蕉枯萎病菌TR4原生质体转化和基因敲除体系构建[J]. 植物病理学报, 2018, 48(1): 137-140.
- Zhang H, Mallik A, Zeng R S. Control of Panama disease of banana by rotating and intercropping with Chinese chive (Allium tuberosum Rottler): role of plant volatiles[J]. Journal of Chemical Ecology, 2013, 39(2): 243-252.
- 邓 晓, 李勤奋, 侯宪文, 等. 添加甘蔗渣对香蕉杆堆肥化过程中微生物种群的影响[J]. 中国农学通报, 2009, 25(15): 125-130.
- 匡石滋, 李春雨, 田世尧, 等. 复合菌剂对香蕉茎秆堆肥中微生物和养分含量的影响[J]. 中国农学通报, 2011, 27(6): 182-187.
- 黄永红, 吕 顺, 李春雨, 等. 香蕉枯萎病菌4号生理小种对香蕉根际土壤微生物及酶活性的影响[J]. 湖南农业大学学报(自然科学版), 2012, 38(2): 173-176.
- 洪 珊, 剧虹伶, 阮云泽, 等. 茄子与香蕉轮作配施生物有机肥对连作蕉园土壤微生物区系的影响[J]. 中国生态农业学报, 2017, 25(1): 78-85.
- 王一鸣, 赖朝圆, 阮云泽, 等.石灰联合碳铵熏蒸对连作香蕉生长和根际微生物群落结构的影响[J]. 中国南方果树, 2018, 47(3): 5-13.
- 张志红, 冯 宏, 肖相政, 等. 生物肥防治香蕉枯萎病及对土壤微生物多样性的影响[J]. 果树学报, 2010, 27(4): 575-579.
- 李 进, 樊小林, 蔺 中. 碱性肥料对土壤微生物多样性及香蕉枯萎病发生的影响[J]. 植物营养与肥料学报, 2018, 24(1): 212-219.
- 邓 晓, 李勤奋, 侯宪文, 等. 香蕉枯萎病患病与健康蕉园土壤微生物群落功能多样性的比较研究[J]. 土壤通报, 2013, 44(2): 355-362.
- 邓 晓, 李勤奋, 侯宪文, 等. 香蕉枯萎病不同感病级别植株根际与非根际土壤微生物物种多样性研究[J]. 中国农学通报, 2012, 28(30): 239-248.
- 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
- Martin M. CUTADAPT removes adapter sequences from high-throughput sequencing reads[J]. EMBnet.journal, 2011, 17(1): 10-12.
- Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200.
- Haas B J, Gevers D, Earl A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome research, 2011, 21(3): 494-504.
- Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
- Wang Q G, Garrity M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267.
- Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596.
- Edgar R. MUSCLE: multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research, 2004, 32(5): 1792–1797.
- Algina J, Keselman H J. Comparing squared multiple correlation coefficients: Examination of a confidence interval and a test significance[J]. Psychological Methods, 1999, 4(1): 76-83.
- Yang S L, Zhang J, Xu J X. Influence of the Three Gorges Dam on downstream delivery of sediment and its environmental implications, Yangtze River[J]. Geophysical Research Letters, 2007, 34(10): L10401.
- Sheik C S, Mitchell T W, Rizvi F Z, et al. Exposure of soil microbial communities to chromium and arsenic alters their diversity and structure[J]. PLoS One, 2012, 7(6): e40059.
- Kim S J, Ahn J H , Weon H Y, et al. Chujaibacter soli gen. nov., sp. nov., isolated from soil[J]. Journal of Microbiology, 2015, 53(9): 592-597.
- Yang X M, Shi J X, Feng Y G, et al. Tobacco bacterial wilt can be biologically controlled by the application of antagonistic strains in combination with organic fertilizer[J]. Biology & Fertility of Soils, 2013, 49(4): 447-464.
- 邓超超, 李玲玲, 谢军红, 等. 耕作措施对陇中旱农区土壤细菌群落的影响[J]. 土壤学报, 2019, 56(1): 207-216.
- 尚天翠, 卫 刚, 赵 玉. 新疆野生樱桃李林不同生态条件下土壤细菌数量变化及其影响因子研究[J]. 生物学杂志, 2015(2): 58-60.
- 刘艳霞, 李 想, 邹 焱, 等. 贵州省典型植烟生态区域根际土壤微生物群落多样性[J]. 生态学报, 2018, 38(9): 3145-3154.
- 曹志平, 李德鹏, 韩雪梅. 土壤食物网中的真菌/细菌比率及测定方法[J]. 生态学报, 2011, 31(16): 4741-4748.

