系统性轻链型淀粉样变性自体干细胞移植术后的造血重建
陈轻获 黄湘华 赵 亮 任贵生 陈文萃 郭锦洲 刘志红
系统性轻链型淀粉样变性(AL淀粉样变性)是由于单克隆免疫球蛋白轻链或其片段异常聚集,累及肾脏、心脏等多种组织器官,影响其功能进而导致死亡[1-2]。自体外周血干细胞移植(APBSCT)是治疗AL淀粉样变性的重要方法,可使患者达到完全且长期的血液学缓解,或者部分缓解[3-4]。未行诱导治疗直接行APBSCT的患者,血液学反应率32%~68%,完全缓解率(CR)16%~50%[5]。结合有效的诱导治疗,缓解率能进一步提升。此方法相较于骨髓移植,无移植排异反应,移植成功率高,能更快实现造血重建[6-7]。但是移植后治疗相关死亡率(TRM)高,阻碍其临床应用。移植后100d内尽快实现造血重建可以减少感染、出血等早期移植相关并发症,进而降低TRM,减少治疗相关费用,缩短住院时间。故本研究拟分析AL淀粉样变性患者行APBSCT后造血重建的影响因素。
对象和方法
研究对象本文为单中心回顾性研究。共纳入2010年7月至2018年6月期间在国家肾脏疾病临床医学研究中心全军肾脏病研究所诊断为AL淀粉样变性[8]后行APBSCT的211例患者。部分患者移植前接受诱导治疗,根据诱导治疗方式分为:(1)以硼替佐米为主的治疗方案;(2)以来那度胺、沙利度胺等免疫调节剂为主的治疗方案;(3)其他药物或者未接受诱导治疗。
干细胞动员和采集使用粒细胞集落刺激因子(G-CSF)单药进行动员,剂量为5~10 μg/(kg·d),连用4d后测定血中CD34+细胞计数,若达到15个/μl则开始采集。采集目标值为CD34+细胞计数>2×106/kg。
移植过程处理患者移植全程入无菌净化仓治疗。将干细胞回输时间定义为0d,“-2”d使用马法兰行预处理,根据疾病危险分层确定马法兰使用剂量[9]。高危组:≥3个器官受累(包括心脏),或采集的CD34+细胞计数2~2.5×106/kg;中危组:1~2个器官受累(包括心脏或者肌酐清除率<51 ml/min),采集的CD34+细胞计数>2.5×106/kg;低危组:无心脏受累,受累器官总数不超过2个,肌酐清除率>51 ml/min,采集的CD34+细胞计数>2.5×106/kg。高、中、低危组马法兰剂量分别为100 mg/m2、140 mg/m2、200 mg/m2。于“+1”d开始使用G-CSF直至粒系植入。进入粒缺时,开始预防性使用三代头孢防感染,使用重组人促血小板生成素(TPO)等促进血小板重建,按需输注辐照单采血小板和悬浮红细胞,使血小板 >20×109/L ,血红蛋白(Hb)>70 g/L。若患者体温>38℃,更换头孢为碳青霉烯类抗生素;若血培养阳性,则根据药敏结果使用敏感抗生素。
植入时间的定义白细胞回升后连续3d>1.0×109/L的第1天为粒系植入时间。血小板下降至最低后升高,在不输血的情况下,连续3d>20×109/L的第1天为血小板植入时间[10]。
根据粒系与血小板植入中位时间,将同时满足粒系植入时间≤中位值且血小板植入时间≤中位值的患者定义为快速植入组,其余患者为对照组。
统计学方法数据分析使用《SPSS 25.0》软件。主要观察指标是粒系植入和血小板植入的时间。描述性分析基线指标、采集、移植过程相关因素,不符合正态分布的数据用中位数(25%,75%)或者中位数(最小值~最大值)描述。符合正态分布和不符合正态分布的资料分别使用t检验和非参数检验(K-W检验、U检验)进行组间比较。使用Logistic单因素回归比较快速植入组和对照组资料,使用COX单因素回归对所有因素与粒系和血小板植入的关系分别进行分析,再按P<0.1的标准选择满足条件的变量分别纳入Logistic、COX多因素回归分析。P<0.05为差异有统计学意义。
结 果
一般情况本组211例患者中位年龄52(35~67)岁,男性112例(53.1%),λ轻链型183例(86.7%)。183例(86.7%)表现为肾病综合征,110例(52.1%)存在心脏受累。尿蛋白中位值4.0 g/24h,肌酐中位值70.7 μmol/L,白细胞中位值6.1×109/L,肌钙蛋白T中位值0.016 ng/ml,B型脑钠肽中位值86.75 pg/ml,室间隔厚度中位值10.5 mm,左室射血分数中位值66%(表1)。114例(54%)患者诱导治疗方案以硼替佐米为主,33例(15.6%)以免疫调节剂为主,另64例(30.3%)未曾接受诱导治疗。移植前接受中位化疗2个疗程。
移植情况干细胞采集量CD34+细胞计数的中位值为8.4×106/kg。采集到回输中位时间46d,确诊到移植中位时间5个月,住院中位时间26d。动员使用G-CSF的中位剂量为6.67 μg/(kg·d)。使用马法兰剂量200 mg/m2的有129例(61.1%),140 mg/m2的68例(32.2%),余14例(6.6%)为100 mg/m2。180例(85.3%)使用了TPO。有72例(34.1%)患者输注了大于2个治疗量的血小板,61例(28.9%)输注了红细胞。
粒系植入所有患者均在出院前实现了粒系植入。植入中位时间是10(8~22)d。CD34+≥8.4×106/kg的患者,粒系植入时间为9(8~14)d,CD34+≤5×106/kg的患者,粒系植入时间是10(9~22)d,CD34+为5~8.4×106/kg的患者,粒系植入时间是10(8~15)d。非参数检验组间比较,发现CD34+≥8.4×106/kg组与≤5×106/kg组在植入时间上存在统计学差异(表2)。
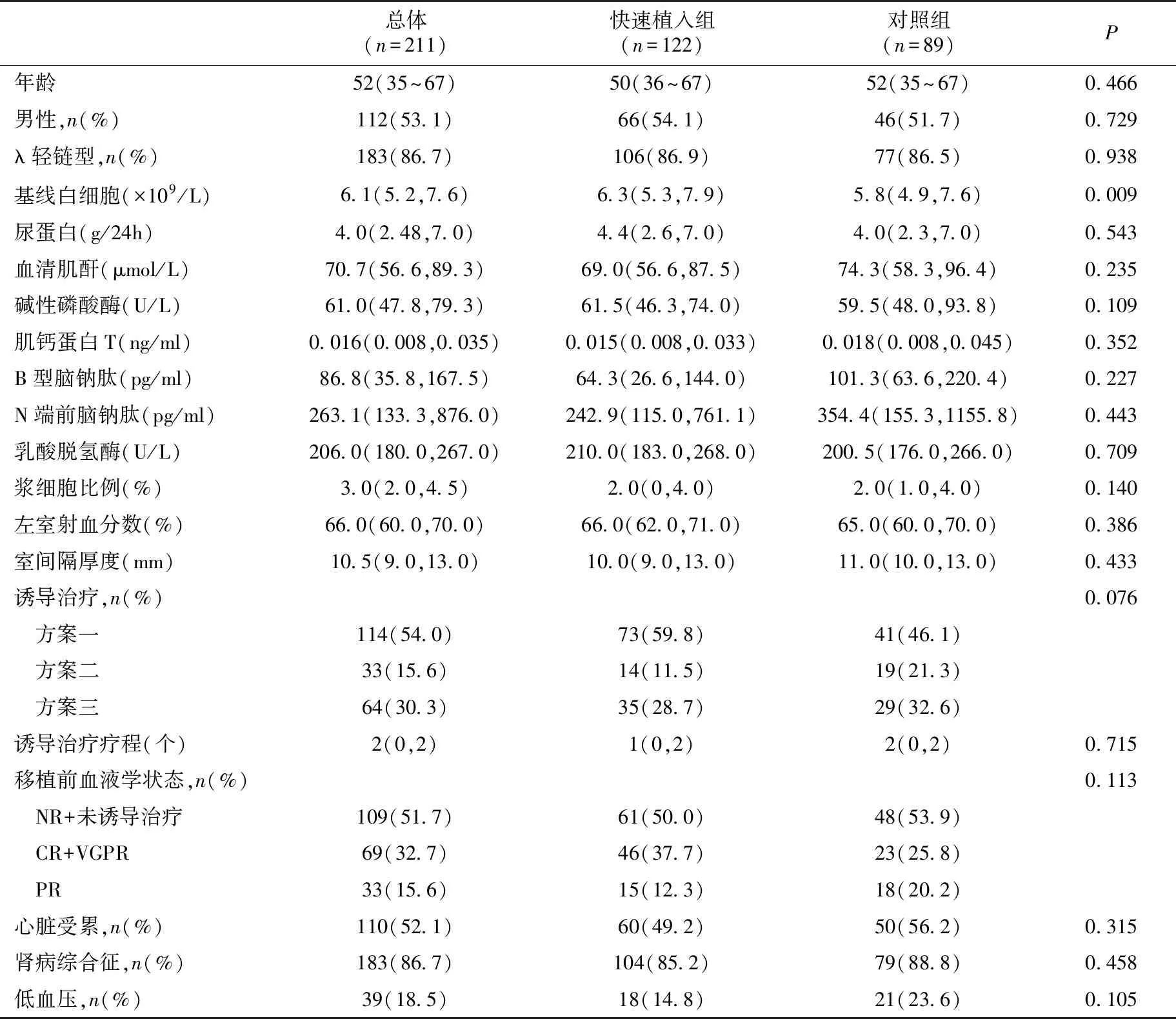
表1 自体外周血造血干细胞移植患者基线资料
诱导治疗方案一:硼替佐米为主;方案二:来那度胺、沙利度胺等免疫调节剂为主;方案三:无诱导治疗;NR:无反应;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解

表2 CD34+与造血重建时间的关系
a:与≤5×106/kg组相比,P<0.05;b:与5~8.4×106/kg组相比,P<0.05;*:两例未早期植入
COX单因素回归分析发现,移植前血液学状态、干细胞采集量、马法兰剂量、使用TPO、移植前白细胞值等变量的P值<0.1。将这些变量纳入COX多因素回归模型:马法兰剂量200 mg/m2的患者实现快速植入的概率是剂量减量患者的1.56倍(95%CI 1.174~2.074,P=0.002)。移植前血液学达到PR以上的患者实现粒系快速植入的概率是无反应(NR)以及无诱导治疗患者的1.407倍(表3,图1A-B)。CD34+在多因素分析中无统计学差异。
血小板植入209例(99%)患者在移植后100天内实现血小板植入。植入中位时间是11(8~31)d。非参数检验行组间比较,发现CD34+≥8.4×106/kg与其他两组在血小板植入时间上存在统计学差异(表2)。
COX单因素回归分析显示,干细胞采集量、马法兰剂量、诱导治疗方式、诱导化疗疗程、基线肌酐值、移植前白细胞值、移植前血小板值、使用TPO等这些变量的P值<0.1。纳入COX多因素回归模型:马法兰剂量200 mg/m2的患者实现快速植入的概率是减量患者的1.809倍(表3,图1C)。

表3 造血重建时间的COX多因素回归分析
NR:无反应;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解
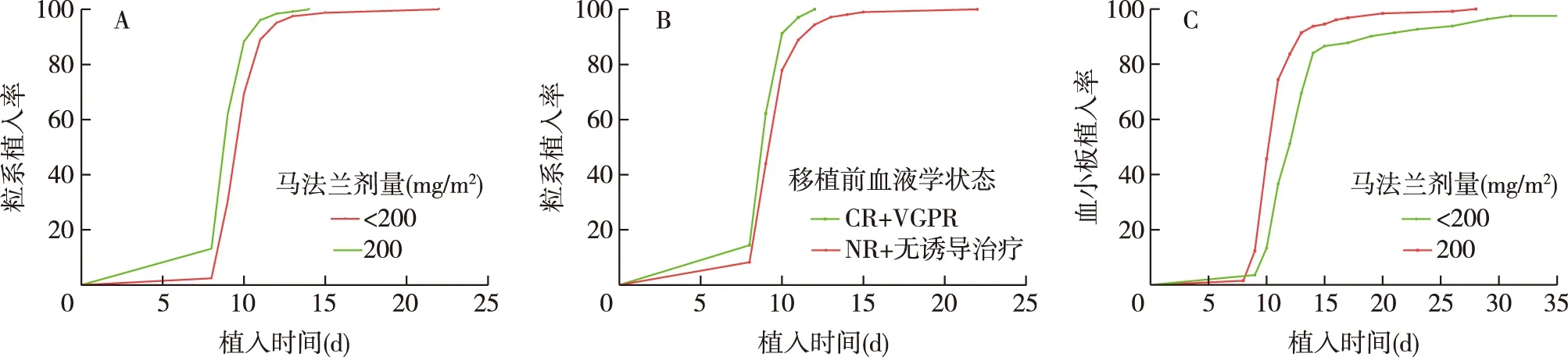
图1 A:马法兰剂量与粒系植入的关系;B:移植前血液学状态与粒系植入的关系;C:马法兰剂量与血小板植入的关系
影响粒系与血小板快速植入的因素根据粒系与血小板植入中位时间,将同时满足粒系植入时间≤10d,血小板植入时间≤11d的患者纳入快速植入组,其余患者为对照组。快速植入组共122例(58%),对照组89例(42%),两组间基线资料数据见表1。Logistic分析发现快速植入组住院时间更短,血小板输注需求更小。
选择移植前白细胞、移植前血小板、诱导治疗方式、干细胞采集量、采集到回输时间、马法兰剂量、使用TPO等变量纳入Logistic多因素回归模型,结果示,马法兰剂量200 mg/m2的患者有更大的可能性实现快速植入(HR=3.66,95%CI 1.948~6.876,P<0.001)。CD34+≥8.4×106/kg的患者快速植入的概率是CD34+≤5×106/kg患者的3.113倍。移植前白细胞偏低的患者不利于早期快速植入(表4)。
讨 论
AL淀粉样变性患者行APBSCT治疗,可清除体内的异常克隆细胞,实现快速而持久的血液学重建[11-14]。由于该疾病常累及多种脏器,且多见于老年人,因而与其他疾病行APBSCT的患者相比,TRM更高[12]。相对淋巴瘤、多发性骨髓瘤等疾病,AL淀粉样变性的发病率低[11],且所有患者中仅15%~20%满足移植要求[2],因而行APBSCT的病例偏少,针对国内人群的此项研究较匮乏,本研究回顾了近8年满足纳入条件的病例,样本量较大,对于指导中国AL淀粉样变性患者行APBSCT更具有参考价值。
本研究中患者粒系和血小板植入的中位时间分别是10d和11d。Oran等[15]的研究中,粒系和血小板植入中位时间分别是10d和13d,对比两组数据,本中心患者年龄、肌酐、尿蛋白等基线情况更优,干细胞量更大。李剑等[14]的一项研究中粒系和血小板植入的中位时间均为11d,对比可参考资料,本中心患者年龄、蛋白尿等情况更优。针对植入时间的差别,可能与样本量相对少,患者的基线情况及移植相关处理存在差异有关。
本研究在探究CD34+与造血重建关系部分,运用了多种检验方式。在非参数检验中,CD34+>8.4×106/kg组与5~8.4×106/kg组在血小板植入时间上存在差别。CD34+>8.4×106/kg组与<5×106/kg组在粒系、血小板植入时间上均存在差异。COX单因素及Logistic分析中也显示出差异,但是COX多因素分析未支持此结论。所以我们认为干细胞数量更多者可能有利于快速植入的趋势,对血小板的影响趋势更明显。此结果与以往认为CD34+达到5×106/kg后增加剂量与早期植入率之间无明显相关性有所差异[16-18]。但也有研究表明当CD34+>7×106/kg有利于快速植入[7,19],亦有研究显示当CD34+>10×106/kg可实现更快速地植入[20],这与我们在大剂量时有利于快速植入的趋势相符。有研究只发现CD34+与血小板植入的关系,未发现其与粒系植入的关系[21],这与我们的结果中血小板趋势更明显相仿。针对CD34+与植入之间关系的不同研究结果,一方面可能与样本量及样本比例有关,本研究人群中,CD34+<2.5×106/kg的患者偏少,大剂量CD34+患者较多,故重点在于研究大剂量CD34+的影响,未以CD34+<2.5×106/kg作为对照,与以往研究存在差异,另一方面可能与患者的标准化不佳有关。
本研究发现预处理使用大剂量马法兰有利于快速植入,具体原因尚不明确。移植前诱导治疗使用大剂量马法兰会影响骨髓微环境,但是AL淀粉样变性患者由于移植前治疗对于骨髓微环境的破坏相对其他疾病较轻,预处理使用标准剂量的马法兰在更彻底清髓的同时不足以破坏骨髓微环境,因而可能更有利于植入。同时,马法兰剂量是根据疾病危险分层确定的,使用马法兰200 mg/m2的患者,其基线指标更佳,也是影响结果的原因之一。
移植前白细胞偏低的患者粒系不易快速植入,可能是患者自身细胞增生与分化能力上存在差异,也不排除白细胞偏低患者样本量较少引起的误差。移植前血液学达到CR或者非常好的部分缓解(VGPR)的患者相较于NR或者未诱导化疗的患者能在更短的时间内实现粒系植入,而PR的患者在植入时间上则无明显差异。可能达到PR以上反应的患者其疾病负荷更轻,骨髓功能更为良好。
综上所述,APBSCT后造血重建受多种因素影响,CD34+计数、预处理马法兰剂量及移植前患者的骨髓微环境情况都是重要的影响因素。干细胞数量更多有利于快速植入的趋势,对血小板的影响趋势更明显,对于预处理适合使用标准剂量马法兰的患者快速植入可能性大,移植前通过诱导治疗达到VGPR甚至CR的患者粒系有更快植入趋势。早期快速植入的患者住院时间更短,输注血小板需求更小。

