鼠伤寒沙门菌sseK3基因缺失株的构建及其生物学特性研究①
杜付玉 廖成水 郁 川 张春杰 程相朝 杨亚东
(河南科技大学动物科技学院,洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471023)
鼠伤寒沙门菌(Salmonella enterica serovar typhimurium)一直是世界范围内引起人类食物中毒的主要病原菌[1]。目前主要通过抗生素进行预防和治疗,但随着抗生素的滥用,增强了沙门菌的耐药性,这不仅降低了治疗效果,而且增加了预防和控制的负担[2]。目前通过基因工程方法构建减毒沙门菌作为口服疫苗是研究的热点[3]。
不同沙门菌致病岛(SPI1和SPI2)编码的Ⅲ型分泌系统(type Ⅲsecretion system,T3SS)分泌到细胞中的一系列效应物,帮助沙门菌逃避宿主的杀伤作用并在宿主细胞内存活和复制[4]。沙门菌分泌性蛋白K3(Salmonella secreted effector K3,SseK3)是新发现的一种沙门菌T3SS的效应蛋白。研究推测sseK3可能参与了沙门菌的毒力,但具体的作用机制尚不明确[5]。目前对于sseK3的研究相对滞后,且有关于鼠伤寒沙门菌sseK3基因功能等相关研究在国内尚未见报道。因此,本研究运用重组自杀性质粒介导的等位基因交换技术,构建鼠伤寒沙门菌sseK3基因缺失株,并对其生物学特性进行检测,为更进一步探究sseK3基因的功能及鼠伤寒沙门菌减毒活疫苗的研发提供理论依据。
1 材料与方法
1.1材料 鼠伤寒沙门菌SL1344标准毒株、大肠杆菌χ7213和自杀性质粒pRE112、大肠杆菌DH5α、pBR322质粒均由本室保存;沙门菌属诊断血清(11种)和各种单因子血清均购自宁波天润生物药业有限公司;兔抗鼠IgG-HRP酶标二抗购自北京博奥森生物技术有限公司;二氨基庚二酸(D L-α,ε-Diaminopimelic acid,DAP)购自美国Sigma-Aldrich公司;TMB显色液购自碧云天生物技术研究所;质粒提取试剂盒和DNA凝胶回收试剂盒均购自生工生物工程(上海)股份有限公司;细菌微量生化反应管购自杭州滨和微生物试剂有限公司;实验动物均为6周龄BALB/c小鼠(雌雄各半),合格证号SCXK(豫)2017-000l,购自郑州大学实验动物中心。
1.2方法
1.2.1引物设计与合成 根据相关文献[6]及GenBank中的鼠伤寒沙门菌SL1344(No.U25631.1)设计引物(见表1),所有引物均由生工生物工程(上海)股份有限公司合成。
1.2.2重组自杀性质粒pRE112ΔsseK3的构建及鉴定 以鼠伤寒沙门菌SL1344基因组为模板,用引物PsA/PsB和引物PsC/PsD分别扩增上下游同源臂。通过融合PCR,用引物PsA和PsD扩增出不含sseK3基因的同源重组片段,克隆至质粒pMD18-T,构建重组质粒pMD18-T-AD,双酶切并连接至自杀性质粒pRE112,进而转化至χ7213中,得到重组质粒pRE112-AD,将其命名为pRE112ΔsseK3。
1.2.3鼠伤寒沙门菌sseK3缺失株的构建及筛选 通过自杀性质粒介导细菌基因的接合转移,两步筛选法筛选出基因缺失株。其中χ7213(pREΔsseK3)作为供体菌,SL1344为受体菌。将χ7213(pREΔsseK3)和SL1344混合,在37℃培养24 h,将培养好的菌液均匀涂布于平板,挑选Cm抗性的菌落, 设供体菌和受体菌对照, 使用引物PsE/PsF进行扩增鉴定阳性接合子。将阳性接合子转接至无NaCl的LB培养基(NB),加入10%的蔗糖,37℃过夜培养后,稀释至一定稀释度,将其涂布至麦康凯平板(含有1%麦芽糖),初步筛选出sseK3缺失株。使用引物PsG/PsF、PsE/PsF对sseK3缺失株进行PCR扩增并送至生工生物工程(上海)股份有限公司测序。
表1 PCR扩增所需引物
Tab.1 Primer for PCR amplification

Gene amplifiedPrimerPrimer sequence(5′-3′)Restriction siteFragment length(bp)Upstream of sseK3PsATCTAGACCGCGAGTGACATCAATATTAXbaⅠ1 019PsBCATACGTTTGCAAATAATTTTCAACCCTTACGCTADownstream of sseK3PsCTAGCGTAAGGGTTGAAAATTATTTGCAAACGTATG1 037PsDGGTACCTACCTGGAACAATGCAGGTTKpnⅠsseK3/ΔsseK3PsEGCCCCCCCTAACCAAGTAAAAACTAT1 463(wt)PsFCTAAATATTCAGGCGGGTTTATTACCC455(ΔsseK3)sseK3/ΔsseK3PsGAGCGCGTTTCCCTCACAGCAATTAAT2 410(wt)PsFCTAAATATTCAGGCGGGTTTATTACCC1 402(ΔsseK3)sseK3PFAAGCTTATGTTTTCTCGAGTCAGAHindⅢ1 008PRGGATCCTTATCTCCAGGAGCTGATABamHⅠinvAPs1CAGGATACCTATAGTGCTGC580Ps2CGCACCGTCAAAGGAACCGT
1.2.4鼠伤寒沙门菌sseK3互补菌株的构建与鉴定 以鼠伤寒沙门菌SL1344基因组为模板,用引物PF/PR扩增出sseK3基因,然后将扩增出的sseK3基因片段回收并连接至pMD18-T载体,构建重组质粒pMD18-T-sseK3,经PCR及测序鉴定正确后,用HindⅢ和BamHⅠ双酶切pMD18-T-sseK3,回收片段并将其连接至质粒pBR322,构建重组质粒pBR322-sseK3。然后电转至构建的SL1344ΔsseK3缺失菌株中构建回复菌株SL1344CΔsseK3,挑取单个菌落进行PCR及双酶切鉴定并进行序列测定。
1.2.5鼠伤寒沙门菌sseK3缺失株生物学特性检测
1.2.5.1sseK3缺失株的表型鉴定及生化特性分析 缺失菌株SL1344ΔsseK3的表型鉴定:利用玻片凝集试验鉴定sseK3缺失株的血清型,并将sseK3回复菌株、sseK3缺失株与亲本株SL1344分别接种于有无1%麦芽糖的麦康凯琼脂平板,然后转接至葡萄糖、乳糖、麦芽糖等细菌微量生化反应管中检测。
1.2.5.2sseK3缺失株遗传稳定性的测定 在LB液体培养基中,将sseK3缺失株连续传60代,用PsG/PsF引物进行PCR分别扩增鉴定第10、20、30、40、50、60代,检测sseK3缺失株是否能够稳定遗传。
1.2.5.3sseK3缺失株生长曲线的绘制 将sseK3缺失株、sseK3回复菌株与亲本株SL1344分别接种于LB培养基,并在37℃下培养14 h,分别取菌液稀释至一定浓度并涂至LB固体平板上,通过板上的菌数进而计算初始菌液中的菌数。然后,将细菌转接至相同的液体培养基致终浓度为106CFU/ml,每间隔1 h进行涂板计算菌液中的菌数,通过记录每小时的菌数从而绘制生长曲线。
1.2.5.4sseK3缺失株半数致死量(LD50)的测定 将192只6周龄BALB/c小鼠,随机分为16组,每组12只。将sseK3缺失株、回复菌株和亲本株SL1344在LB液体培养基中于37℃培养过夜,并进行平板计数以计算攻毒剂量。选取合适的稀释度,每个稀释度口服感染12只6周龄BALB/c小鼠,每只200 μl,观察直至无小鼠死亡,同时设生理盐水空白对照组。用SS和1%麦芽糖的麦康凯固体平板无菌接种死亡小鼠的肝脏,并对invA基因进行PCR扩增,确定并记录小鼠的真实死亡情况,记录的结果根据Bliss法计算出小鼠的半数致死量(LD50)。
1.2.5.5sseK3缺失株免疫小鼠IgG抗体的测定 将56只6周龄BALB/c小鼠随机分为实验组与对照组,实验组分别于第1天、8天以sseK3缺失株(1×106CFU)灌服进行一免、二免,对照组灌服等量生理盐水。于二免后1、7、11、14、21、28、35 d从实验组与对照组中每次分别取4只小鼠采血分离血清,参照参考文献[6],以鼠伤寒沙门菌SL1344裂解物作为检测抗原,应用间接ELISA方法检测各个血清中的IgG抗体水平。
1.2.5.6sseK3缺失株免疫小鼠保护率的测定 将48只6周龄BALB/c小鼠平均随机分成4组,分别设sseK3缺失株实验组1和组2,生理盐水阴性对照组1和组2。制备免疫和攻毒菌液,分别于第1天和第8天对实验组以sseK3缺失株(1.0×106CFU)对每只小鼠灌服免疫,对照组灌服等量的生理盐水。在第二次免疫后第7天,利用SL1344亲本株(1.0×107CFU)分别对实验组1、阴性对照组1小鼠进行灌胃,但是实验组2、阴性对照组2的小鼠不进行攻毒。观察并记录21 d小鼠的死亡情况,计算sseK3缺失株的免疫保护率。
1.3统计学处理 实验数据使用GraphPad Prism 5.0和SPSS20软件分析,实验数据差异性分析采用t检验或者ANOVA分析,各组间差异比较采用方差分析。
2 结果
2.1重组自杀性质粒pREΔsseK3的构建 对构建的重组自杀性质粒pREΔsseK3进行双酶切,酶切出现两条带,约为5 170 bp和2 056 bp,与预期的片段大小一致(图1)。进一步测序结果表明,成功构建了重组自杀性质粒pREΔsseK3。
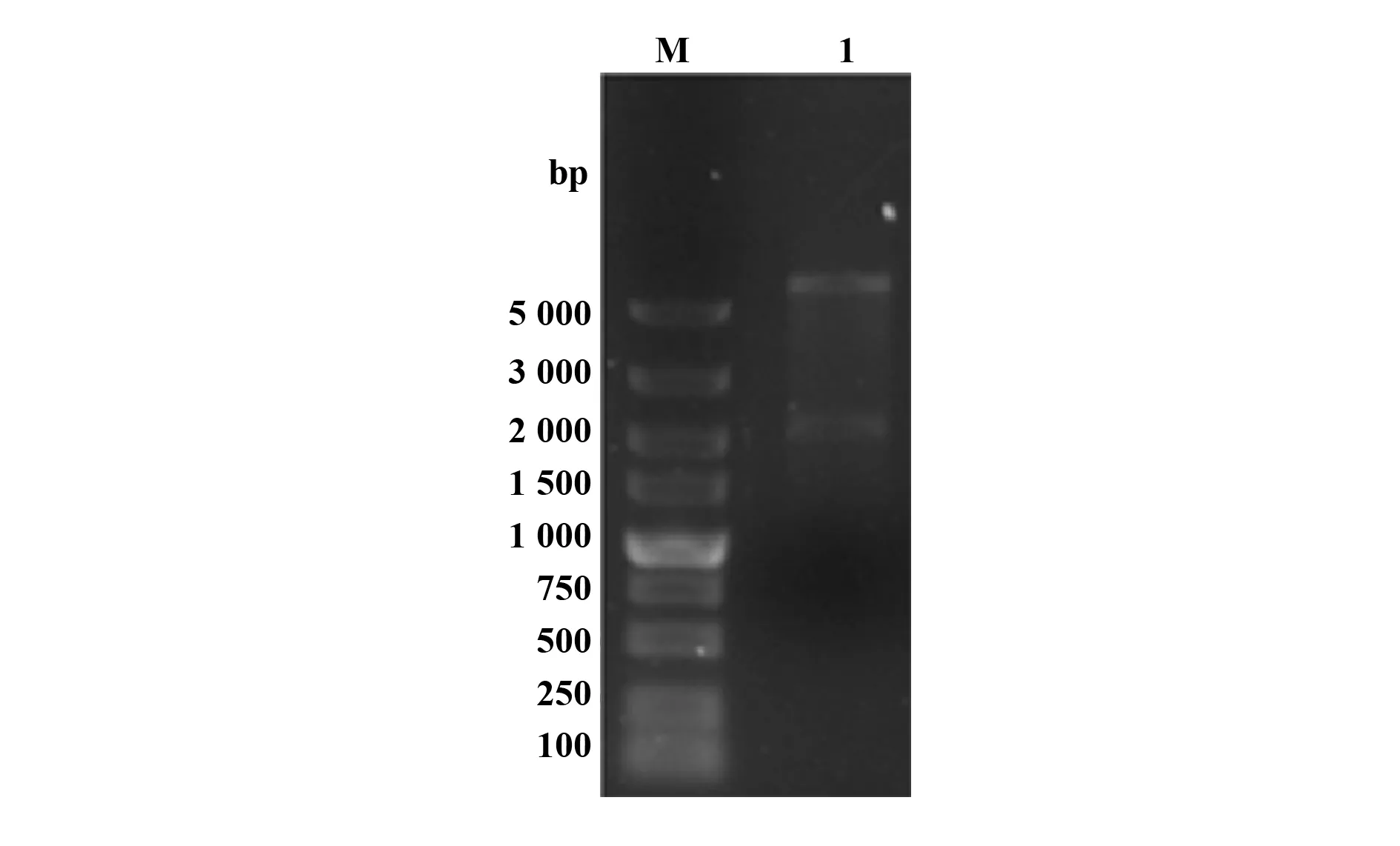
图1 重组自杀性质粒pREΔsseK3的酶切鉴定Fig.1 Identification of recombination suicide vector pRE-ΔsseK3Note: M.DL5000 DNA marker;1.Double digestion identification with XbaⅠ and KpnⅠ.
2.2sseK3缺失株的筛选及鉴定 供体菌和受体菌在经过第一次同源重组后,通过sseK3的上臂内部引物PsE和下臂内部引物PsF扩增鉴定接合子,得到约为1 463 bp和455 bp共2条带(图2A)。接下来,阳性接合子在加入10%蔗糖的NB培养基上进行第二次同源重组,用引物PsE/PsF扩增出大小为455 bp和1 463 bp的两条片段(图2B)。使用sseK3下臂内部引物PsF和上臂外部引物PsG通过PCR扩增阳性缺失株,从而证明同源重组发生在SL1344染色体上,结果发现,野生型扩增出2 410 bp的片段,缺失菌株扩增出1 402 bp的片段(图2C)。同时,生工测序结果也进一步说明成功构建了sseK3缺失株,菌株被命名为SL1344ΔsseK3。
2.3回复菌株SL1344CΔsseK3的构建 将回收的sseK3连接至pBR322并电转至sseK3缺失株感受态细胞,进行PCR及双酶切鉴定,PCR扩增出约1 008 bp片段;酶切出了大小约4 361 bp的载体条带和约1 008 bp的目的条带,与预期结果相一致,说明sseK3回复菌株构建成功(图3)。
2.4sseK3缺失株生物学特性检测sseK3缺失株的表型鉴定:血清型鉴定表明sseK3缺失菌株与亲本菌株SL1344的血清型相同,均为1,4,5,12:i:1,2。生化鉴定结果表明,sseK3缺失菌株与亲本菌株SL1344相比,其生化特性没有发生明显变化,与亲本菌株SL1344保持一致。
2.5sseK3缺失株遗传稳定性测定 用PsG/PsF引物分别对第10、20、30、40、50、60代的sseK3缺失株的单菌落进行PCR鉴定,均得到了约1 402 bp的片段(图4),结果显示,sseK3缺失株能够稳定遗传。
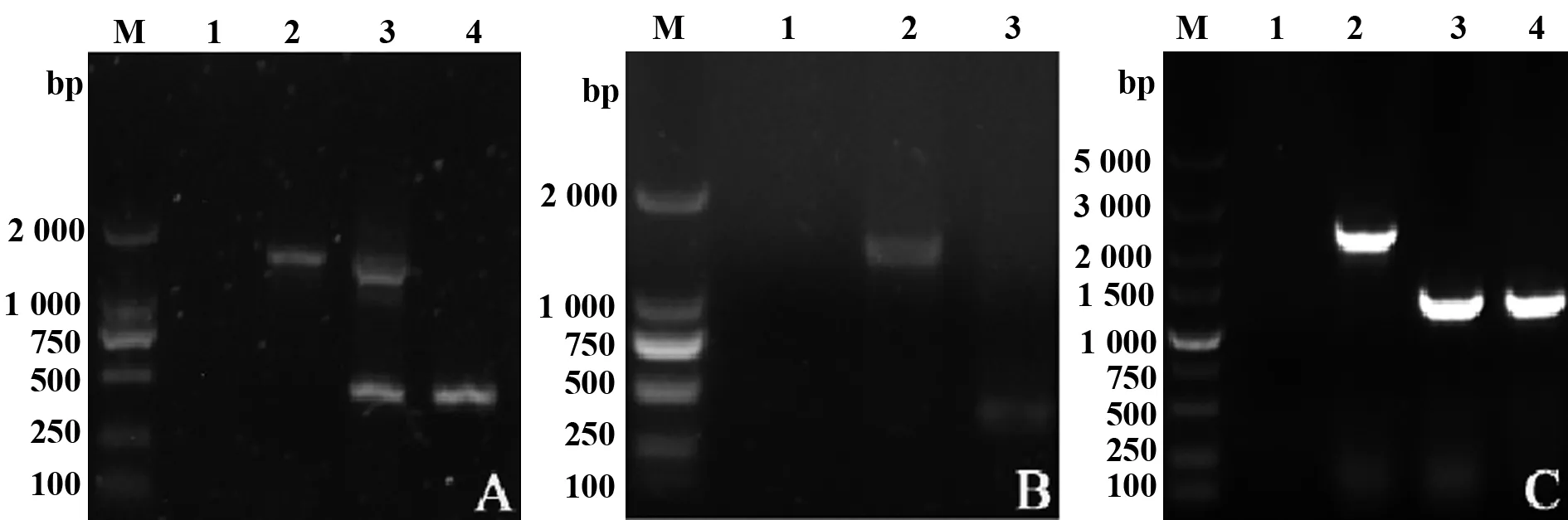
图2 sseK3缺失株的PCR鉴定Fig.2 PCR identification of sseK3 mutant strain of Salmonella typhimuriumNote: A.PCR identification of ΔsseK3 mutant conjugants with PsE and PsF;M.DL2000 DNA Marker;1.ddH2O control;2.SL1344 control;3.ΔsseK3 mutant conjugants;4.SL1344ΔsseK3;B.PCR identification of ΔsseK3 mutant with PsE and PsF;M.DL2000 DNA Marker;1.ddH2O control;2.SL1344 control;3.SL1344ΔsseK3;C.PCR identification of ΔsseK3 mutant with PsG and PsF;M.DL5000 DNA Marker;1.ddH2O control;2.SL1344 control;3,4.SL1344ΔsseK3.
2.6sseK3缺失株生长特性鉴定sseK3缺失株、sseK3回复菌株与亲本株SL1344分别经过培养并计数,结果显示,sseK3缺失株的生长速度与亲本株SL1344和sseK3回复菌株无显著差异(图5)。
2.7sseK3缺失株半数致死量(LD50)的测定sseK3缺失株、sseK3回复菌株与亲本株SL1344口服感染小鼠后,观察小鼠的死亡情况。经过剖检死亡小鼠,均发现存在沙门菌导致的病理变化,从死亡的小鼠分离细菌,分离得到的细菌均能用pi1/pi2引物扩增出约580 bp的目的条带,然而生理盐水对照组中的小鼠均正常。记录的结果通过Bliss法计算LD50,sseK3缺失株的LD50为2.96×108CFU,亲本株SL1344的LD50为2.86×105CFU,sseK3回复菌株的LD50为6.16×105CFU。且sseK3缺失株与亲本菌株相比,LD50值升高约1 035倍,毒力明显下降(表2)。
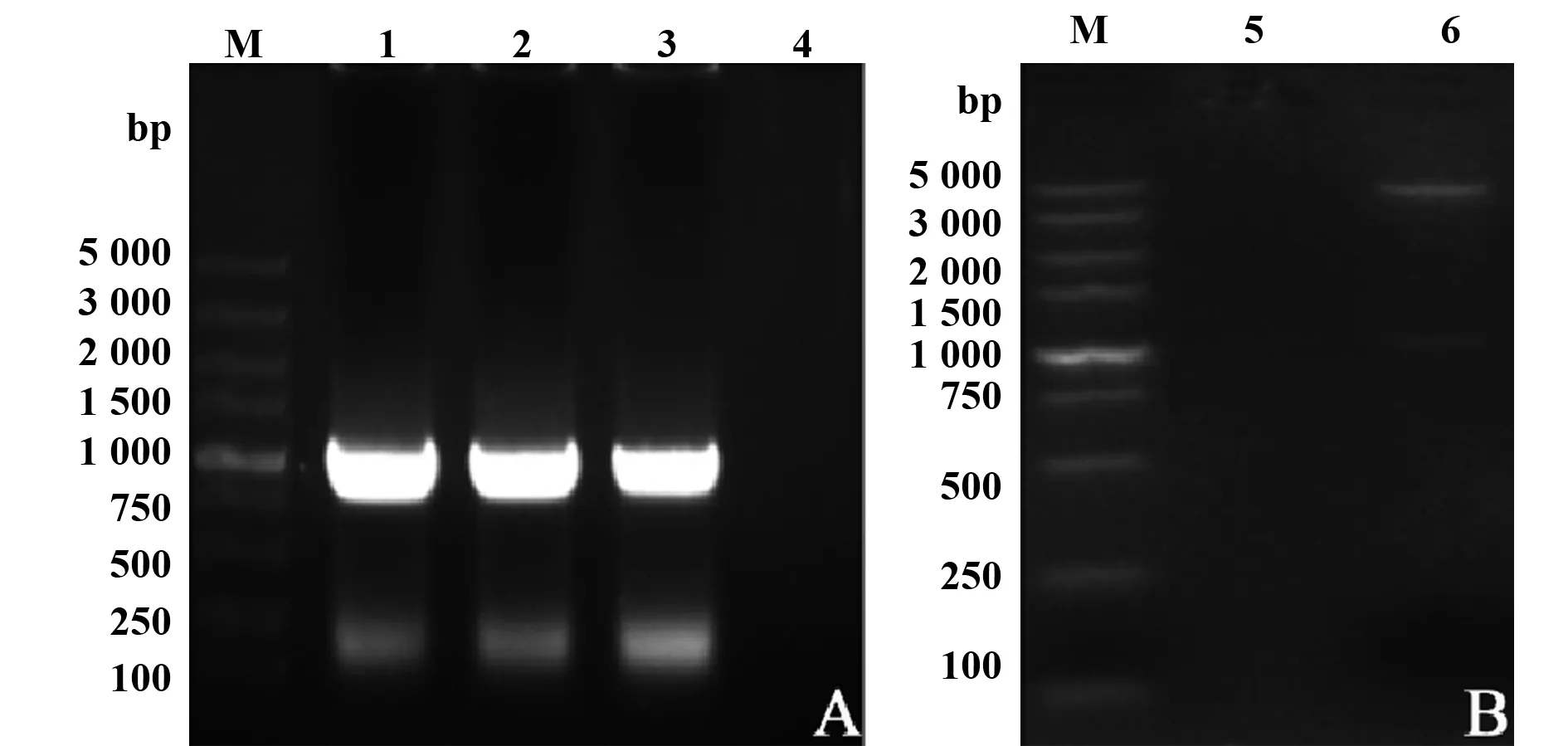
图3 回复菌株SL1344CΔsseK3的鉴定Fig.3 Identification of SL1344CΔsseK3 strainNote: A.Verification of the pBR322-sseK3 electroporated into SL1344ΔsseK3;M.DL5000 DNA Ladder;1-3.SL1344C ΔsseK3;4.ddH2O control;B.Identification of recombination SL1344 ΔsseK3(pBR322-sseK3);M.DL5000 DNA Ladder;5.ddH2O control;6.Double digestion identification with HindⅢ+BamHⅠ.
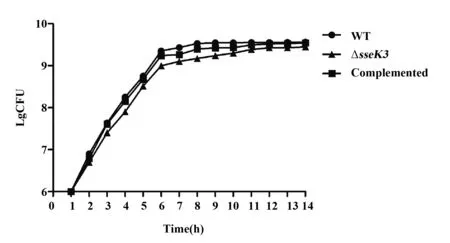
图5 sseK3缺失株生长特性检测Fig.5 Growth characterization of SL1344ΔsseK3 mutant
表2sseK3缺失株LD50的测定
Tab.2 Determination of LD50ofsseK3deletion strain
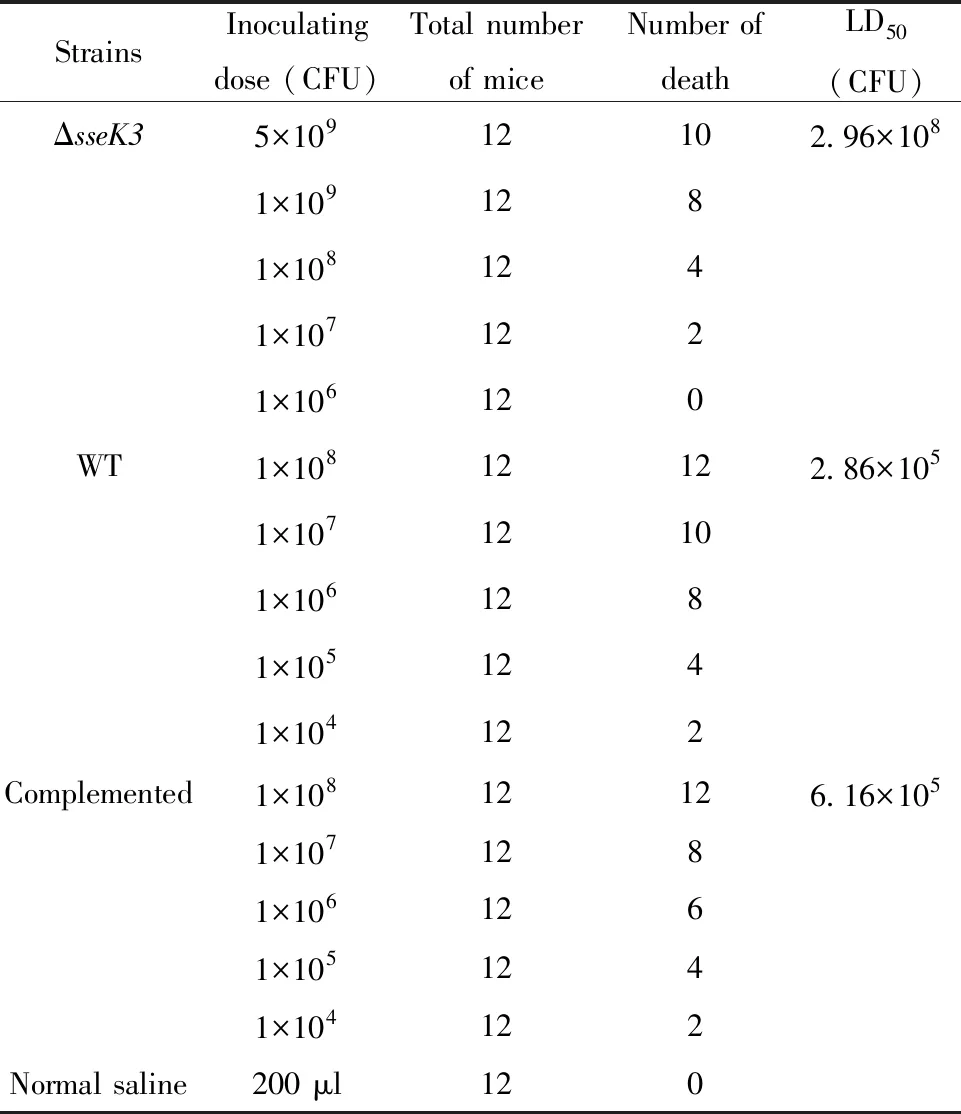
StrainsInoculatingdose (CFU)Total numberof miceNumber ofdeathLD50(CFU)ΔsseK35×10912102.96×1081×1091281×1081241×1071221×106120WT1×10812122.86×1051×10712101×1061281×1051241×104122Complemented1×10812126.16×1051×1071281×1061261×1051241×104122Normal saline200 μl120
2.8sseK3缺失株免疫小鼠血清特异性IgG抗体的检测sseK3缺失株免疫组小鼠血清IgG水平与对照组相比,结果发现sseK3缺失株免疫小鼠能够一定程度上刺激小鼠产生体液免疫应答,而且sseK3缺失株免疫小鼠血清在免疫后的第14天,IgG抗体水平含量达到最高,在免疫后第21天,呈现出逐渐降低的趋势(图6)。
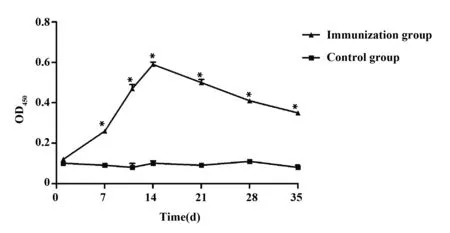
图6 sseK3缺失株免疫小鼠血清的IgG抗体检测Fig.6 Detection of IgG antibody in serum of mice immunized with sseK3 deletion strainNote: Compared with control group,*.P<0.05,n=3.
2.9sseK3缺失株免疫保护率的测定 在进行强毒株SL1344攻毒后,对照组1中的所有小鼠14 d内均死亡;在实验组1中的2只小鼠在1~7 d死亡,2只小鼠在8~14 d死亡,其余8只直至实验结束均正常存活,对照组2和实验组2中的12只小鼠均存活至观察期结束。结果显示,sseK3缺失株对小鼠的免疫保护率为66.7%。
3 讨论
鼠伤寒沙门菌是目前威胁人类健康的主要人畜共患菌之一,主要通过摄入被污染的食物和水源引发感染,有关鼠伤寒沙门菌感染的报道每年呈递增的趋势[7,8]。因此,近年来对鼠伤寒沙门菌致病因子的研究及减毒标记活疫苗的研发备受关注。国外已有研究发现,sseK3是沙门菌的一种新型转运蛋白[5,9],但是国内有关sseK3基因的作用机制及其生物学特性方面的研究尚未见报道。
因此,为探索sseK3基因的功能,本研究中使用的自杀性质粒pRE112筛选重组菌株不影响生物体的其他遗传性状,并且简单、准确、快速,非常适合研究某种基因在自然生物体环境内的功能,使用pRE112获得的ΔsseK3缺失菌株没有任何抗生素抗性[10]。通过同源重组、抗性筛选标记和PCR检测技术,筛选出无任何抗性的sseK3缺失株,并对其生物学特性进行了一系列的比较研究,结果发现,sseK3缺失菌株、亲本菌株和其回复菌株的生长特性与生化特性之间无显著差异,这说明sseK3很可能不参与鼠伤寒沙门菌的代谢过程。根据小鼠LD50的比较分析,结果发现sseK3缺失株与亲本菌株相比,LD50值升高约1 035倍,表明sseK3基因缺失株的毒力较SL1344亲本菌株明显下降,sseK3与鼠伤寒沙门菌的毒力作用相关。这与Brown等[11]报道的sseK3参与沙门菌的毒力的结果相一致。对免疫小鼠血清抗体检测结果发现缺失株免疫组小鼠血清IgG抗体水平在免疫后呈现先上升后下降的趋势,并于免疫后第14~21天达到最高水平,表明sseK3缺失株免疫小鼠在一定程度上能够刺激小鼠产生一定的抗体,对小鼠有一定的保护作用,这与陈松彪等[12]发现的鼠伤寒沙门菌SL1344免疫小鼠后IgG检测结果相符。通过小鼠的免疫保护率实验,结果发现sseK3缺失株免疫小鼠后用强毒株攻毒有66.7%的免疫保护率,佐证了SL1344株ΔsseK3缺失株的免疫作用。回复菌株与亲本亲株生物学特性无显著性差异,基本回复到野生型水平,这说明sseK3在鼠伤寒沙门菌发挥毒力的过程中起到了重要作用,但具体机制仍然没有得到很好的解答。
总之,本研究成功构建出了鼠伤寒沙门菌sseK3缺失菌株,sseK3缺失菌株、亲本菌株和回复菌株的生长特性和生化特性均无显著差异,毒力却显著降低,具有良好的免疫原性,因此本研究将进一步对sseK3基因的功能进行探究,这为鼠伤寒沙门菌致病岛分泌蛋白的致病机制的研究提供了新思路,并为进一步评估sseK3在细菌内发挥毒力作用的具体机制奠定基础,更为其更好作为用于减毒活疫苗的候选物提供参考依据。

