白藜芦醇抗骨肉瘤细胞增殖及增强其免疫原性的研究①
童晨曦 姜晓玲 刘 美 陈昌蓉 曾 艳 宋银宏
(三峡大学医学院病原与免疫学系,三峡大学感染与炎症损伤研究所,宜昌 443002)
骨肉瘤(Osteosarcoma,OS)是一种多发生于儿童和青少年的骨恶性肿瘤,其恶性程度极高。目前,骨肉瘤的主要治疗方案是手术和放化疗。多种治疗手段的发展使患者的5年生存率提高到60%,但发生转移的患者5年生存率小于20%[1]。对抗癌疗法产生抗性是造成肿瘤转移和患者死亡的主要原因,其发生机制与免疫系统的应答反应也息息相关[2]。因此,研究具有选择性细胞毒性的药物对治疗骨肉瘤具有实际意义。白藜芦醇(Resveratrol,RES)是一种来自葡萄、桑葚、花生和其他植物的天然植物多酚化合物,作用十分广泛,其对抗炎、抗氧化等都有一定功效[3]。而白藜芦醇的抗癌特性更是引起了很大关注。有文献报道白藜芦醇对多种肿瘤细胞有抑制作用,如卵巢癌、皮肤癌[4-6]。对于骨肉瘤,也有研究组开展了白藜芦醇对骨肉瘤抑制作用的实验研究。但是对其是否能增强骨肉瘤细胞的免疫原性和体内的免疫应答并不是十分清楚。本研究进一步探讨了白藜芦醇对骨肉瘤K7M2细胞系的抗增殖作用,并对白藜芦醇增强骨肉瘤细胞的免疫原性进行了探讨。
1 材料与方法
1.1材料
1.1.1细胞株和实验动物 小鼠骨肉瘤细胞株K7M2购自上海中科院细胞库。BALB/c 小鼠(雌性,6~8 周龄,体重约16~18 g)购于三峡大学实验动物中心,动物质量合格证号:42010200001767。
1.1.2主要试剂和仪器 白藜芦醇(成都克洛玛生物科技有限公司);DMEM高糖培养基、胎牛血清(Gibco);细胞凋亡试剂盒(BD公司);MTT细胞增殖及细胞毒性检测试剂盒、细胞周期试剂盒(江苏凯基生物技术股份有限公司);TRIzol Reagent(Invitrogen);PCR逆转录试剂盒和PowerUpTM SYBR Green Master Mix(Thermo Scientific);蛋白提取试剂盒(索莱宝科技有限公司);BCA蛋白定量试剂盒(Thermo Scientific);β-actin兔抗鼠单克隆抗体、CyclinE1兔抗鼠单克隆抗体和XIAP兔抗鼠单克隆抗体(Ruiying Biological);Mcl-1兔抗鼠单克隆抗体、Bcl-2兔抗鼠单克隆抗体,Bax兔抗鼠单克隆抗体和Caspase-3兔抗鼠单克隆抗体(Cell signaling technology);Kras兔抗鼠单克隆抗体(Abcam);辣根过氧化物酶标记的山羊抗兔二抗(谷歌生物科技有限公司);H-2Kd-FITC (MHCⅠ),I-A/I-E-PE (MHCⅡ)(BD公司);CD45-APC荧光单克隆抗体(Biolegend);BD FACSVerse流式细胞仪(BD公司);Multiskan Spectrum全波长酶标仪(Thermo Scientific);StepOnePlus 实时荧光定量PCR仪(Applied Biosystems公司);GelX凝胶成像系统(上海欧翔科学仪器有限公司)。
1.2方法
1.2.1细胞培养 K7M2细胞用含 10% 胎牛血清、1×105U/L 青霉素和100 mg/L链霉素的高糖DMEM培养,置于37℃、5%CO2培养箱中。隔天换液,每隔2 d传代一次。
1.2.2MTT检测细胞增殖 将细胞接种在96孔平底板中(6 000 个/孔)。分不同浓度组(80、40、20、10、5 μmol/L)的RES处理细胞24 h、48 h和72 h,每组设置6个复孔,同时设置阴性对照组和空白对照组,阴性对照组用与药物相同体积的DMSO处理。相应时间点用含有10%MTT(5 mg/ml)溶液的150 μl新鲜培养基替换旧培养基。在37℃温育4 h后,除去MTT溶液,并用150 μl DMSO溶解细胞内甲瓒晶体。酶标仪在570 nm处的测定每孔吸光度(A)值。实验组和阴性对照组均减去空白对照组(A)值后,计算细胞抑制率,细胞抑制率=(阴性对照组-实验组)/阴性对照组×100%。
1.2.3细胞凋亡实验 K7M2细胞用20 μmol/L和40 μmol/L的RES孵育48 h。设置单染组和对照组,对照组用与药物相同体积的DMSO处理。用不含EDTA的消化酶消化后收集细胞并调整细胞浓度至1×106个/ml,PBS洗涤2次,用100 μl 的1×Binding buffer重悬,然后加入2.5 μl PE和5 μl 7-AAD染液在25℃避光环境下孵育15 min。然后上流式细胞仪检测不同处理组细胞凋亡变化。
1.2.4细胞周期实验 K7M2细胞用20 μmol/L和40 μmol/L的RES培养48 h,对照组加入与药物相同体积的DMSO。收集细胞PBS洗涤两次,用70%乙醇于4℃固定一夜,用PI和RNase A溶液染色,流式细胞术分析不同处理组细胞周期比例。
1.2.5实时定量多聚酶链聚合反应(RT-qPCR)检测细胞凋亡和细胞周期相关基因的表达量 K7M2细胞用20 μmol/L和40 μmol/L的RES培养48 h,对照组加入与药物相同体积的DMSO。用TRIzol从K7M2细胞中提取RNA,将RNA逆转录成cDNA。使用SYBR Green Master Mix在StepOnePlus Real-Time PCR System仪器上进行RT-qPCR反应。β-actin作为内参,用2-ΔΔCt法计算Xiap、Kras、Bcl-2、Mcl-1、CyclinE1、Bax和Caspase-3相对表达量。RT-qPCR反应条件:95℃ 45 s,56℃ 30 s,72℃ 3 min,40个循环。所有引物序列及相关信息见表1。
1.2.6蛋白质印迹法(Western blot)检测细胞凋亡和细胞周期相关蛋白的表达量 K7M2细胞用20 μmol/L 和40 μmol/L的RES培养48 h,对照组加入与药物相同体积的DMSO。用RIPA裂解液提取K7M2细胞蛋白,BCA法测定蛋白浓度。用SDS-PAGE凝胶电泳分离蛋白,湿转90 min至PVDF膜上,置于5%脱脂牛奶中室温封闭1 h,加入相应目的蛋白的一抗于4℃孵育过夜,TBST洗膜3次后二抗室温孵育1 h,ECL化学发光试剂显色。IPP6.0对显影出来的条带进行分析。
1.2.7流式细胞术检测分子
1.2.7.1体外K7M2细胞系MHC分子的检测 K7M2细胞用20 μmol/L和40 μmol/L的RES处理48 h。收集细胞并设置对照组和单标记组,对照组加入与药物相同体积的DMSO。用荧光单克隆抗体H-2Kd-FITC (MHCⅠ)、I-A/I-E-PE(MHCⅡ)以1∶100 稀释比例加入不同处理组,冰上避光孵育60 min,流式细胞仪检测各组MHCⅠ类和MHCⅡ类分子表达变化。
1.2.7.2荷骨肉瘤小鼠模型肿瘤细胞MHC分子的检测 6~8周龄,体重16~18 g雌性BALB/c小鼠按体重随机分为3组。高剂量治疗组为100 mg/kg,低剂量治疗组为50 mg/kg,对照组注射含药物相同体积DMSO的PBS溶液。首先构建荷骨肉瘤小鼠模型,体外培养的K7M2细胞制备成单细胞悬液,调整细胞浓度为5×105个/ml,取200 μl细胞悬液注射于小鼠右侧腋窝皮下。用游标卡尺测量体积,当瘤体体积≥0.3 cm×0.3 cm×0.3 cm,判断荷瘤成功。每日称量体重后,将药物用PBS溶液按分组剂量配制好后,每只取200 μl于瘤周皮下注射,注射用药16 d,颈椎脱臼处死小鼠,无菌取肿瘤组织剪碎、研磨挤压成单细胞悬液后,离心、弃掉上清。300 g 离心 5 min 后弃上清收集细胞,不同处理组分别加入1∶100 稀释的单克隆抗体组合(H-2Kd-FITC、I-A/I-E-PE和CD45-APC),4℃避光反应60 min,各管加入 3 ml PBS重悬,300 g离心5 min后弃上清,重复2次;上流式细胞仪分析不同组肿瘤细胞(CD45-)MHC分子表达变化。
表1 PCR引物
Tab.1 PCR primers

GenePrimer sequence(5′-3′)β-actin F:GTGGATCAGCAAGCAGGAGTR:GTGGATCAGCAAGCAGGAGTXiapF:TTGGAACATGGACATCCTCAR:TACCACTTCGCATGCTGTTCKrasF:AGAGCGCCTTGACGATACAGR:CCCTCCCCAGTTCTCATGTAMcl-1F:CAAAGATGGCGTAACAACTGGR:CGTTTCGTCCTTACAAGAACABcl-2F:GATGACTGAGTACCTGAACCGR:CAGAGACAGCCAGGAGAAATCCyclinE1F:GCGAGGATGAGAGCAGTTCR:AAGTCCTGTGCCAAGTAGAACBaxF:CCCGAGAGGTCTTTTTCCGAGR:CCAGCCCATGATGGTTCTGACaspase-3F:ACCATGGAGAACACTGAAR:TTAGTGATAAAAATAGAG

2 结果
2.1RES对骨肉瘤K7M2细胞增殖的影响 MTT法检测细胞增殖,结果如图1所示,RES处理细胞24 h后,40 μmol/L及80 μmol/L两个处理组的细胞增殖抑制率分别为38.24%及38.87%。处理细胞48 h后,20、40、80 μmol/L三个处理组的细胞抑制率均大于30%;处理细胞72 h后,5、10、20、40和80 μmol/L的RES均可显著抑制K7M2细胞增殖。相同浓度RES作用K7M2细胞,抑制率随着药物作用时间的延长而提高,这说明RES抑制骨肉瘤K7M2细胞增殖具有时间依赖性。
2.2RES对骨肉瘤K7M2细胞凋亡的影响 用流式细胞术检测细胞凋亡,结果如图2所示,与DMSO组相比较,RES(20 μmol/L和40 μmol/L)组的细胞凋亡率显著升高(P<0.01,P<0.001),存活细胞显著减少(P<0.05,P<0.001),表明RES能显著诱导骨肉瘤K7M2细胞凋亡。
2.3RES对骨肉瘤K7M2细胞周期的影响 流式细胞术检测细胞周期,发现与DMSO组相比较,RES(20 μmol/L和40 μmol/L)组S期的K7M2细胞均显著增多(P<0.05,图3)。表明RES能诱导骨肉瘤K7M2细胞周期阻滞在S期。

图1 RES显著抑制K7M2细胞增殖Fig.1 RES significantly inhibited K7M2 cell proliferationNote: Cell inhibition rate was determined by MTT assay.***.P<0.001.
2.4RES对细胞凋亡和细胞周期相关基因和蛋白表达量的影响 用后RT-qPCR检测基因表达,发现与DMSO组相比较,20 μmol/L RES处理组Xiap、Kras、Bcl-2和Mcl-1 mRNA表达水平显著降低(P<0.01、P<0.05、P<0.01、P<0.001,图4A),而Cy-clinE1、Bax和Caspase-3 mRNA表达水平均显著升高(P<0.05,图4B);40 μmol/L RES处理组Xiap、Kras、Bcl-2和Mcl-1 mRNA表达水平同样显著降低(P<0.001、P<0.05、P<0.05、P<0.001,图4A),而CyclinE1、Bax和Caspase-3 mRNA表达水平显著升高(P<0.01、P<0.05、P<0.05,图4B)。用Western blot检测蛋白,结果如图4C所示,与DMSO组相比较,RES(20 μmol/L和40 μmol/L)组Xiap、Kras、Bcl-2和Mcl-1的蛋白表达水平显著降低,而CyclinE1、Bax和Caspase-3 的蛋白水平表达显著升高,同mRNA水平改变趋势相一致。
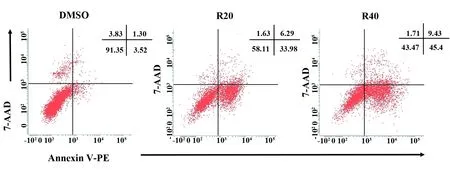

图2 RES显著诱导K7M2细胞凋亡
Fig.2 RES significantly induced apoptosis in K7M2 cells
Note: Cell apoptosis and viability were determined by flow cytometry.Compared with group DMSO,n=3,*.P<0.05.**.P<0.01.***.P<0.001.
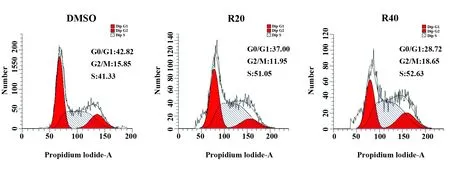

图3 RES显著诱导K7M2细胞周期阻滞于S期
Fig.3 RES significantly induced K7M2 cell cycle arrested at S phase
Note: Cell cycle was determined by flow cytometry.Compared with group DMSO,n=3,*.P<0.05.
2.5RES对体内外骨肉瘤MHC分子表达的影响 用流式细胞术检测MHC分子的表达,结果发现,与DMSO组相比较,RES(20 μmol/L和40 μmol/L)在体外处理K7M2细胞后,细胞的MHCⅠ类分子(图5A)及MHCⅡ类分子(图5B)的表达量均显著增加(P<0.05、P<0.01;P<0.05、P<0.01)。在体内实验中,与对照组小鼠相比,RES(50 mg/kg和100 mg/kg)处理的荷骨肉瘤小鼠的肿瘤细胞MHCⅠ类分子表达量显著增高(P<0.01、P<0.001,图5C),同时,MHCⅡ类分子表达量也显著增高(P<0.01、P<0.001,图5D)。表明RES能显著增强体内外骨肉瘤K7M2细胞的免疫原性。
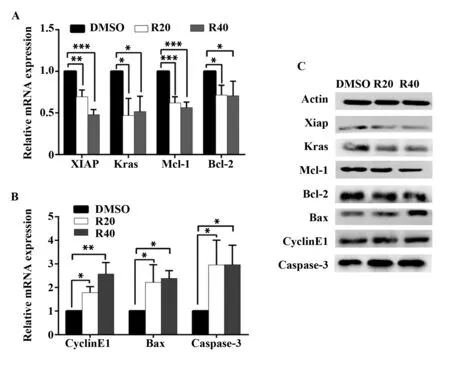
图4 RES对K7M2细胞凋亡和细胞周期相关的基因和蛋白表达量的影响Fig.4 Effect of RES on expression of mRNA and protein in K7M2 cellsNote: A,B.The expression of mRNA was determined by RT-qPCR.Compared with group DMSO.n=3,*.P<0.05,**.P<0.01,***.P<0.001.C.The expression of protein was determined by Western blot.
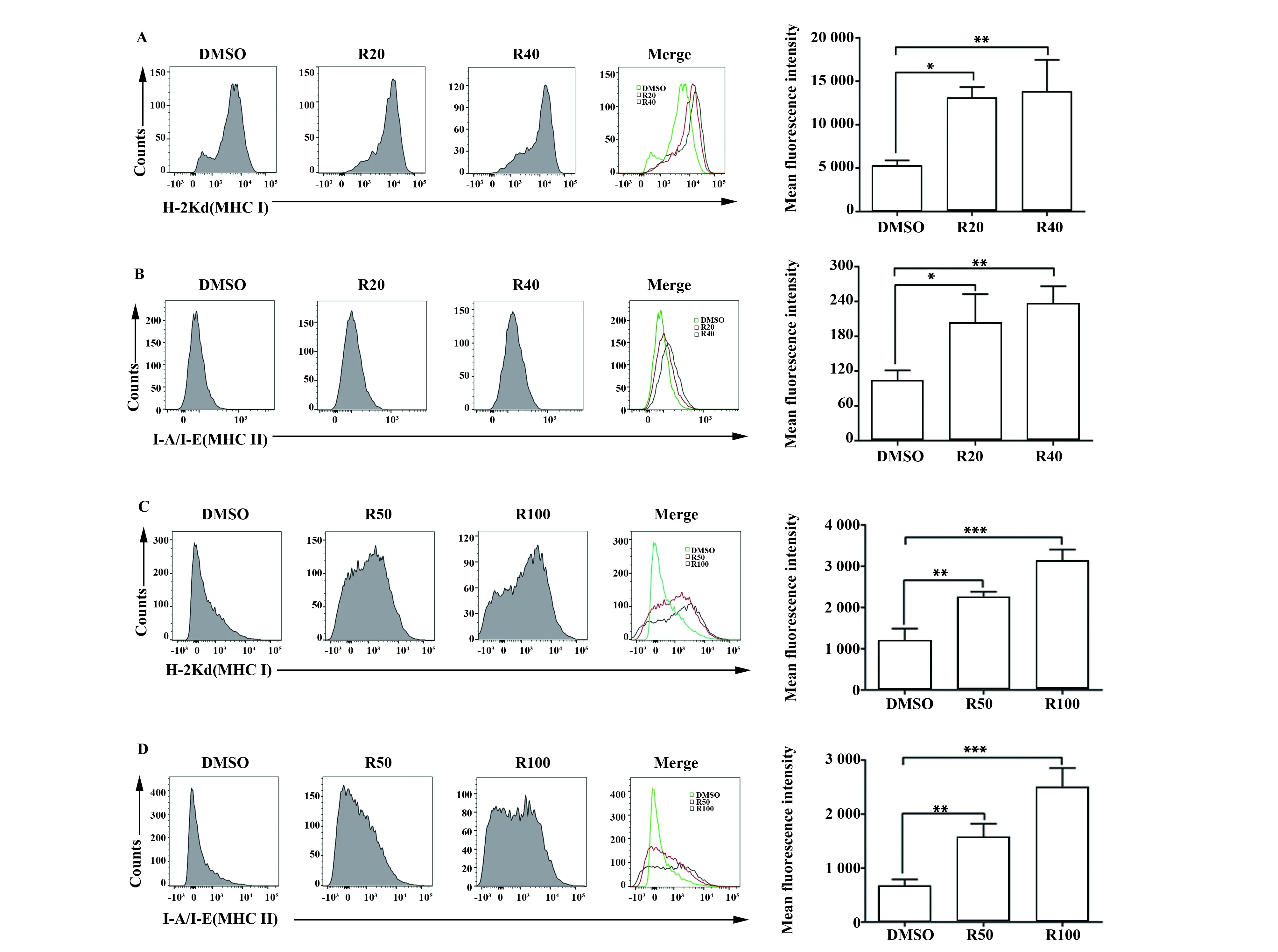
图5 RES显著增强体内外K7M2细胞MHC分子表达Fig.5 RES significantly enhanced MHC molecule expression of K7M2 cellsNote: The expression of MHC was determined by flow cytometry.Compared with group DMSO.n=3,*.P<0.05,**.P<0.01,***.P<0.001.
3 讨论
肿瘤的发生发展受一系列复杂机制的影响,其中包括原癌基因和肿瘤抑制基因的突变以及凋亡过程的改变,凋亡的累积同样会影响细胞周期的稳态。同时也与癌细胞的识别或肿瘤生长同抗肿瘤免疫应答之间的平衡有关[7]。那么对于宿主而言,抗肿瘤免疫就起着十分重要的作用。此前大量研究表明,化疗药物对肿瘤细胞的作用机制主要是通过诱导细胞同期停滞和细胞凋亡[8,9],而关于白藜芦醇影响骨肉瘤免疫应答的研究较少。本研究采用骨肉瘤K7M2细胞,首先体外检测RES对K7M2细胞毒性作用,对细胞凋亡和细胞周期的影响。发现用20 μmol/L和40 μmol/L RES处理K7M2细胞48 h后能够有效诱导细胞凋亡,并使细胞周期阻滞在S期。与此同时,与细胞凋亡和细胞周期相关基因和蛋白的表达水平也发生了改变。Bcl-2、Bax和Mcl-1同属于B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)家族,Bcl-2和Mcl-1发挥着抗凋亡作用,而Bax属于促凋亡基因,共同发挥调节作用[10]。X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是凋亡蛋白抑制剂(Inhibitor of apoptosis protein,IAP)家族中的一员,可直接抑制Caspase-3,并传递不依赖Caspase的信号。这样,作为下游终末剪切酶效应的Caspase-3就不能发挥其促进凋亡发生的作用[11,12]。K-ras编码一种调节增殖、分化和细胞存活的膜相关GTP酶信号蛋白,在肿瘤发生和发展中起重要作用,会导致预后不良[13]。CyclinE1作为细胞周期从G1期向S进展的重要调节因子,在大多数人类癌症中表达,并与肿瘤发生相关[14]。本文发现20 μmol/L和40 μmol/L RES处理K7M2细胞48 h后,Mcl-1、Xiap、K-ras和Bcl-2 mRNA和蛋白水平明显降低,而Bax和Caspase-3明显增高,这些基因和蛋白的表达变化都能促使肿瘤细胞凋亡的发生。有趣的是,CyclinE1 mRNA和蛋白表达水平也显著增加,这种变化可能也与在多细胞生物中,周期分裂是与外部环境和内部细胞状态相结合,细胞分裂过程中变化的类型也不尽相同有关[15]。还可能与其他周期蛋白(如细胞周期中CyclinD1和CyclinE1)表达的高低、相互调控以及肿瘤类型相关联[16]。还有可能是某些恶性肿瘤本身的发展过程中CyclinE1的扩增很少,药物治疗后会发生其他变化。当然,彻底阐明其机制需要开展更多的相关研究工作。但事实上,在本研究中CyclinE1的升高导致了G0/G1期细胞减少,细胞周期阻滞在S期,但G2/M期并无显著改变。
许多研究已经发现,在60%~90%的不同组织学起源的人类癌症如头颈部、皮肤、乳腺和肺中MHC Ⅰ 类分子表达下调或完全丧失[17,18]。具有下调MHC表达的癌症有更大的转移潜能,对患者预后不良[19,20]。本研究发现,在20 μmol/L和40 μmol/L RES处理K7M2细胞48 h后,体外培养的K7M2细胞系中MHC Ⅰ 类、MHC Ⅱ 类分子的表达量显著增加。同样的结果在体内动物研究也得到了验证。通过构建荷骨肉瘤小鼠模型,50 mg/kg和100 mg/kg 的RES在肿瘤局部注射16 d后,发现荷骨肉瘤小鼠肿瘤细胞中MHC Ⅰ 和MHC Ⅱ 类分子的表达都显著增高,有显著的统计学差异。肿瘤逃避免疫识别的一个重要机制即是降低递呈肿瘤抗原给细胞毒性T细胞的MHC Ⅰ 类分子的表达[21,22],MHC Ⅰ 类表达增加,表明RES可减弱MHC Ⅰ 类分子低表达而产生的免疫逃逸。MHC Ⅱ类分子在肿瘤细胞中一般并不表达,而在RES处理后,MHC Ⅱ 类分子表达增多则被认为是抗原提呈能力增强的表现,可能会增强免疫反应[23]。我们推测,同MHC分子的改变一样,体内会有众多免疫细胞的改变来对抗骨肉瘤。综上所述,RES具有抑制骨肉瘤细胞增殖的作用,另外其也具有提高抗肿瘤免疫的潜力。本研究在动物模型治疗过程中也初步观察到50 mg/kg和100 mg/kg的RES对小鼠骨肉瘤体积有抑制效应,未来将在进一步的研究中明确其治疗效果。此外,在进一步的研究中,还将检测肿瘤组织中募集的免疫细胞变化,探讨RES对骨肉瘤小鼠肿瘤的抑制作用及对抗肿瘤免疫是否有增强作用,并讨论其可能的机制。

