228例甲状腺微小乳头状癌临床特征及颈部淋巴结转移危险因素分析
马小开,黄建康,朱 博,彭德峰,周 锐,王圣应
1.蚌埠医学院第一附属医院甲乳外科一病区,安徽 蚌埠 233000;2.中国科学技术大学附属第一医院西区,安徽省肿瘤医院头颈肿瘤外科,乳腺诊治中心,安徽 合肥 230000
近年来,甲状腺癌的发病率上升速度快,成为内分泌外科领域颇受关注的疾病之一。甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)是指最大直径≤1.0 cm的甲状腺乳头状癌(papillary thyroid carcinoma,PTC),有研究报道[1]PTMC占新发PTC近50%,虽然PTMC的发病率不断增加,但其相关的致死率没有相应增加,因此国内外专家纷纷提出甲状腺癌存在“过度诊断”及“过度治疗”的问题[2-4],也给广大甲状腺外科工作者提出挑战。本文回顾性分析了228例PTMC患者资料,总结PTMC的临床病理学特征及相关危险因素,以期为临床诊治PTMC制定更加精准合理的方案,减少“过度诊断”及“过度治疗”问题。
1 资料和方法
1.1 病历资料
收集蚌埠医学院第一附属医院2015年1月—2017年12月间行手术治疗的PTMC患者的临床病理学资料,共228例,其中男性45例(19.7%),女性183例(80.3%),男女比例约1∶4,就诊时年龄21~76岁,中位年龄45岁,其中年龄<45岁患者110例,≥45岁患者118例。
1.2 方法
纳入标准:①初次手术;② 不合并其他非甲状腺恶性肿瘤;③病理学类型为PTMC;④ 行预防性中央区淋巴结清扫和(或)颈侧区淋巴结清扫,且具有完整的临床及病理学资料。
排除标准:①非首次甲状腺手术;② 合并其他器官恶性肿瘤或远处转移;③病理学类型为非PTC;④ 临床病理学资料不完整。
观察指标包括:患者性别、年龄、肿瘤大小、病灶的数目、淋巴结转移情况、手术方式、合并其他甲状腺疾病情况、甲状腺功能、超声报告、生化指标。颈部淋巴结评估方法:彩色多普勒超声。
手术方式参考中国抗癌协会甲状腺癌专业委员会制定的《甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)》[5],原发灶的处理:①单侧腺叶+峡部切除86例;② 甲状腺全切67例;③患侧腺叶+峡部+对侧近全切除75例。淋巴结处理:①临床颈部淋巴结阴性(cN0期)患者均行预防性中央区淋巴结清扫;② 临床同侧颈侧区淋巴结阳性(cN1b期)患者行中央区+颈侧区淋巴结清扫28例。关于多灶性微小乳头状癌,按照病灶中最大直径者作为肿瘤大小进行统计学分析。
1.3 统计学处理
本组研究采用SPSS 20.0软件进行统计学分析,率的比较采用χ2检验,危险因素采用二分类logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 PTMC患者发病率
分析2015—2017年在蚌埠医学院第一附属医院就诊并诊断为PTC患者的临床资料。2015年诊断PTC患者287例,其中PTMC患者83例,占28.9%;2016年诊断PTC患者302例,其中PTMC患者94例,占31.1%;2017年诊断PTC患者483例,其中PTMC患者189例,占39.1%。3年期间,蚌埠医学院第一附属医院收治的PTMC患者呈逐年上升趋势(P<0.01,表1)。
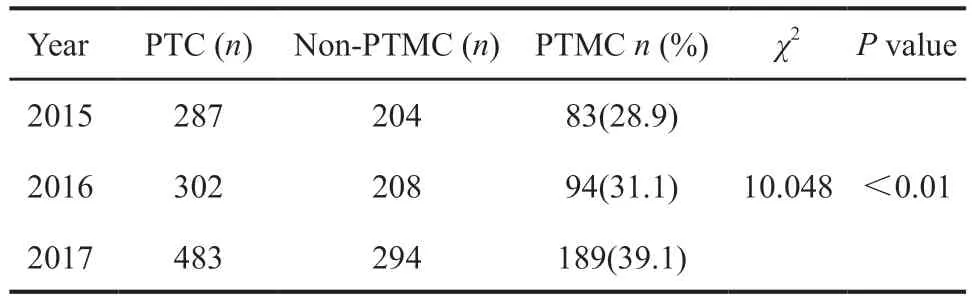
表1 PTMC发病情况分析Tab.1 Analysis of the incidence of PTMC
2.2 超声诊断结果
与术后病理学诊断比较,超声诊断PTMC的灵敏度为91.23%(208/228),其中低回声结节、结节内或周边血流信号丰富及结节内点状强回声为PTMC的特点;在评估颈部淋巴结受累状态方面灵敏度为40.37%(44/109),特异度为93.28%(111/119),其中颈部淋巴结横/长径>1/2,皮髓质分界不清或髓质结构消失,与原发灶相似的微小钙化或囊性变是颈部淋巴结转移的特点。
2.3 实验室检查结果
甲状腺功能:T3增高者2例,降低者1例;T4增高者2例,降低者1例;促甲状腺激素(thyroidstimulating hormone,TSH)增高者9例,降低者13例;抗甲状腺球蛋白抗体(anti-thyroglobulin antibody,TGAB)增高者33例;甲状腺微粒体抗体(thyroid microsomal antibody,TMAB)增高者35例。
生化指标:总胆固醇增高者40例,甘油三酯增高者62例,高密度脂蛋白增高者10例,降低75例,低密度脂蛋白增高39例,降低1例。
2.4 原发病灶情况
本组228例患者均为PTC,其中肿瘤最大径≤5 mm者57例,最大径>5 mm者171例;单发病灶180例,多发病灶48例(其中2个病灶35例,3个病灶5例,4个以上病灶8例);肿瘤位于左侧92例,位于右侧97例,双侧39例;合并淋巴细胞性甲状腺炎患者24例,合并结节性甲状腺肿患者10例,合并甲状腺腺瘤6例,合并对侧PTC患者35例(不含双侧PTMC)。
2.5 颈部淋巴结转移情况
228例患者中,109例发生中央区淋巴结和(或)颈侧区淋巴结转移(47.81%),中央区淋巴结转移比例为47.4%(108/228);侧颈部淋巴结转移比例为9.2%(21/228),其中1例患者侧颈部淋巴结转移但无中央区淋巴结转移,其余20例患者均为中央区淋巴结转移同时伴有侧颈部淋巴结转移;淋巴结清扫数目为1~49枚,共1 476枚淋巴结,平均6.5枚;转移淋巴结数目1~18枚不等,共397枚淋巴结,转移淋巴结占所有清扫淋巴结的26.90%。
2.6 颈部淋巴结转移危险因素分析
发生颈部淋巴结转移患者共109例,其中男性29例,女性80例;就诊时年龄<45岁患者66例,≥45岁患者43例;肿瘤最大径≤4 mm者10例,最大径>4 mm者99例;单发病灶者73例,多发病灶者36例;肿瘤位于左侧者41例,右侧者50例,双侧者18例;单因素分析结果显示,患者性别、年龄、肿瘤最大径及原发灶数目与中央区淋巴结转移相关(P<0.05),合并对侧甲状腺癌(不含双侧PTMC)及慢性淋巴细胞性甲状腺炎患者差异无统计学意义(P>0.05,表2),二元logistic多因素分析结果提示男性患者、年龄<45岁、肿瘤最大径>4 mm及多中心病灶是PTMC颈部淋巴结转移的独立危险因素(P<0.05,表3)。

表2 PTMC患者颈部淋巴结转移危险因素相关性分析Tab.2 Risk factors for cervical lymph node metastasis in PTMC
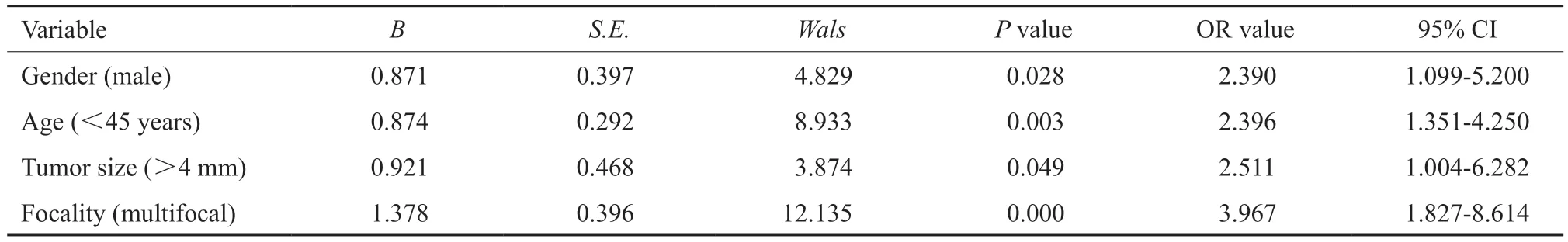
表3 PTMC患者颈部淋巴结转移危险因素多因素分析Tab.3 Multivariate analysis of risk factors for cervical lymph node metastasis in PTMC
2.7 美国癌症联合会甲状腺癌分期系统(第8版)更新的影响结果
更新前:Ⅰ期患者185例,Ⅲ期患者43例;更新后:Ⅰ期患者210例,Ⅱ期患者18例。
2.8 疾病转归情况
本组患者中出现3例暂时性喉返神经麻痹症状(1.3%),5例暂时性甲状旁腺功能减退症状(2.2%),以上情况均见于甲状腺全切患者,并于术后2~6周恢复正常。患者随访从术后4周开始,随访时间21~44个月,有2例患者失访,随访过程中有1例患者出现颈侧区淋巴结肿大,经穿刺未见肿瘤细胞,继续随访,本组患者无死亡病例。
3 讨 论
中国甲状腺癌发病率及死亡率呈逐年上升趋势,据统计[6]2013年中国甲状腺癌新发病例33 939例,死亡4 974例,分别较1990年增加21 898例及1 810例,而美国2018年预计新发甲状腺癌患者53 990例,死亡患者约2 060例[7]。超声是目前筛查甲状腺疾病最常用的手段,特别是高分辨的彩超的应用对诊断PTMC及评估颈部淋巴结状态具有重要价值[8-9]。本研究提示彩超在评估颈部淋巴结转移情况方面灵敏度较低,由于超声检查存在人为因素影响,在有条件的医院应当组建甲状腺专业超声医师团队,以减少甲状腺癌的漏诊率及误诊率,特别是颈部淋巴结状态的评估。
如何评估PTMC危险因素对指导临床治疗方案的制定具有重要的参考价值。首先,年龄与PTMC的进展密切相关[10-11],既往的研究表明年龄<45岁[12-13]患者颈部淋巴结转移风险增加;此外年龄对甲状腺癌的临床病理学分期影响较大,美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版TNM分期更新点之一就是将分化型甲状腺癌的预后诊断年龄切点值由45岁提高到55岁,这对45~55岁之间患者的分期及临床治疗策略产生影响[14],本组患者中经分析年龄在45~55岁(含45岁,不含55岁)组共有74例,其中有18例患者由Ⅲ期降为Ⅱ期,25例患者由Ⅲ期降为Ⅰ期,因而这部分患者的后续随访管理策略也将发生改变。其次,肿瘤最大直径>5 mm或≥7 mm是中央区淋巴结转移危险因素之一[13,15-16],而≤5 mm的PTMC是否纳入低危人群?中国抗癌协会甲状腺癌转移委员会的专家共识中提到:对于腺内型PTMC(尤其直径≤5 mm)是否采用密切观察方式存在较多争议[5],陈诚等[17]的研究发现最大径≤5 mm的PTMC中央区淋巴结转移率达34.9%(170/487),本组研究数据显示最大径≤5 mm患者中央区淋巴结转移率38.6%(22/57),最大径≤4 mm患者中央区淋巴结转移率31.3%(10/32),而多因素分析最大径≤4 mm是颈部淋巴结转移的独立危险因素,因此对于最大径≤4 mm患者淋巴结的处理也要慎重对待。再次,肿瘤的多灶性与颈部淋巴结转移具有相关性,也是PTMC手术治疗的相对适应证[5],相关的研究也证实病灶数≥3更容易出现颈部淋巴结转移[15,18-19],本研究数据显示多中心病灶(≥2)是颈部淋巴结转移的独立危险因素。第四,甲状腺被膜或腺体外侵犯情况与复发风险的关系,有研究证实甲状腺被膜侵犯是其复发的危险因素[15,20],而AJCC第8版的TNM分期将甲状腺外微小侵犯从T3中删除,也说明了微小腺外侵犯的危险因素程度降低[21],胡厚洋等[22]的研究也证实甲状腺被膜及被膜外的微小侵犯并不影响分化型甲状腺癌的颈部复发,本组数据中由于被膜外微小侵犯病例较少,尚不能说明问题。
针对PTMC的外科治疗,国内外专家仍存在争议,主要涉及到手术的必要性及手术的范围问题。对于手术的必要性,国外的学者提出了积极监控的方式,同时相关的临床试验也证实积极监控对于部分PTMC患者是一个很好的选择[23],即使出现肿瘤的增大或淋巴结的转移,也并未出现肿瘤原因相关的死亡[10,24],然而我们应该更多地从患者的角度去决策是否应积极监控,以减少他们的身心痛苦。手术的范围主要包含原发灶和区域淋巴结的处理,在一项外科医师手术方式的问卷调查[25]中,对于单发的PTMC患者70.3%外科医师推荐单侧甲状腺腺叶切除,而对于伴有淋巴结转移或多灶性的PTMC患者,分别有89.5%及85.4%的外科医师选择全甲状腺切除术。目前中国抗癌协会甲状腺癌转移委员会专家共识[5]推荐根据病灶临床特征及危险评估合理选择甲状腺腺叶+峡部切除或全/近全切除(A级证据),cN0期患者在有技术保障的前提下可行预防性中央区淋巴结清扫(B级证据)。此外,还应该重视PTMC患者术后的长期随访。
本研究结果提示,对于男性患者、年龄<45岁、肿瘤最大径>4 mm及多中心病灶患者,应积极实施外科手术干预,进行预防性中央区淋巴结清扫。在临床诊治过程中,严格参照《甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)》,同时结合实际情况,严把质控关,合理并有选择性地开展PTMC的积极监控、外科治疗及术后随访工作,注重PTMC患者的全程规范化管理,同时呼吁有条件的单位开展国内多中心的临床随访研究,以期为PTMC患者的精准治疗提供更多循证医学的依据。

