梭梭14-3-3蛋白基因HaFT-9的克隆及特性分析
刘栓栓,王 波,宗兴风,王 娇,王新奇,姚正培,任燕萍,张 桦,2
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业大学干旱区荒漠研究所,乌鲁木齐 830052)
0 引 言
【研究意义】14-3-3蛋白是高度保守的调节蛋白,参与激素信号转导等代谢调节过程[1],在植物响应干旱、高盐、高温等非生物胁迫以及生物胁迫[2]中发挥重要作用。梭梭(Haloxylon ammodendron)为藜科梭梭属多年生灌木或小乔木,主要分布于我国西北荒漠和半荒漠地区,具有较强的抗旱、抗寒、耐盐碱、耐高温、耐瘠薄等能力[3],是荒漠地区主要的建群种,在荒漠地区防风固沙、保护生态环境、改善小气候等多方面具有重要作用[4]。研究梭梭14-3-3蛋白功能,不仅有助于从调节蛋白这个侧面理解梭梭抗逆适应性的分子机制,为作物抗逆基因工程提供新的基因来源,同时对选育和筛选抗逆梭梭植株,加快生态治理进程具有重要意义。【前人研究进展】14-3-3蛋白最早在牛脑组织中被发现,根据其在DEAE层析后所分离组分的片段数及在淀粉凝胶电泳中的迁移率而得名[5, 6],该蛋白在植物体内主要以同源或异源二聚体的形式形成特殊的槽状结构,进而结合相应的磷酸化靶蛋白[7],序列由较高变异性的N端和C端,以及保守的核心区域组成,其中N端是决定它能否形成二聚体的关键区域[8,9]。它能够以序列特异性和磷酸化依赖的方式与众多的靶蛋白结合并通过改变靶蛋白的活性、稳定性、构象、亚细胞定位或者与其他蛋白的亲和力来调控靶标的信号转导[9],参与代谢调控、细胞周期调控、转录、应激反应等一系列生物过程[10]。研究表明,过表达小麦与拟南芥14-3-3基因,可以提高植株对干旱和盐胁迫的耐受能力,减弱植株的萎蔫程度[11, 12]。植株可在逆境条件下,利用14-3-3蛋白降低质膜H+-ATPase复合物的活性,从而降低质子泵活性,并关闭气孔进而来提高植物的抗旱性[13],同时拟南芥还可通过两种不同结构的14-3-3蛋白与SOS2的相互作用抑制SOS2的活性,进而抑制正常生长条件下植物的SOS通路,而钠离子可以通过降低14-3-3蛋白与SOS2的相互作用来激活SOS通路,提高植株耐盐能力[14]。14-3-3蛋白还可参与激素信号通路的调控,该蛋白通过与OsBZR 1相互作用改变OsBZR 1的催化活性,从而导致BR敏感性降低、BR应答基因表达改变[15]。水稻14-3-3蛋白基因OsGF14e被钙依赖蛋白激酶OsCPK 21磷酸化后促进水稻幼苗对ABA和盐胁迫的响应[16]。前期对梭梭进行干旱和高温的转录组测序,在差异表达的unigene中通过序列比对筛选了9个14-3-3蛋白基因,命名为HaFT-1~9,已克隆了与干旱和盐胁迫相关的HaFT-1、HaFT-2[17],HaFT-5和HaFT-6[18]基因。【本研究切入点】目前对梭梭抗逆性的研究主要集中在生理[19]和抗旱[20]机制方面,对梭梭耐高温的研究少有报道。研究前期对梭梭幼苗模拟地表高温胁迫后进行转录组测序,转录组数据分析表明,14-3-3蛋白基因HaFT-9在高温胁迫后表达上调,推测该基因可能与梭梭响应高温胁迫有关,因此,以研究梭梭14-3-3蛋白基因功能为切入点,探讨其表达特性和结合活性,进而理解其调控功能,有助于解析梭梭耐高温的分子机制。【拟解决的关键问题】研究梭梭14-3-3蛋白基因HaFT-9在非生物胁迫和激素处理后的表达模式,特别是对高温胁迫适应的响应模式,分析HaFT-9蛋白的结合特性。
1 材料与方法
1.1 材 料
梭梭种子采集于新疆吉木萨尔育苗场,自然环境干燥后在-20℃冰箱保存备用。
1.2 方 法
1.2.1 梭梭幼苗处理
1.2.1.1 干旱胁迫、盐胁迫以及激素处理试验
在超净工作台内,梭梭种子经75%乙醇消毒30 s,无菌水冲洗3次,再用1%次氯酸钠消毒15 min,无菌水冲洗6次后,将种子点播于1/2 MS固体培养基上。种子置于26℃恒温箱中培养30 d,光照强度为900~1 260 μmol/(m2·s),昼夜光照周期16 h/8 h。将生长30 d的梭梭幼苗转移至具有20% PEG6000、200 mmol/L NaCl、100 μmol/L ABA和20 μmol/L IAA的溶液中(ddH2O配置),在胁迫不同时间段(0 h、1 h、3 h、6 h、12 h、24 h)对幼苗同化枝取样,样品迅速置于液氮速冻,-80℃冰箱保存备用。
1.2.1.2 模拟地表高温胁迫试验
俞阗[21]通过模拟地表高温胁迫发现地表高温是引起梭梭幼苗死亡的主要原因之一,同时发现两年生幼苗对高温的耐受性明显强于一年生幼苗。试验利用电热线恒温加热梭梭苗与地表接触位置,对一年生和两年生梭梭幼苗进行模拟地表高温胁迫。1年生梭梭幼苗经40和55℃连续处理24 h后,停止高温胁迫并置于30℃复原,同时对梭梭同化枝在不同时间点(0 h、2 h、12 h、24 h、3 d、6 d、15 d)取样;2年生梭梭幼苗经55和65℃连续处理48 h后,停止高温胁迫置于30℃复原,同时对梭梭同化枝在不同时间点(0 h、2 h、24 h、48 h、7 d、10 d、19 d)取样。
1.2.1.3 高温胁迫适应性试验
将26℃恒温下生长30 d的梭梭幼苗,进行以下两种生长胁迫模式处理。试验组胁迫模式为:正常生长条件下的幼苗置于26℃ 3 d(常温对照,CK)→37℃ 1 h(高温预处理,S1)→26℃ 3 d(第1次常温复原,R1)→45℃ 1 h(高温胁迫处理,S2)→26℃ 7 d(第2次常温复原,R2);对照组胁迫模式为:将正常生长条件下(CK’)的幼苗置于45℃ 1 h处理(S2’)后,直接进行26℃ 7 d复原(第1次常温复原,R2’),在8个时间点 (CK、S1、 R1、S2、R2、CK’、S2’、 R2’)对梭梭幼苗同化枝取样,即试验组比对照组多一项37℃预胁迫处理,以期分析高温预处理后基因表达变化。
1.2.2HaFT-9基因的克隆
利用全式金Trizol提取45℃高温胁迫1 h梭梭幼苗的RNA,使用反转录试剂盒TaKaRa FirstSrtand cDNA Synthesis kit进行cDNA第一链的合成。
从梭梭高温转录组测序拼接得到标注为14-3-3蛋白基因的Unigene序列,将该基因命名为HaFT-9,利用NCBI与DNAMAN 分析得到HaFT-9 ORF全长序列,采用Primer 5.0设计HaFT-9的克隆引物(表1),以cDNA为模板,进行PCR扩增。反应体系为:10×Buffer (含Mg2+) 5 μL、2.5 mmol/L dNTPs 2.0 μL、上下游引物各1.0 μL、cDNA 模板1.0 μL、Taq酶0.5 μL、其余用ddH20补足至50 μL。反应程序:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 45 s,35个循环;72℃ 10 min;PCR产物切胶回收后连接pEASY-T1 载体,转化至Trans1-T1大肠杆菌感受态中。
胶回收方法参考Midi Purification Kit(天根生化科技有限公司)试剂说明书, pEASY-T1 载体连接与大肠杆菌转化参考(北京全式金生物技术有限公司)说明书。表1
表1 PCR引物序列
Table 1 Primer sequences of PCR
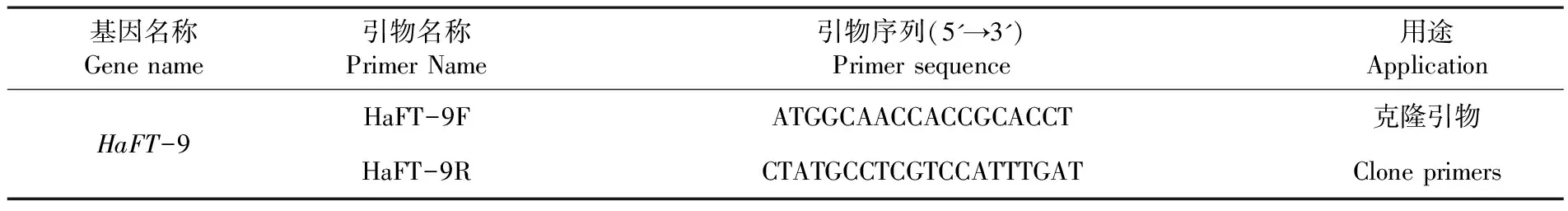
基因名称Gene name引物名称Primer Name引物序列(5'→3')Primer sequence用途ApplicationHaFT-9HaFT-9FATGGCAACCACCGCACCT克隆引物HaFT-9RCTATGCCTCGTCCATTTGATClone primers
1.2.3 目的基因的生物信息学分析
利用NCBI在线数据库对HaFT-9基因编码的氨基酸序列进行搜索以及比对,并使用非在线软件(clustalx和genedoc)对相似序列进行多序列比对。利用软件ProtParam(http://web.expasy.org/protparam/)预测蛋白质的理化性质,利用软件PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白质的二级结构,利用软件SWISS-MODEL(https://swissmodel.expasy.org/interactive/Lmyegg/models/)预测蛋白质的三级结构,利用软件BaCelLo(http://gpcr2.biocomp.unibo.it/bacello/pred.htm)预测蛋白的亚细胞定位,利用软件MEGA5.0构建系统进化树。表2
表2 荧光定量引物序列
Table 2 Realtime fluorescence quantitative primer

基因名称Gene name引物名称Primer Name引物序列(5'→3')Primer sequence用途ApplicationHaFT-9HaFT-9qFTACTTTGGGTGAAGAGTCCTACA荧光定量引物HaFT-9qRTTTGATCCTGCATGTCTGATGTRealtime fluorescence quantitative primerHa18sRNA18sRNAFCTCTGCCCGTTGCTCTGATGAT内参基因引物18sRNARCCTTGGATGTGGTAGCCGTTTCReference gene primerHaACT7ACT7FTTGAACCCCAAGGCTAACAGAG内参基因引物ACT7RACGACCAGCAAGATCCAAACGGReference gene primerHaEF-1AEF-1AFCGTGAAGGCGACTCGTTAATTG 内参基因引物EF-1ARGCTTGGAGACGCTTGACAGGACReference gene primer
1.2.4 实时荧光定量PCR分析
将1.2.1中各处理材料提取总RNA后,使用反转录试剂盒TaKaRa FirstSrtand cDNA Synthesis kit进行cDNA第一链的合成。利用软件Primer 5.0设计HaFT-9的实时荧光定量PCR引物,模拟干旱胁迫、高温胁迫和IAA处理的内参基因为Ha18srRNA,高盐胁迫的内参基因为HaAct7、ABA处理下的内参基因为HaEF-1A[22],按照SYBR®Premix ExTaqTMII(TaKaRa)进行实时荧光定量PCR,反应体系:SYBR®Premix ExTaqTMII 10 μL,上下游引物各0.8 μL,Rox DyeⅡ 0.4 μL,cDNA 2 μL,其余用ddH2O补足至20 μL。反应程序:95℃ 预变性30 s;95℃ 变性3 s,60℃退火35 s,循环40次。待溶解曲线生成后,采用2-△△CT法,计算HaFT-9基因在不同处理及对照样品中的表达量。
1.2.5 酵母双杂交载体构建及互作验证1.2.5.1 入门克隆载体构建
采用Gateway®系统构建酵母双杂载体,根据HaFT-9的ORF序列设计入门克隆引物(表3划线部分为attB位点),以前期测序正确的pEASY-T1- HaFT-9质粒为模板进行PCR扩增,切胶回收,利用BP酶将回收产物与pDONR221载体连接,转化Trans-T1感受态细胞,菌落PCR验证正确的阳性克隆送测序。BP反应方法见Gateway©Technology(Invitrogen)说明书。表3
表3 入门克隆引物
Table 3 Entry cloning primers
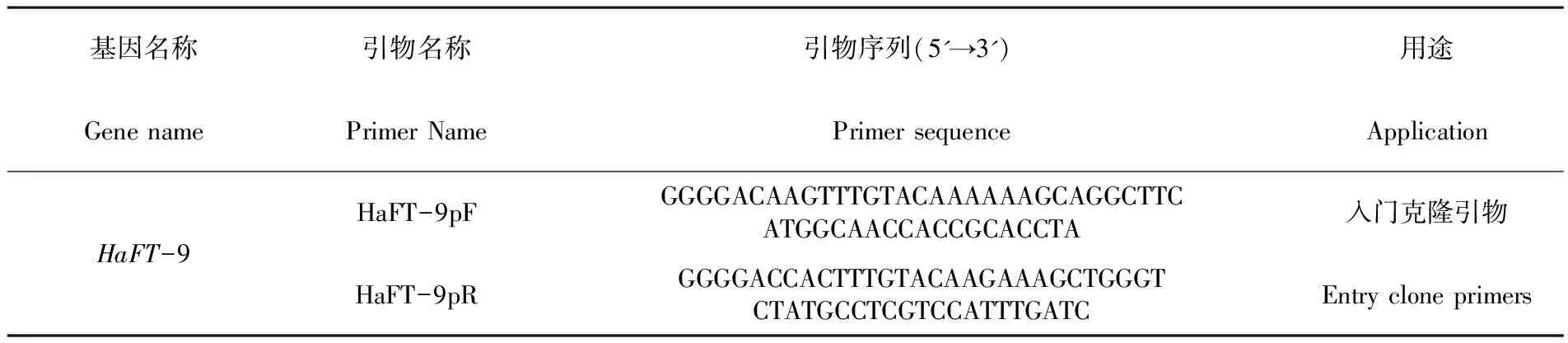
基因名称引物名称引物序列(5'→3') 用途Gene namePrimer NamePrimer sequenceApplicationHaFT-9HaFT-9pFGGGGACAAGTTTGTACAAAAAAGCAGGCTTCATGGCAACCACCGCACCTA入门克隆引物HaFT-9pRGGGGACCACTTTGTACAAGAAAGCTGGGTCTATGCCTCGTCCATTTGATCEntry clone primers
1.2.5.2 AD与BD重组载体构建及互作验证
pDESTTM32含有GAL 4 DNA结合区为BD载体,pDESTTM22含有GAL 4激活区为AD载体。利用LR酶将目的片段从pDONR221- HaFT-9入门克隆载体重组至BD载体与AD载体,验证正确的阳性克隆送测序。LR反应方法见ProQuestTMTwo-Hybrid System(Invitrogen)说明书。
将-80℃冰箱保存的酵母菌株MaV203在YPDA固体培养基上划线培养进行菌体活化,30℃培养2~3 d,挑取单菌落至2 mL YPDA液体培养基,30℃,200 r/min培养24 h。以1∶100的比例加入至30 mL YPDA液体培养基中,30℃,200 r/min培养至OD600为0.8~1.0,用于酵母转化。BD载体和BD-HaFT-9载体分别转化酵母菌株Mav203,涂布于SD-Leu培养基与SD-His培养基,进行转录自激活验证。将AD、BD以及构建好的BD-HaFT-9、AD-HaFT-9转化至酵母MaV203,转化产物涂板于二缺板(SD-Leu-Trp) 30℃培养2~3 d。将长出的单克隆用蒸馏水稀释至同一浓度,转移至三缺板(SD-Leu-Trp-His)培养2~3 d,将三缺板生长的菌落进行X-gal染色,观察结果。
转化方法参考Frozen-EZ Yeast Transformation IITM试剂盒

注:M:2K Marker; 1:HaFT-9 PCR 扩增产物
Note: M:2K Marker;1:HaFT-9 PCR amplification products
图1 梭梭14-3-3蛋白基因的扩增产物
Fig.1 The amplification result ofHaloxylonammodendron14-3-3 protein gene
2 结果与分析
2.1 14-3-3蛋白基因HaFT-9的克隆
梭梭干旱转录组拼接得到标注为14-3-3蛋白基因的Unigene序列,根据梭梭的拉丁名中的首字母和14-3-3蛋白名字中的fourteen与three将该基因命名为HaFT-9。以梭梭cDNA为模板进行PCR 扩增,得到与预期片段大小相符的目的条带,将该条带切胶回收,与pEASY-T1连接后转化大肠杆菌感受态,挑取阳性克隆送新疆昆泰锐进行测序。测序结果显示该基因片段大小为789 bp, NCBI登录号为API85525。图1
2.2 目的基因的生物信息学
2.2.1 保守结构域预测及序列比对
NCBI BLAST 结果显示,HaFT-9基因的ORF为789 bp,编码262个氨基酸。多重序列比对结果如图3所示,HaFT-9蛋白序列与所有参与比对的14-3-3 的氨基酸序列和结构都高度保守,与菠菜14-3-3蛋白家族成员的氨基酸序列相似性最高,已达到87.40%,另外与拟南芥和柑橘的相似性分别为77.27%和76.89%。此外14-3-3蛋白与其他物种的14-3-3蛋白家族成员一样具有保守的酪氨酸激酶磷酸化位点,N-末端和C-末端的蛋白质信号基序。HaFT-9属于14-3-3蛋白家族。 图2

注:HaFT-9为梭梭14-3-3蛋白序列;柑橘(XP_006426292.1);菠菜(KNA23398.1);拟南芥(XP_020890110.1)
Note:HaFT-9 is a 14-3-3 protein sequence ofHaloxylonammodendron;Trusclementina(XP_006426292.1);Spinaciaoleracea(KNA23398.1);Arabidopsislyratasubsp.lyrata(XP_020890110.1)
图2 梭梭HaFT-9基因编码蛋白质的保守结构域预测
Fig.2 The prediction of conserved domains ofHaFT-9 protein genes fromHaloxylonammodendron
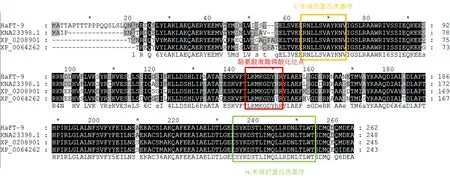
图3HaFT-9基因编码氨基酸序列与其他植物14-3-3的序列比对
Fig.3 Alignments of theHaFT-9 deduced amino acid sequences with other 14-3-3 proteins from plants
2.2.2 蛋白质的理化性质及亚细胞定位等预测
利用ProtParam在线软件对HaFT-9 蛋白的理化性质进行分析,结果显示和HaFT-9蛋白质为不稳定蛋白,分子量是29.392 kD,等电点pI 值为4.88,分子式为C1294H2057N345O4-14S10。利用PSIPRED在线软件对蛋白质的二级结构预测发现HaFT-9有12个α螺旋和1个β折叠。使用swiss-mode在线软件预测HaFT-9的三级结构发现HaFT-9可以形成同源二聚体,并以“U”的形式排列。利用BaCelLo在线软件对HaFT-9亚细胞定位进行预测表明HaFT-9基因编码的蛋白质定位在细胞核内。图4
2.2.3 蛋白质的系统进化树
选取拟南芥(XP_020890110.1)、油菜(XP_013738533.1)、中华猕猴桃(PSR99833.1)、橡胶树(XP_021649588.1)、藜麦(XP_021725612.1)、烟草(BAD12174.1)、甜菜(XP_010681047.1)、菠菜(KNA23398.1)、柑橘(XP_006426292.1)等植物中与HaFT-9相似性较高的14-3-3的氨基酸序列,利用MEGA 5.0软件系统分析。结果这些物种被聚为两大类,其中HaFT-9的氨基酸序列与柑橘的亲缘关系最近,与同为黎科的菠菜聚为一类,另一支甜菜、拟南芥、油菜、中华猕猴桃等聚为一类。同为黎科植物但不同来源的14-3-3 基因系统进化关系具有明显的种属特征。图5

注:A和B为蛋白的不同面
Note: A and B are different sides of the protein
图4 HaFT-9的三维结构预测模型
Fig.4 The 3-D structure of HaFT-9 established by SwissModel

注:HaFT-9为梭梭14-3-3蛋白序列
Note:HaFT-9 is a 14-3-3 protein sequence of Haloxylon ammodendron
图5 HaFT-9与其他物种14-3-3蛋白的系统进化树
Fig.5 Phylogenetic tree of the deduced amino acid sequences of HaFT-9 inHaloxylonammodendronand other species
2.3 不同胁迫条件下的HaFT-9基因表达
2.3.1 干旱、盐胁迫和激素处理下的基因表达
采用实时荧光定量PCR的方法,检测梭梭HaFT-9基因在20% PEG6000 模拟干旱胁迫、200 mmol/L NaCl高盐胁迫、20 μmol/L IAA及100 μmol/L ABA处理下的表达,在模拟干旱胁迫与盐胁迫下HaFT-9的表达均显著上调,且该基因的表达量在6 h达到峰值(图6 A,图6 B);在IAA和ABA激素处理下,HaFT-9基因的表达量分别在1和6 h达到峰值(图6 C,图6D)。以上结果表明,该基因可响应干旱胁迫、盐胁迫和激素诱导,同时对IAA信号的响应快于ABA,并且ABA信号响应与干旱和盐胁迫的响应模式相似。图6
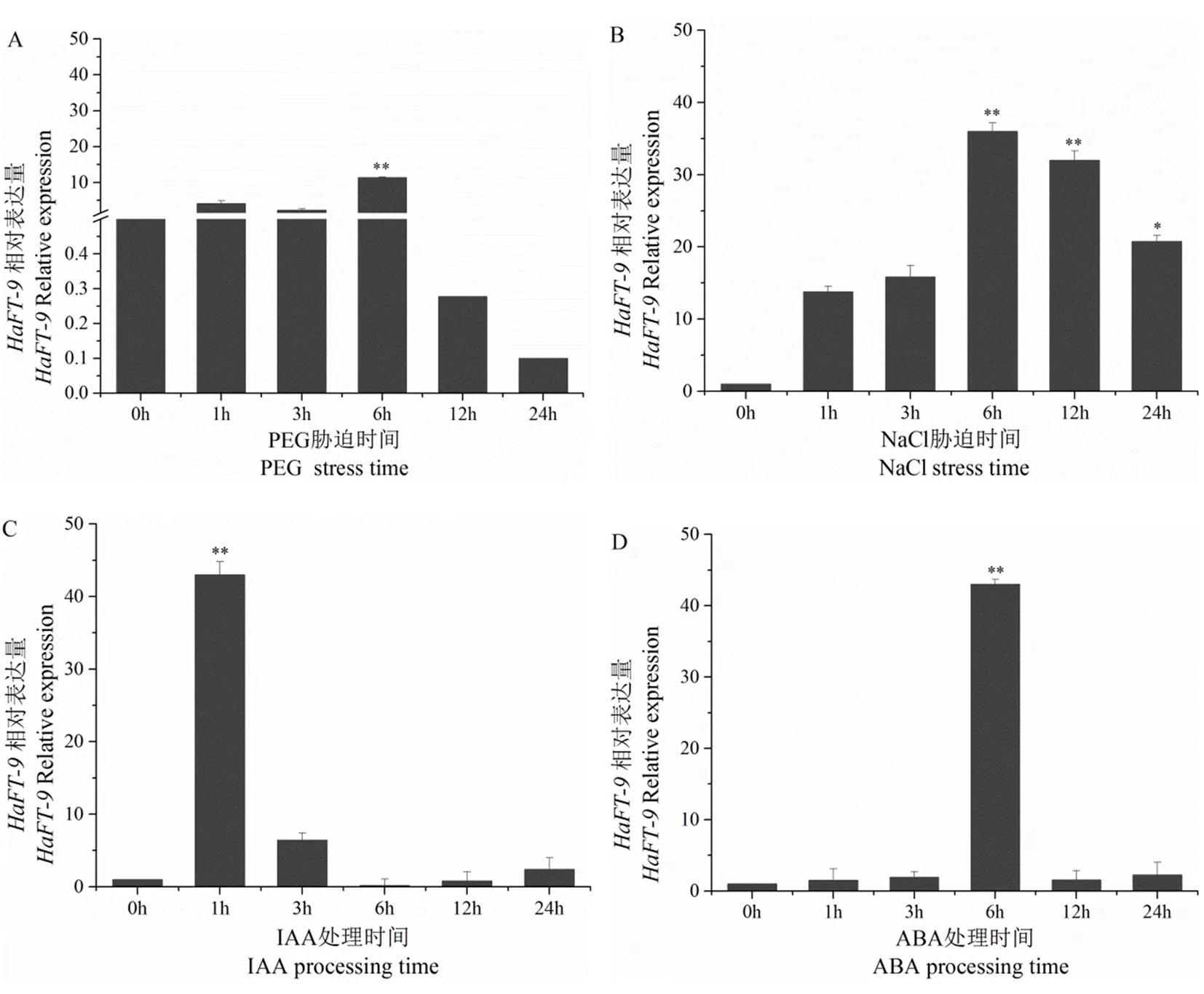
注:A、 B、C、D:分别为干旱胁迫、盐胁迫、IAA、ABA处理下HaFT-9的表达模式;*代表显著水平差异(P< 0.05);**代表极显著水平差异(P< 0.01)
Note: A, B, C and D: The expression patterns ofHaFT-9 under drought stress, salt stress, IAA and ABA treatments, respectively*Represent significant level difference (P< 0.05);**Represent extremely significant level difference (P< 0.01)
图6 非生物逆境胁迫下HaFT-9 的表达模式
Fig.6 Expression patterns ofHaFT-9 under abiotic stress
2.3.2 地表高温胁迫下的基因表达分析
研究表明, 一年生梭梭40℃胁迫下,HaFT-9基因的表达在胁迫时没有增加,在常温复原3 d时上调表达,但差异不显著;55℃胁迫下,基因的表达量在2 h达到峰值,之后逐渐下降(图7 A),在复原15 d时仍有高表达。两年生梭梭55℃胁迫下,HaFT-9基因的表达在常温复原7 d时显著上调,65℃胁迫下,24 h和常温复原7 d时基因表达上调显著,常温复原7 d时达到最高(图7 B)。表明HaFT-9基因可响应地表高温胁迫诱导同时在胁迫后的常温复原阶段仍能持续表达,推测该基因可能与高温胁迫和胁迫适应性相关。图7
2.3.3 高温胁迫适应条件下的基因表达分析
经模拟地表高温胁迫试验,证明梭梭结束高温诱导并恢复正常生长条件后,HaFT-9仍存在高水平表达,推测该基因可能与梭梭高温胁迫适应机制相关,为进一步验证该推测,设计如图8 A所示的处理模式,试验组和对照组初期都在26℃培养3 d作为CK和CK’,胁迫处理,试验组比对照组多一项37℃预胁迫。结果表明,对照组(图8B中的黑框):45℃高温胁迫1 h(S2’)后HaFT-9上调表达,在26℃恢复7 d后(R2’)表达没有下降,表达量是CK’的1.6倍;试验组(图8B中的灰框):在37℃高温预胁迫1 h(S1)后HaFT-9上调表达,相对表达量是CK的2倍,26℃ 恢复3 d后,表达量是CK的1.5倍,继续进行45℃胁迫1 h(S2)后,HaFT-9的表达量仍为对照的1.5倍,继续26℃常温恢复7 d(R2)后HaFT-9的表达量上升至CK的2.7倍,显著高于对照组的恢复阶段(R2’)。表明HaFT-9在高温处理和恢复阶段都上调表达,且经过37℃高温预处理后进行45℃胁迫后的恢复阶段,HaFT-9的表达量显著高于未经过预处理组,推测HaFT-9可能与高温胁迫适应性和胁迫记忆相关。图8

注:A:模拟地表高温胁迫下一年生梭梭HaFT-9的表达模式; B:模拟地表高温胁迫下两年生梭梭HaFT-9的表达模式;*代表显著水平差异(P< 0.05);**代表极显著水平差异(P< 0.01)
Note: A:Expression pattern of HaFT-9 in annualHaloxylonammodendronunder simulated surface heat stress; B:Expression pattern of HaFT-9 in biennialHaloxylonammodendronunder simulated surface heat stress*Represent significant level difference (P< 0.05);**Represent extremely significant level difference (P< 0.01)
图7 模拟地表高温胁迫下梭梭同化枝中HaFT-9的表达模式
Fig.7 Patterns ofHaFT-9 expression in assimilation branches ofHaloxylonammodendronunder simulated surface high temperature stress

注:A:处理模式; B:梭梭同化枝中HaFT-9的表达模式;CK’、CK、R1:梭梭幼苗26℃培养3 d;S1:梭梭幼苗37℃胁迫1 h;S2’、S2:梭梭幼苗45℃胁迫1 h;R2’、R2:梭梭幼苗26℃恢复7 d**代表极显著水平差异(P< 0.01)
Note: A: High temperature treatment patterns; B: Analysis ofHaFT-9 expression in assimilated shoots ofHaloxylonammodendron;CK'、CK、R1: Seedlings ofHaloxylonammodendronwere cultured at 26℃ for 3 days; S1: Seedlings ofHaloxylon ammodendron were cultured at 37℃ for 1 hour; S2’、S2:Seedlings ofHaloxylon ammodendron were cultured at 45℃ for 1 hour; R2’、R2 : Seedlings ofHaloxylonammodendronwere cultured at 26℃for 7 days;**Represent extremely significant level difference (P< 0.01)
图8 高温胁迫和常温复原条件下梭梭同化枝中HaFT-9的表达
Fig.8 Analysis ofHaFT-9 expression in assimilated shoots ofHaloxylonammodendronunder high temperature stress and normal temperature recovery
2.4 蛋白自激活及酵母双杂交实验
将BD载体和BD-HaFT-9载体分别转化酵母菌株Mav203,涂布于SD-Leu培养基,挑取单克隆点于SD-His培养基上(含10 mmol/L 3-AT),30℃培养2~3 d。转化子能够在SD-Leu培养基上正常生长,说明质粒成功转入酵母细胞,但无法在SD-His培养基上生长,HaFT-9蛋白无自激活活性(图9 A)。
将BD载体、BD-HaFT-9载体、AD载体、AD-HaFT-9载体、阳性对照(pEXP32-Krev1+pEXP22-RalGDS-wt)、阴性对照(pEXP32-Krev1+pEXP22-RalGDS-m2)转化酵母菌株Mav203,结果表明,转化子都能够在双缺培养基(SD-Leu-Trp)上生长,阳性对照与BD-HaFT9+ AD-HaFT-9可以在三缺培养基(含40 mmol/L 3-AT)上生长, 并在X-Gal的处理下显蓝色(图9 B)。HaFT-9蛋白在酵母体内能与自身互作形成同源二聚体。图9
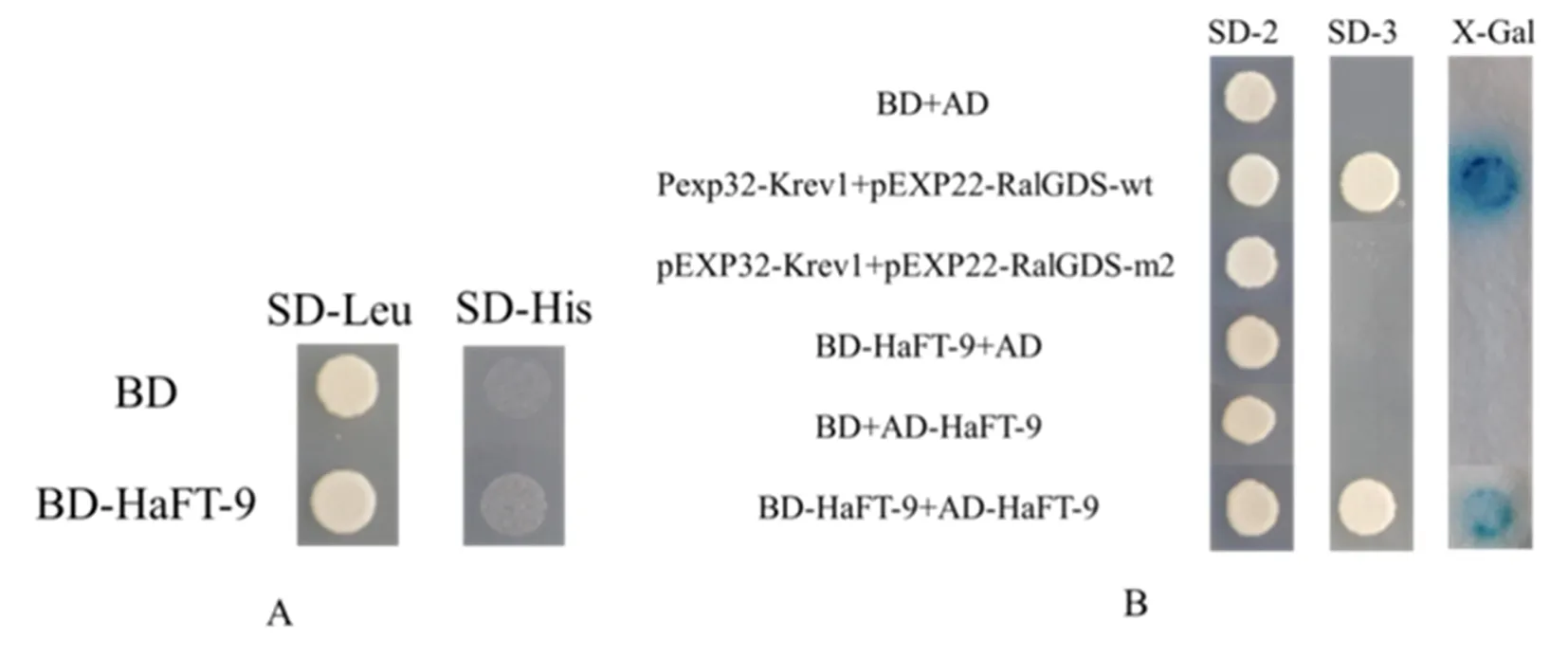
注:A:HaFT-9自激活实验;B:HaFT-9酵母双杂交实验;BD:载体pDESTTM32;SD-2:SD-Leu-Trp;SD-3:SD-His-Leu-Trp
Note: A :Self-activation experiment ofHaFT-9; B:Two-hybrid experiment ofHaFT-9 yeast; BD:Vector pDESTTM32; SD-2:SD-Leu-Trp; SD-3:SD-His-Leu-Trp
图9 酵母双杂交实验检测HaFT-9蛋白结合特性
Fig.9 Detection ofHaFT-9 protein binding characteristics by yeast two-hybrid assay
3 讨 论
14-3-3蛋白是高度保守且功能多样的调节蛋白[23],在植物体内主要以同源或异源二聚体的形式存在,已报道的14-3-3蛋白二聚体,烟草14-3-3c[24]和人类14-3-3t[25]的每个单体都是由9个反平行α螺旋组成。Lozano-Durán等[26]研究发现烟草14-3-3c蛋白,以“U”的形式排列形成同源二聚体,该蛋白具有干扰靶蛋白结合、连接两种靶蛋白、改变靶蛋白的催化活性和亚细胞定位等作用。试验利用在线软件swiss-mode预测HaFT-9的三级结构,发现HaFT-9可以形成同源二聚体,并以“U”的形式排列。由此对HaFT-9进行了转录自激活和酵母双杂交实验,结果证明,HaFT-9不具有转录自激活活性,并且与自身互作形成二聚体,说明,HaFT-9可以在酵母中形成同源二聚体。但试验预测HaFT-9蛋白的二级结构,表明该蛋白单体由12个α螺旋和1个β折叠组成,与前人研究[24-26]结果不完全相同,这种结构是否引起HaFT-9蛋白功能上的不同还需进一步研究。
Zhang等[27]发现过表达小麦14-3-3基因TaGF14b可以利用ABA信号通路增强植物对干旱、高盐等非生物胁迫的耐受能力。Yan等[11]发现过表达拟南芥14-3-3蛋白基因GF14λ,可提高棉花的耐旱性,减弱植株萎蔫程度。任江萍等[28]研究发现小麦14-3-3蛋白基因Ta14S的表达量在ABA、PEG、高温胁迫下显著上调。试验对梭梭幼苗进行干旱、盐胁迫和IAA、ABA处理时HaFT-9基因的表达均上调,说明,HaFT-9能够响应干旱胁迫、高盐胁迫、IAA、ABA激素信号诱导,该结果与前人的研究相似[11, 12, 27, 28]。
高温胁迫是一种常见的非生物胁迫,植物在初次受到这种高温胁迫后,体内的适应机制被启动,产生“胁迫记忆”,当植物再次受到这种胁迫时就会表现出对这种胁迫的适应性[29, 30]。近年来对拟南芥和水稻等植物的研究发现,由高温胁迫启动的基因表达会在正常生长温度下持续数日[31],当第二次高温来临时,基因会表现出比第一次更高的表达水平[32]。研究发现,拟南芥在高温胁迫处理结束后的2~6 h内,14-3-3蛋白基因GRF9仍然上调表达,表明GRF9的功能可能与高温胁迫适应性相关[33]。试验对一年生和两年生梭梭进行模拟地表高温胁迫处理时,发现梭梭在常温复原阶段,HaFT-9基因仍然上调表达,推测HaFT-9可能与热胁迫适应性有关。为验证这一推测,设计高温胁迫和常温复原试验,给予梭梭幼苗37℃非致死温度胁迫后,第二次再给予梭梭幼苗45℃胁迫后,HaFT-9表现出比第一次和对照组更高的基因表达水平,该结果与上述[29-33]研究一致。梭梭14-3-3蛋白基因HaFT-9可能与高温胁迫和高温胁迫适应性相关。
4 结 论
从梭梭中成功克隆得到了14-3-3蛋白基因HaFT-9,全长789 bp,编码262个氨基酸,HaFT-9蛋白不具有转录自激活活性,能与自身互作形成同源二聚体。HaFT-9基因可响应模拟干旱、盐、高温胁迫和IAA、ABA处理,并可能与高温胁迫适应性相关。

