不同目数碳酸钙对保加利亚乳杆菌发酵和冻干的影响
李晓军,马跃英,郭跃东,王海霞,冯 谦,王春颖,李康宁,黄少磊,刘彦民
(内蒙古双奇药业股份有限公司,内蒙古呼和浩特 010010)
乳酸菌是工业上公认的发酵能力最强的微生物,主要用于益生菌和乳酸生产。尽管如此,乳酸菌发酵过程中通常受到产物乳酸的抑制,导致生长速度减缓或停止,从而不能达到理想的细胞浓度或者乳酸浓度。目前,常用的浓缩培养方法主要有缓冲盐法、化学中和法、透析培养法、膜过滤法和微胶囊培养法等。从成本和应用规模上考虑,只有缓冲盐法和化学中和法更适合大规模的生产。一般情况下,研究人员以缓冲盐法配合化学中和法来实现更高的菌体密度。常用的中和剂有碳酸钙、氢氧化钙、氨水、氢氧化钠或氢氧化钾[1]。我国工业上常用碳酸钙作为乳酸发酵的中和剂。目前,针对不同类型的酸中和剂对乳酸菌的生长和产酸影响的研究比较多[2]。但是,关于不同目数碳酸钙对乳酸菌发酵和冻干的影响的研究非常鲜见。以保加利亚乳杆菌为研究对象,系统比较了不同目数碳酸钙对保加利亚乳杆菌发酵和冻干的影响。
1 材料与方法
1.1 材料
1.1.1 供试材料
保加利亚乳杆菌NQ2508。
1.1.2 培养基
改良MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,K2HPO42 g,柠檬酸二铵2 g,乙酸钠 5 g,吐温 -80 1 mL,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,碳酸钙2 g,蒸馏水 1 000 mL,pH值6.6。MRS检测培养基:在以上改良MRS培养基的基础上加入15 g的琼脂粉。冻干保护剂配方:脱脂乳200 g,乳糖120,谷氨酸钠10 g,抗坏血酸10 g,蒸馏水1 000 mL。
1.1.3 主要试剂
乳酸为分析纯,天津市富宇精细化工有限公司提供;100目,200目,325目,600目,800目和1 250目轻质碳酸钙,天津燕东矿产品有限公司提供。
1.1.4 主要仪器及设备
J2-21型离心机(BECKMAN)、超净台BCN-1360,哈尔滨东联公司产品;1029型厌氧培养箱,Forma scientific公司产品;2014-025Bb型真空冷冻干燥机,上海东富龙公司产品。
1.2 方法
1.2.1 不同目数碳酸钙中和乳酸能力比较
配制含不同目数碳酸钙的MRS培养基各200 mL,于121℃下灭菌15 min。冷却至室温后,分别以50%的乳酸滴定,每次每组加入的量均为50μL,加入后摇瓶5 s,然后测定pH值,直到所有组的pH值均降到4.5以下,停止滴加。比较各培养基pH值降到4.5时滴加乳酸的量。根据乳酸的滴加量来初步比较各种碳酸钙中和乳酸的能力。
1.2.2 不同目数碳酸钙对保加利亚乳杆菌生长影响
将保加利亚乳杆菌菌种在MRS液体培养基中活化2代后,按5%的接种量分别接种于含不同目数碳酸钙的MRS培养基中,厌氧培养箱于37℃下培养。每隔1 h取样测定发酵液活菌数和pH值,以活菌数和pH值为纵坐标、时间为横坐标,绘制生长曲线。比较不同目数碳酸钙对保加利亚乳杆菌生长的影响。
1.2.3 不同目数碳酸钙对保加利亚乳杆菌冻干影响
将保加利亚乳杆菌菌种在MRS液体培养基中活化2代后,按5%的接种量分别接种于含不同目数碳酸钙的MRS培养基中,厌氧培养箱37℃下培养。培养至对数生长后期时,于4℃下各发酵液以转速8 000 r/min离心20 min,弃去上清,离心得到的菌体以2倍质量的保护剂悬浮,然后进行真空冷冻干燥(预冻:-40℃,2 h;升华干燥:-30~-8℃,8 h;解析干燥:8~25℃,4 h)。得到的冻干粉进行活菌数检测,并计算冻干存活率。冻干存活率的计算方法为:

2 结果与分析
2.1 不同目数碳酸钙中和乳酸能力比较
含不同目数碳酸钙的MRS培养基灭菌后的pH值基本一致,都在6.5左右。但每种培养基中和乳酸的能力却有很大差别。同样将培养基pH值降到4.5,325目的碳酸钙所消耗的乳酸最多,为1 450μL。初步可以判断325目碳酸钙的中和能力较其他几种要强。
不同目数碳酸钙中和乳酸的能力比较见图1。
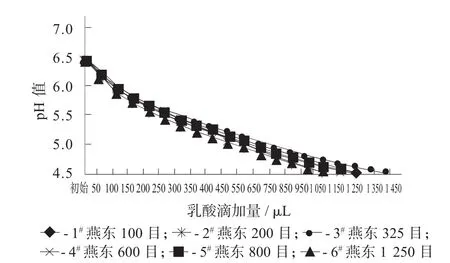
图1 不同目数碳酸钙中和乳酸的能力比较
2.2 不同目数碳酸钙对保加利亚乳杆菌生长的影响
各试验组的生长曲线见图2。
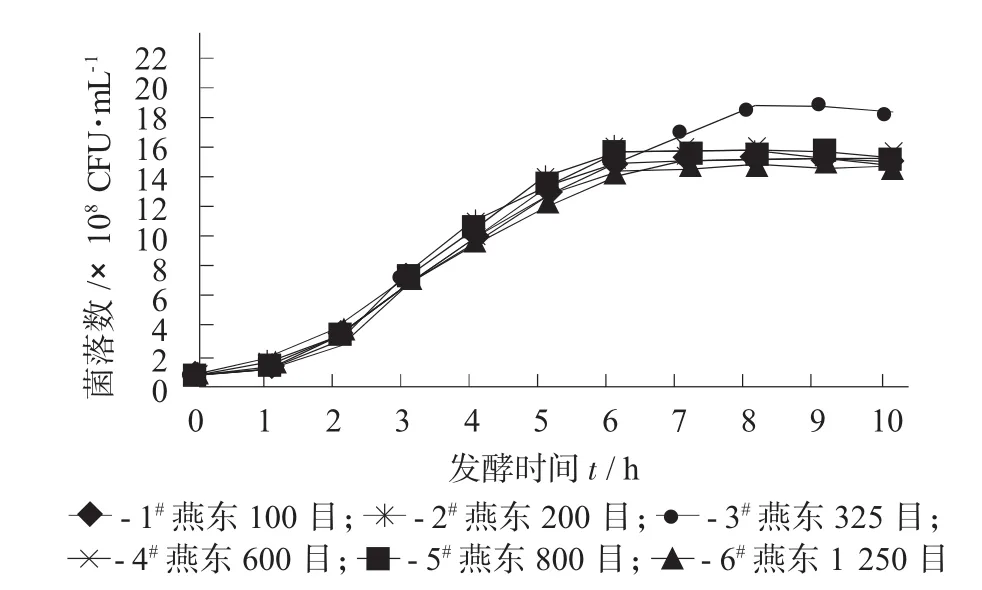
图2 各试验组的生长曲线
由图2可知,各试验组接种后经过短的缓慢期(约2 h)后,进入对数期,在发酵到6~8 h,时,菌体从对数期进入稳定期。可见,使用325目的碳酸钙的试验组3在8 h后进入稳定期,比其余各组晚2 h,对数期时间的延长,也使得发酵液活菌数得到了很大的提升。其中,试验组3的发酵液活菌数最高,达到19×108CFU/mL,与其他组相比,有显著性差异 (F=21.90,p<0.01)。
2.3 不同目数碳酸钙对保加利亚乳杆菌冻干的影响
在对数末期和稳定性前期收获各组发酵液,加入冻干保护剂,进行冷冻干燥,并计算冻干存活率。由表1和图3的结果可以看出,试验组3的冻干存活率较高,与其他组相比,差异具有统计学意义(p<0.01)。
3 结论
碳酸钙的目数越高,粒径越小。粒径的大小决定了碳酸钙颗粒的比表面积及颗粒上孔的大小和数量。在碳酸钙颗粒上的孔可以为乳酸菌提供一个相对有利的微环境[3]。首先,碳酸钙外壳可以使孔内细胞保持较高的活性水平,保护细胞不受研磨力和剪切力的影响。其次,乳酸菌产生的乳酸一旦被释放到细胞外溶液中,这部分乳酸就会被其周围的碳酸钙快速消耗,从而导致细胞周围溶液中游离乳酸浓度的降低。从而降低游离乳酸的反馈抑制作用,提高细胞微环境的pH值[4]。研究得到的结果显示,使用325目碳酸钙的试验组3的发酵液活菌数和冻干存活率最高,其次是使用800目碳酸钙的试验组5。目数太大和太小的试验组发酵液活菌数和冻干存活率均不高。可能的原因是,小目数的碳酸钙质量大、易沉底,大目数的碳酸钙质量小易漂浮,只有325目的碳酸钙处于悬浮状态,与乳酸菌的接触面积最大,且其比表面积和孔的大小及数量也适宜。
表1 各试验组的冻干存活率(±s)
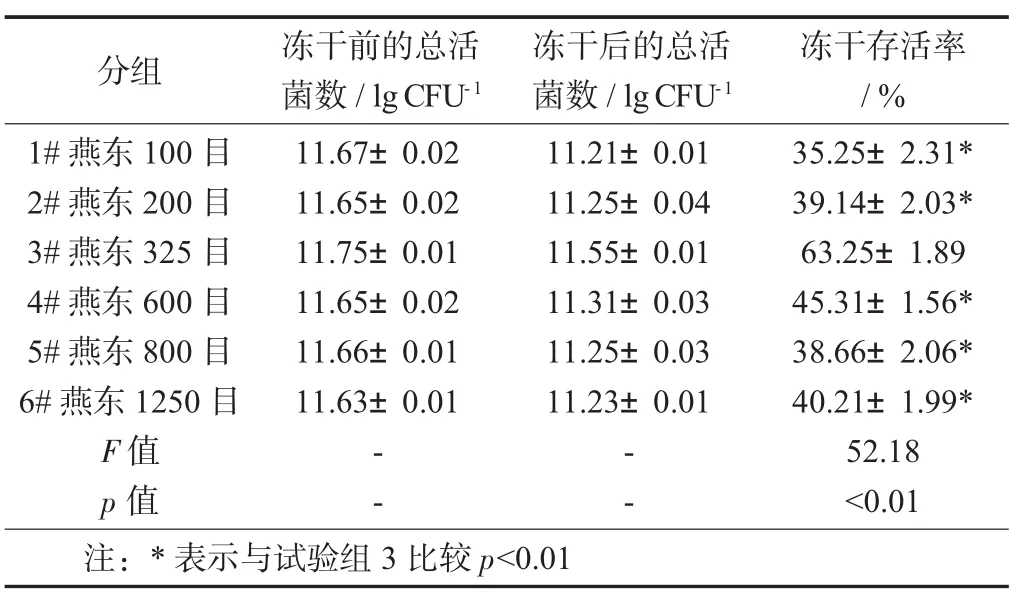
表1 各试验组的冻干存活率(±s)
?

图3 各试验组的冻干存活率
研究的不足之处在于,没有从微观角度证实不同目数碳酸钙形貌之间的区别,及保加利亚乳杆菌与碳酸钙颗粒之间的相互作用的机理。但是,研究的实际应用价值还是非常大的。首先,为乳酸菌发酵中和剂的筛选又创造了一条新途径和一种新的思路。其次,研究结果可进一步通过中试试验和生产试验的验证,应用于生产中,提升产能。

