蜂胶中五种酚酸对脂质代谢的影响
张雨豪,乔江涛,张红城
(中国农业科学院蜜蜂研究所,北京 100081)
随着生活水平的日益提高,人们在日常饮食中摄入的碳水化合物和脂类的总量有了显著增加,伴随内分泌失调,很多人正面临着由于体内脂质代谢紊乱而导致的一系列代谢问题[1-3]。与脂代谢紊乱密切相关的各种心血管疾病[4]、糖尿病[5]等正在严重地威胁人类的健康。因而,从天然产物中探索寻找能够调控脂代谢紊乱的有效成分,并深入研究揭示其在调控脂代谢紊乱方面的作用机制,正被越来越多的科研工作者所关注。蜂胶中含有种类繁多且含量丰富的多酚类化合物,有研究试验表明,植物来源的多酚类物质,如金雀异黄素[6]、柚皮素[7]等,对改善脂代谢紊乱具有积极作用。蜂胶作为一种传统药物,在很早以前就有将其应用于辅助治疗代谢疾病的相关报道。近年来,随着国内外科研工作者对蜂胶研究的不断深入,越来越多的研究正集中在探索揭示其在调控脂质代谢紊乱方面的作用机制[8-12]。在这些研究当中,蜂胶中含有的多酚类化合物往往被作为主要的研究对象。
蜂胶具有很多种类,如我国蜂胶的代表性类型是杨树型蜂胶,而产自巴西的绿蜂胶则主要以酒神菊类为胶原植物。蜂胶中的多酚类物质主要包括黄酮类化合物和酚酸类化合物,且不同产地、不同品种蜂胶中含有的多酚类物质组成具有很大的差异性[13-14]。此外,以往有关蜂胶能够调控和改善脂质代谢的研究多集中于黄酮类化合物,而关于酚酸类化合物的功能评价则相对较少,这是因为相比黄酮类化合物,酚酸类化合物的提取和制备有一定困难,且成本更高。因此,为了更加全面地了解蜂胶中对调节脂代谢紊乱能够起到改善作用的有效成分,试验以中国蜂胶作为研究对象,对中国蜂胶中存在的主要几种酚酸类成分进行了调节脂质代谢功能评价,通过建立细胞模型筛选出具有较好的降低细胞内脂质累积效果的酚酸类化合物成分。以期为中国蜂胶中有效成分在脂质代谢紊乱引发疾病的药物开发及应用提供理论依据。
1 材料与方法
1.1 材料与试剂
L02正常肝细胞,中国科学院细胞库提供;咖啡酸、阿魏酸、异阿魏酸、肉桂酸、亚桂皮乙酸、油红O染料、噻唑蓝(MTT)、二甲基亚砜(DMSO)、棕榈酸钠(PA),美国Sigma公司提供;胎牛血清(FBS)、青链霉素 (10 000 U/L)、非必需氨基酸(NEAA,100×)、0.25%胰蛋白酶,美国Gibico公司提供;牛血清白蛋白(BSA,无脂肪酸),德国Merck公司提供;乙醇(分析纯)、异丙醇(分析纯),北京化学试剂公司提供;苏木精染料、4%的多聚甲醛,北京酷来搏科技有限公司提供;DEME高糖培养基,美国Hyclone公司提供;超纯水纯化系统Milli Q Intergral,美国Merk Millipore公司提供。
1.2 仪器与设备
96孔细胞培养板、10 cm细胞培养皿、细胞冻存管,美国Corning公司产品;0.22μm微孔过滤膜,德国Merck Millipore公司产品;分析天平,梅特勒-托利仪器有限公司产品;HERA cell 150 CO2型恒温培养箱,美国Thermo Scientific公司产品;Olympus IX71型倒置荧光显微成像系统,日本Olympus公司产品;酶标仪,美国Biotek公司产品;AIRTECH无菌操作台,北京市华威中仪科技有限公司产品。
1.3 方法
1.3.1 样品前处理
细胞培养标准化学品溶液:准确称取咖啡酸、阿魏酸、异阿魏酸、肉桂酸和亚桂皮乙酸的标准品,于DMSO中进行溶解,并配成浓度为200μmol/L的储备液,各储备液经0.22μm的滤膜过滤后,于-20℃条件下储存备用,使用前可按要求浓度进行稀释。
1.3.2 细胞的培养
L02细胞培养于含10%的胎牛血清、100μg/mL链霉素和100 U/mL青霉素的DMEM高糖培养基中。细胞均置于温度37℃,CO25%,湿度95%的培养箱中,每2 d用胰酶消化传代1次。
1.3.3 MTT试验法检测酚酸对细胞活力影响
MTT试验参照Mosmann文献方法[15]。即在96孔板中,按每孔104个细胞的密度接种处于对数生长期细胞,培养体积为100μL/孔。接种24 h后,向孔中加入梯度浓度的药物储备液进行培养,DMSO浓度保持为0.1%,空白组为只含0.1%的DMSO,每个浓度做3个复孔。24 h后,弃去培养基上清液,用PBS清洗干净后向其中加入含有MTT(0.5 mg/L)的DMEM完全培养基(含10%FBS),放入37℃培养箱中培养。4 h后,弃去培养基上清液,向其中加入150μL DMSO溶液以溶解多聚甲醛,将96孔板置于摇床上反应10 min,然后于波长490 nm处读取每孔吸光度。存活率即每个浓度的吸光度与空白组的吸光度占比。
1.3.4 细胞脂质累积模型的建立
细胞脂质累积模型参照Xie C等人[16]文献方法构建,稍作调整。简单来说,在12孔板中,按每孔5×105个细胞的密度在爬片上进行细胞培养,试验组棕榈酸钠 (PA) 浓度分别为 100,200,300,400,500μmol/L,空白对照组为只含BSA,共设6个组,每组2个复孔,共同培养24 h后红油染色。方法为培养后迅速吸去12孔板中的培养基上清液,用PBS清洗干净后,向每孔中加入质量分数4%的多聚甲醛溶液400μL于室温下固定。15 min后将固定液弃掉,用二次水清洗干净后,向每孔中加入500μL的60%红油O染色液并轻轻摇晃,以使染色液铺染均匀,然后将12孔板于4℃条件下染色10 min,期间需避光。染色完成弃掉染色液,用二次水清洗干净后,向每孔中加入苏木精染色液进行染色,保持30 s后弃去,用二次水清洗1 min。最后,将爬片从12孔板中取出,用甘油和载玻片封片,在显微镜下进行观察。每个玻片需选取10个视野,通过Image-Pro Plus软件统计细胞被油红O染色的面积(Sum),用Photoshop软件统计细胞总生长面积(Area),二者数值之比即可反映细胞脂质累积的程度。数据结果以空白对照进行归一化处理。
1.3.5 酚酸对L02细胞脂质累积的作用
在12孔板中,按每孔5×105个细胞的密度在爬片上进行细胞培养,PA处理的模型组(相同浓度BSA+PA+0.1%DMSO),PA与非诺贝特酸处理的阳性对照组(相同浓度BSA+PA+0.1%DMSO+100μmol/L非诺贝特酸),PA分别与5,20,50,100μmol/L 4个浓度的药物处理组(相同浓度BSA+PA+0.1%DMSO+不同浓度的药物储备液),只含BSA的空白对照组(相同浓度BSA+0.1%DMSO),共设置7个组,每组2个复孔。药物处理组培养24h后红油染色,数据结果以空白对照进行归一化处理,分析比较5种酚酸类物质的降脂作用差异。
1.3.6 统计学分析
通过SPSS 19软件对获得的结果数据进行统计学分析,采用t检验进行显著性评价,当p<0.05即认为具有显著性差异。
2 结果与分析
2.1 酚酸对L02细胞活力的影响
不同浓度的咖啡酸、阿魏酸、异阿魏酸、肉桂酸、亚桂皮乙酸和棕榈酸对L02细胞活力的影响见图1。
采用MTT法评价了蜂胶中咖啡酸、阿魏酸、异阿魏酸、肉桂酸、亚桂皮乙酸5种酚酸类物质对L02人肝细胞细胞活力的影响。由图1可知,5种酚酸类物质在选择的浓度梯度范围内对L02人肝细胞皆不具有明显毒性,甚至咖啡酸在一定浓度范围还能够促进L02人肝细胞的增殖。相较而言,只有阿魏酸浓度在200μmol/L时,其与空白组相比,细胞存活率的降低具有显著性,但细胞存活率仍在85%以上。

图1 不同浓度的咖啡酸、阿魏酸、异阿魏酸、肉桂酸、亚桂皮乙酸和棕榈酸对L02细胞活力的影响
2.2 PA诱导L02细胞产生胞内脂质累积
PA处理24 h后L02人肝细胞细胞内脂质累积情况见图2。
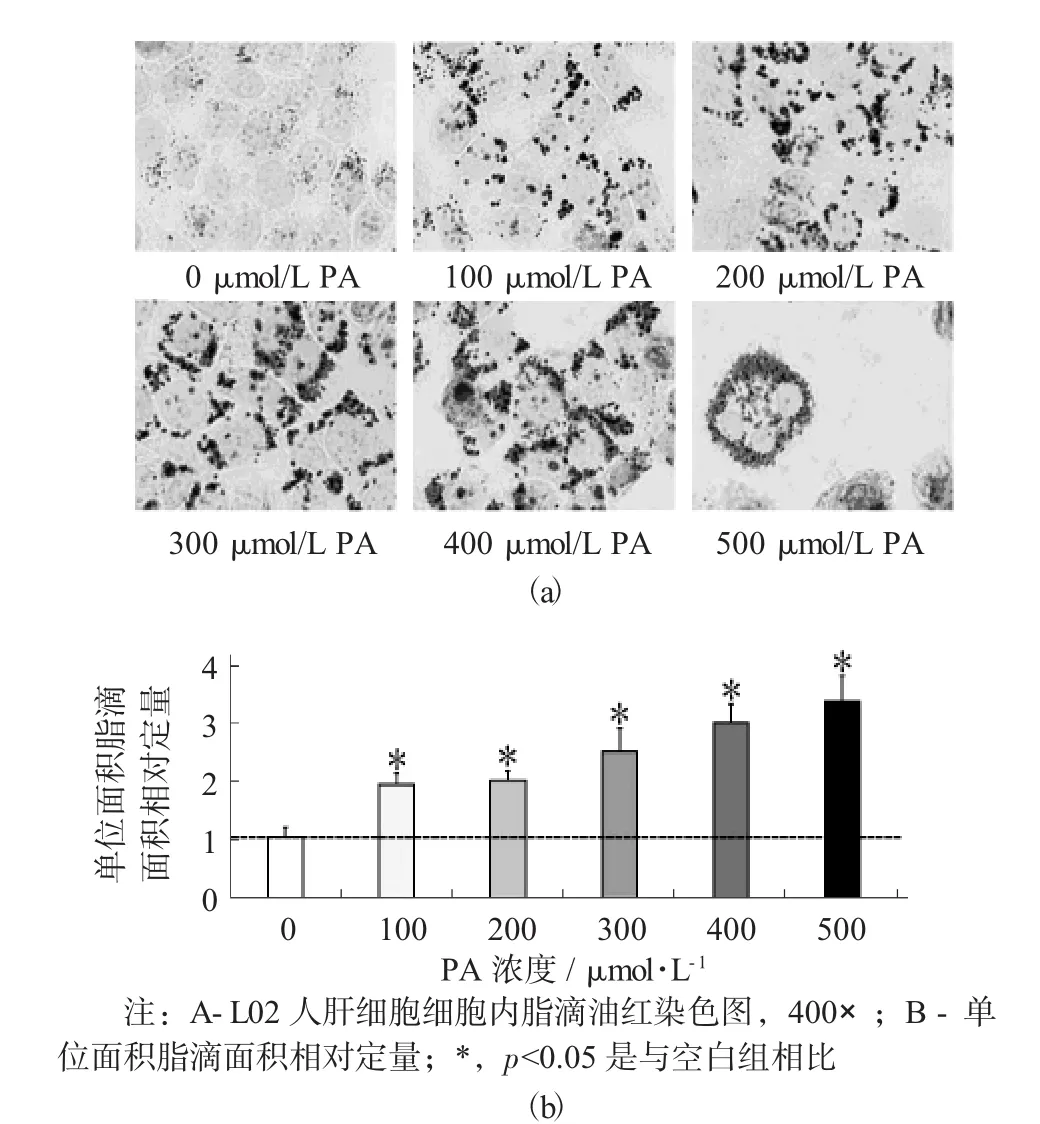
图2 PA处理24 h后L02人肝细胞细胞内脂质累积情况
采用MTT法评价了棕榈酸(PA) 对L02人肝细胞细胞活力的影响。由图2可知,当PA浓度高于100μmol/L时,将会对L02人肝细胞细胞活力产生显著性影响;当PA浓度高于300μmol/L时,L02人肝细胞的存活率低于70%;当PA浓度为500μmol/L时,L02人肝细胞的存活率仅为54%。此外,通过显微镜对细胞进行观察,可观察到已有一定数量的细胞呈漂浮状态。因此,研究选择的PA作用浓度为不高于500μmol/L。
PA能够诱导L02人肝细胞内脂滴的形成,并且形成脂滴的单位面积会随着PA作用浓度的增加而呈现增大趋势。当PA作用浓度大于300μmol/L时,细胞生长面积开始减小,这与MTT试验中细胞存活率的变化趋势相一致。此外,已有研究表明[17],当PA作用浓度达到300μmol/L时,即可影响细胞内多个通路蛋白的正常表达,并引发细胞发生脂质代谢异常。因此,试验选择300μmol/L作为PA的作用浓度,用于接下来的L02人肝细胞相关研究。
2.3 蜂胶中酚酸对L02细胞脂质累积的影响
PA和不同浓度异阿魏酸(IFRA) 处理24 h后L02人肝细胞细胞内脂质累积情况见图3。
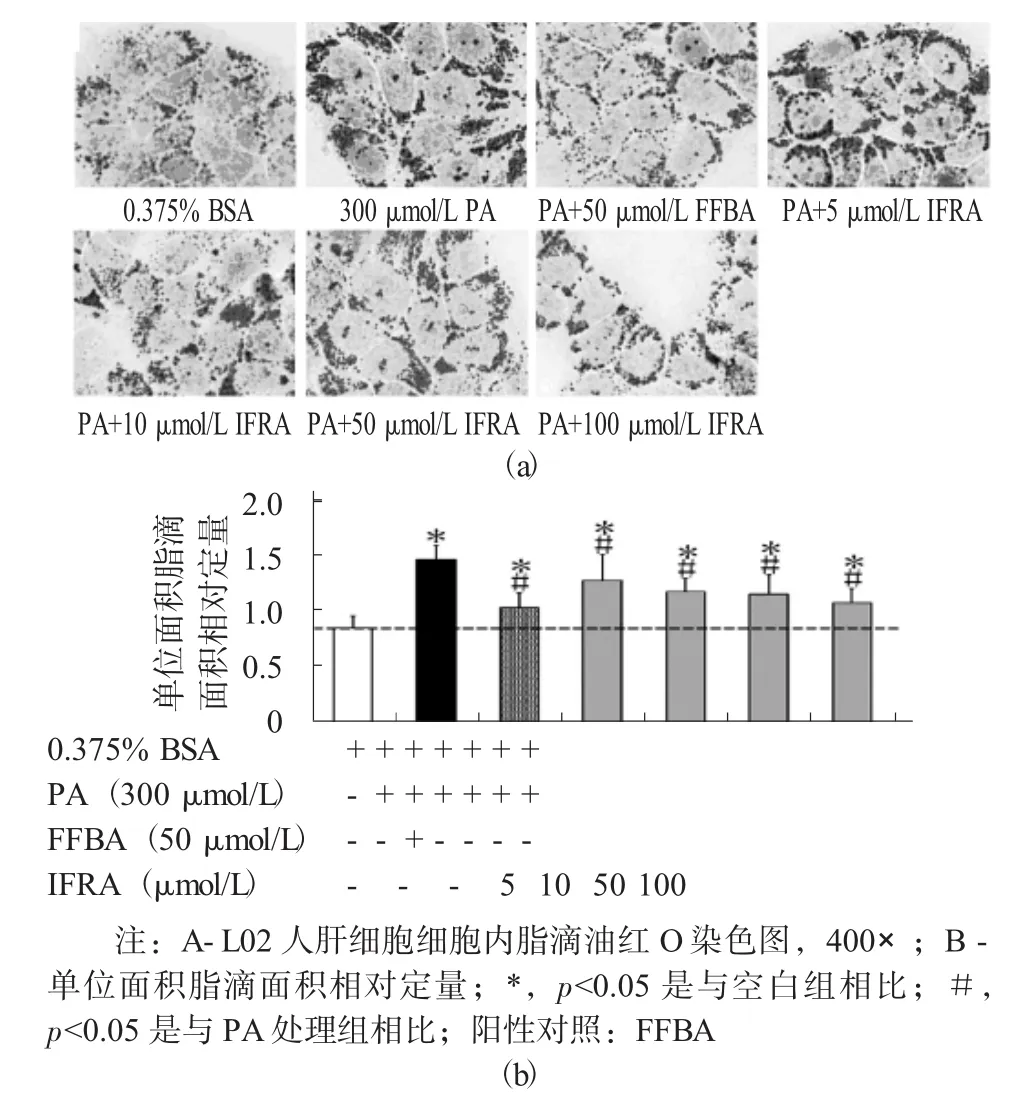
图3 PA和不同浓度异阿魏酸(IFRA)处理24 h后L02人肝细胞细胞内脂质累积情况
通过对模型组、阳性对照组、空白组及不同浓度的药物处理组的红油O染色,以及对细胞内脂滴面积进行统计分析,结果显示PA(300μmol/L) 作用24 h后,细胞内脂质累积程度可达空白对照组的1.5~3.0倍,对于药物处理组,试验选择的5种酚酸类物质中异阿魏酸的降低细胞内脂质累积的效果最好,相较于阳性对照组使用的非诺贝特酸,异阿魏酸在浓度同为100μmol/L时,可将脂质累积降低约22%,同浓度的非诺贝特酸的平均脂质累积减少约为30%。同时,研究结果还表明,另外4种酚酸类物质咖啡酸、阿魏酸、肉桂酸和亚桂皮乙酸并没有令人满意的改善细胞内脂质累积的效果。
3 结论
以中国蜂胶作为研究对象,对中国蜂胶中含量最多的5种酚酸类成分包括咖啡酸、阿魏酸、异阿魏酸、肉桂酸和亚桂皮乙酸进行调节脂质代谢效果评价。通过建立L02人肝细胞脂质累积模型,评价筛选出了这5种酚酸类成分中具有较好降低脂质累积效果的有效成分异阿魏酸,并通过试验研究确定其最佳的作用浓度为100μmol/L。

