小汗腺汗囊瘤六例报道并文献复习
满春花 陈声利 刘永霞 王建文 陈学超 卢宪梅
1 临床资料
病例来自山东省皮肤病医院2013年1月至2018年7月就诊的患者。1例男性儿童,5例中老年女性,病程1~9年。6例均因面部多发丘疹就诊,均诉夏重冬轻,4例无明显自觉症状,2例自觉瘙痒。查体:6例均一般情况可,各系统检查未见异常。皮肤科情况:面部见多发的、囊性透明的、肤色或红色且略带蓝色的丘疹,直径约1~3 mm(图1)。见表1。组织病理示:表皮大致正常,真皮内见一囊腔,4例见囊壁由两层立方形细胞组成(图2),2例囊壁仅见单层被挤扁的上皮细胞。1例囊肿下方见小汗腺腺体及导管。1例真皮内同时见皮内痣。诊断:多发性小汗腺汗囊瘤(Robinson型)。治疗:2例患者应用激光治疗后复发,2例患者未治疗,2例患者失访。
2 讨论
小汗腺汗囊瘤,是一种来源于小汗腺导管的囊肿,1893年由Robinson首先报道,他认为此病皮损为多发,几乎均发生于工作于湿热环境的女性。1973年Smith等[2]报道了另一种类型,皮损多单发,40%发生于男性,患者并未长期暴露于湿热环境中。此两种类型被称为Robinson型和Smith型。Tokura认为前者起源于小汗腺导管部,后者为小汗腺分泌部[3]。de Viragh认为并非如此,他发现单发性小汗腺汗囊瘤SMA染色阴性,而SMA在汗腺的分泌部应该阳性,因此他认为小汗腺汗囊瘤来源于小汗腺或者大汗腺的导管部[4]。本病好发于眼周及颊部,也可见于鼻部、躯干、腘窝、外耳及外阴,表现为针头至豌豆大囊性透明丘疹,淡蓝色或棕褐色,穿刺可有液体流出[5]。本组病例皮损均为多发,发病部位除眼周、颊部、鼻部外,3例发病于口周,皮损表现为1~3 mm淡蓝色丘疹,均在夏季加重,冬季减轻,6例均为Robinson型。

表1 患者临床资料
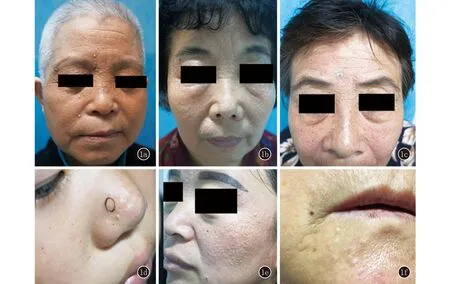
1a:病例1;1b:病例2;1c:病例3;1d:病例4;1e:病例5;1f:病例6
图16例多发性小汗腺汗囊瘤面部皮损
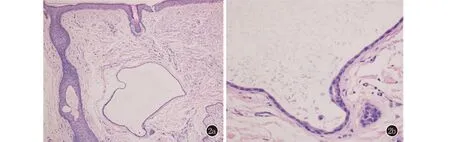
2a:真皮内可见一囊腔,囊腔底部可见一汗管及一皮脂腺(HE,×100);2b: 囊壁由两层立方层细胞组成,右下方可见囊壁与小汗腺导管相通,囊腔内见无定形均质物(HE,×400)
图2皮肤组织病理
Alfadley等[6]报道Robinson型小汗腺汗囊瘤发病年龄为40~70岁,男∶女为1∶8,杨帆报道发病年龄为6~16岁,男∶女为2∶3[5],本组病例发病年龄为3~60岁,男女之比为1∶5。
本病发病机制尚不清楚,与其起源有争议一样,有报道认为小汗腺汗囊瘤起源于小汗腺导管部[6],也有观点认为是由于汗液潴留和汗管的扩张或阻塞导致的排泄性的汗腺扩张[7]。组织病理学表现为位于真皮内的单房性囊肿,囊壁由两层小立方形细胞组成,有时仅见被挤扁的单层上皮细胞。连续切片,有时可见到囊腔与其下方的小汗腺导管相通。囊肿周围的纤维组织被挤压可形成假包膜。
常见与本病相关的遗传性疾病是Schopf-Schulz-Passarge综合征、Goltz-Gorlin综合征,自身免疫性疾病Graves病亦与本病相关[7,8]。本组病例并未合并上述疾病,1例病例合并皮内痣,检索国内外文献,未见相关报道,我们推测两者可能是偶然并发。
本病需与痱子、汗管瘤、多发性脂囊瘤、大汗腺汗囊瘤相鉴别。痱子位置表浅,转移至凉爽环境中可消退。汗管瘤及多发性脂囊瘤组织学表现可鉴别。大汗腺汗囊瘤与本病的鉴别见表2。对于汗囊瘤的分类和来源,除根据临床和组织学特征外,可借助于组化。汗腺的分泌部表达K7、K8、K18、SMA,导管部表达K1/5/10/14;大汗腺分泌部及导管部表达人乳脂球蛋白1,小汗腺不表达[4]。S100蛋白的表达报道不一,有报道S100蛋白表达于小汗腺分泌部的明细胞,在小汗腺的导管部和大汗腺不表达[3,9]。亦有报道其表达于小汗腺的腺泡和导管部[10]。CEA表达于大、小汗腺的分泌部和导管部,对鉴别无意义。

表2 大汗腺汗囊瘤与小汗腺汗囊瘤鉴别
目前此病治疗没有金标准,可手术切除,但会遗留疤痕,因而不适用于多发皮损。多发皮损可进行穿刺引流,但只能暂时缓解症状,很快就会复发[11]。外用1%阿托品或东莨菪碱治疗有效。对29例样本应用0.03%阿托品和15%氯化铝进行自身对照研究,发现前者疗效优于后者,而且0.03%阿托品并未产生视力模糊或口腔干燥等不良反应[12,13]。应用A型肉毒素进行局部注射,疗效维持时间可达2~11个月,复发后再次应用有效[14,15]。激光疗效报道不一[16,17],有应用异维A酸联合CO2激光治疗,取得了良好疗效,异维A酸使囊肿缩小,减少了激光的副作用[18]。亦有报道应用冷冻治疗使皮损减少90%以上[19]。

