榄香烯口服乳联合化疗对晚期食管癌的疗效
(天津医科大学总医院,天津 300052)
食管癌是世界范围内癌症死亡的第6大原因,每年新发病例约45.6万例,死亡人数约40万例。全球约90%的食管癌是鳞状细胞癌[1]。早期的食管癌患者通常缺乏特异性的临床症状与体征,绝大多数就诊时已是晚期,治疗难度增加。目前手术仍是治疗食管癌的主要方式,但5年总体生存率低,疗效不理想[2]。联合化疗能够提高晚期食管癌患者的生活质量,因此,寻找一套安全有效的联合化疗方案显得尤为重要[3]。本研究采用榄香烯口服乳联合多西他赛和奥沙利铂方案治疗晚期食管鳞癌,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年2月—2018年1月天津医科大学总医院晚期食管鳞癌患者44例。其中,男性37例,女性7例。随机分为观察组(榄香烯口服乳联合多西他赛和奥沙利铂)和对照组(多西他赛联合奥沙利铂)。观察组患者21例。其中,男性18例,女性3例;平均年龄(65.52±8.29)岁;上段食管鳞癌3例,中段食管鳞癌11例,下端食管鳞癌7例;临床分期:Ⅲ期11例,Ⅳ期10例。对照组患者23例。其中,男性19例,女性4例;平均年龄(64.61±6.94)岁;上段食管鳞癌5例,中段食管鳞癌11例,下段食管7例;临床分期:Ⅲ期10例,Ⅳ期13例。所有患者均经细胞、组织学检查证实TNM分期为Ⅲ、Ⅳ期的晚期食管鳞癌患者。入选患者Karnofsky评分≥60分。入选病例的一般资料比较,差异无统计学意义(P >0.05),具有可比性。
1.2 方法
对照组予多西他赛联合奥沙利铂化疗。多西他赛75 mg/m2加入 0.9% 氯化钠 500 ml,静脉滴注,1.5 h,1 d。奥沙利铂 100 mg/m2加入 5% 葡萄糖 500 ml,静脉滴注,3 h,1 d;观察组在此基础上加用榄香烯口服乳 20 ml口服,3 次 /d,1 ~ 8 d。上述治疗以 21 d 为1个周期,行2周期化疗。所有患者在使用多西他赛前1天;当天及后1天均予地塞米松7.5 mg口服,2次/d,以预防体液潴留和过敏反应。多西他赛滴注后开始予心电监护,持续4 h。化疗期间予托烷司琼止吐。化疗期间,如果疾病进展或发生不可耐受的毒副反应则终止本方案。
1.3 疗效评价
疗效评价参考RECIST评价标准:完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)、病情进展(progressive disease,PD)。总有效率(overall response rate,ORR):(CR+PR)×100%,疾病控制率(disease control rate,DCR):(CR+PR+SD)×100%,生活质量参照Karnofsky评分标准。毒副反应评价参照WHO化疗药物毒副反应分度标准,对血常规、肝肾功能及胃肠道反应进行评估。免疫功能:检测两组NK、CD4+/CD8+的变化。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件。计量资料以均数±标准差(±s)表示,符合正态分布的比较采用t检验,计数资料以例或例(%)表示,比较采用χ2检验,等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者完成治疗情况比较
观察组21例患者全部完成治疗,对照组23例患者中完成治疗22例,1例退出。两组患者完成情况比较,差异无统计学意义(χ2=0.934,P =0.334),具有可比性。
2.2 两组患者疗效比较
化疗后观察组ORR为58.3%,对照组ORR为40.9%,两组患者化疗后ORR比较差异无统计学意义(χ2=2.865,P =0.091)(见表1)。化疗后观察组 DCR 为90.4%,对照组DCR为86.3%。两组患者化疗后DCR比较差异无统计学意义(χ2=0.177,P =0.674)(见表2)。
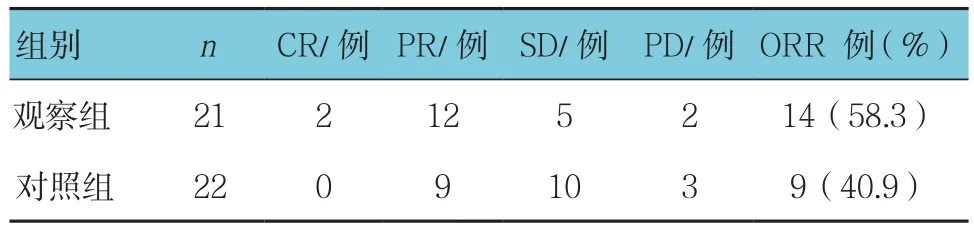
表1 两组患者化疗后ORR比较
2.3 两组患者生活质量比较
观察组化疗前后的Karnofsky评分比较差异有统计学意义(P<0.05),对照组化疗前后的Karnofsky评分差异无统计学意义(P >0.05)(见表3)。观察组生活质量提高的人数与对照组比较,差异有统计学意义(χ2=6.952,P =0.031),观察组高于对照组(见表4)。
2.4 两组患者体重变化比较
观察组和对照组化疗前后的体重变化差异无统计学意义(见表5)。观察组体重增加人数与对照组比较,差异有统计学意义(χ2=6.148,P =0.046),观察组多于对照组(见表6)。
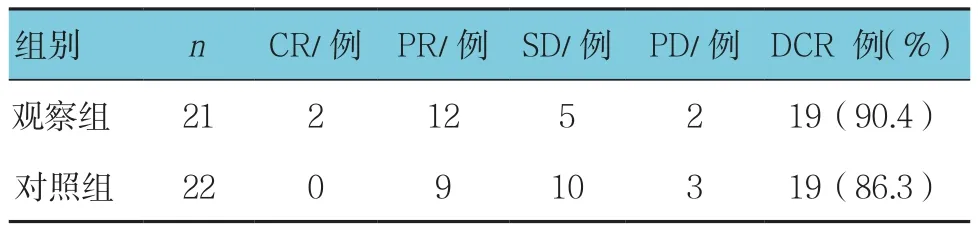
表2 两组患者化疗后DCR比较
表3 两组患者化疗前后Karnofsky评分比较(±s)
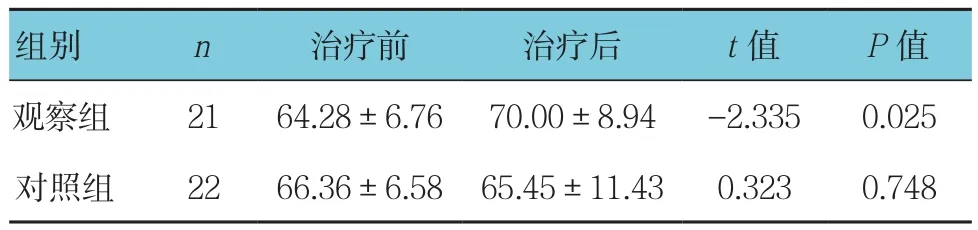
表3 两组患者化疗前后Karnofsky评分比较(±s)
组别 n 治疗前 治疗后 t值 P值观察组 21 64.28±6.76 70.00±8.94 -2.335 0.025对照组 22 66.36±6.58 65.45±11.43 0.323 0.748
2.5 两组患者毒副反应比较
化疗后观察组WBC减少、PLT减少、ALT升高、腹泻、恶心呕吐方面与对照组比较,差异有统计学意义(P<0.05),观察组优于对照组。见表7。
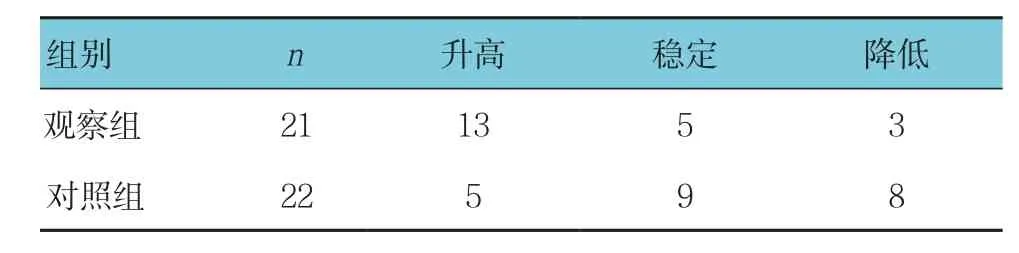
表4 两组生活质量提高人数比较 例
表5 两组患者化疗前后体重变化情况比较(kg,±s)
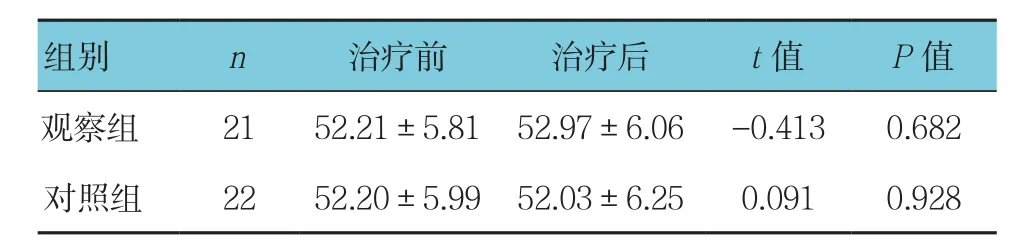
表5 两组患者化疗前后体重变化情况比较(kg,±s)
组别 n 治疗前 治疗后 t值 P值观察组 21 52.21±5.81 52.97±6.06 -0.413 0.682对照组 22 52.20±5.99 52.03±6.25 0.091 0.928
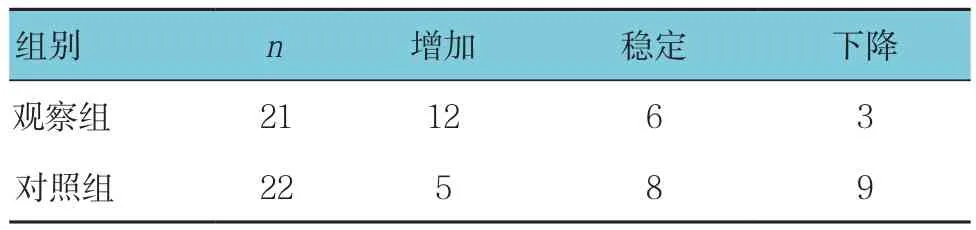
表6 两组体重增加人数比较 例
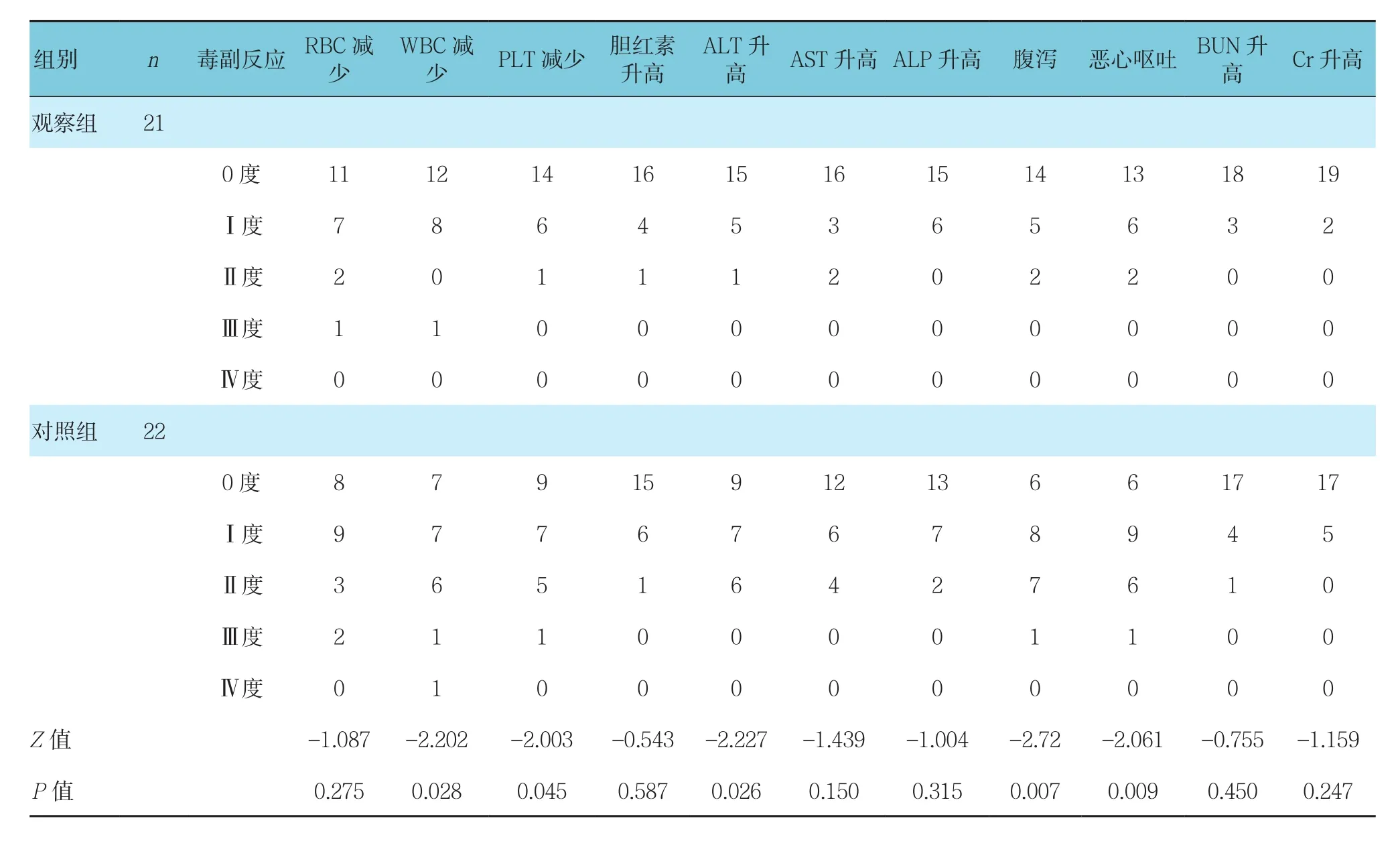
表7 两组患者化疗后毒副反应比较 例
2.6 两组患者免疫功能比较
化疗后观察组和对照组NK细胞活性变化比较,差异有统计学意义(χ2=6.050,P =0.049)。CD4+/CD8+比值变化比较,差异有统计学意义(χ2=7.720,P =0.021)。观察组优于对照组。见表8。
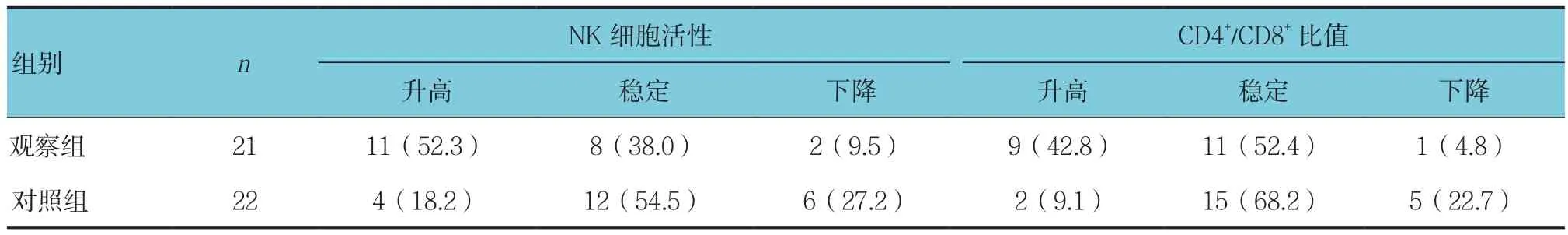
表8 两组患者化疗后免疫功能比较 例(%)
3 讨论
食管癌是一种常见的消化道恶性肿瘤,全世界几乎所有的国家都有发生,约60%的食管癌发生在中国[4]。食管癌相对其他肿瘤恶性程度高,临床疗效差。对于晚期食管鳞癌患者来说,单纯化疗总体获益率及5年生存率低[5],因此往往采用联合化疗。
多西他赛联合奥沙利铂能有效地治疗非小细胞肺癌[6]。目前进展期胃癌的一线化疗药物仍然是多西他赛和奥沙利铂[7]。但对晚期食管鳞癌而言,疗效仍不能使人满意,因此需进一步寻找更加有效的化疗方案。
榄香烯是从传统中草药温莪术中分离出来的化合物。其主要成分是β-榄香烯(化学名1-甲基-1-2乙基-2,4-二异丙基环己烷,分子式C15H24)。研究表明,其具有广谱抗肿瘤、免疫保护、诱导细胞凋亡和分化作用,还可以逆转肿瘤的多重耐药性,增强联合放疗或化疗的敏感性[8],所以广泛应用于恶性肿瘤的治疗。通过增加P15和降低细胞周期蛋白D1的表达水平,从而促进G1期细胞周期停滞进而抑制SiHa细胞的增殖[9]。巨噬细胞能促进肿瘤生长、存活,并可能导致对治疗的抵抗[10]。榄香烯可以调节巨噬细胞的极化,降低M2表型标记的表达,从而抑制巨噬细胞的促瘤作用[11]。但本研究中观察组和对照组总有效率、疾病控制率差异无统计学意义,猜想导致此结果的原因可能如下:①食管鳞癌的异质性,可能不具有榄香烯口服乳的作用靶点;②样本数量偏少,该研究结果可能无法代表榄香烯治疗晚期食管鳞癌的整体现状;③榄香烯发挥效用与药物浓度以及作用时间有一定的联系,可能该研究中所使用的榄香烯浓度不是最佳的有效药物浓度或者榄香烯的作用时间未在治疗时间窗之内。
白艳凤等[12]提出榄香烯口服乳联合顺铂和氟尿嘧啶可提高患者的生活质量,且安全性较好。此外,还有研究显示,对提高晚期胃癌患者的生活质量,减少骨髓抑制、消化道反应发生率,榄香烯联合替吉奥是有效的方案[13]。本研究结果与榄香烯口服乳在其他肿瘤中发挥的作用保持一致,可以认为榄香烯口服乳是一种能够改善患者生活质量,且安全性高的化疗药物。
食管癌的特征性表现是进行性吞咽困难,营养不良发生率高达60%[14]。本研究中观察组体重增加的人数高于对照组,差异有统计学意义,体重的增加对患者化疗的耐受和疾病预后都有一定的增益,因此,认为榄香烯口服乳治疗晚期食管鳞癌患者是有效的。
榄香烯能够增强肿瘤细胞的免疫原性,并改善患者体内的免疫系统[15]。榄香烯能直接作用于细胞膜,破坏细胞,进而增强肿瘤细胞的免疫原性,诱发机体的免疫应答[16]。T淋巴细胞在机体免疫应答中发挥重要作用,主要包括CD4+和CD8+T细胞。CD4+T淋巴细胞为辅助性T细胞,能够辅助B淋巴细胞产生抗体,完成抗肿瘤作用。CD8+T淋巴细胞为抑制性T细胞,通过结合肿瘤细胞表面特异性抗原,然后活化,进而杀伤肿瘤细胞。NK细胞能够与肿瘤细胞表面特殊靶结合,然后释放穿孔素等,进而破坏肿瘤细胞。榄香烯通过提高T淋巴细胞的转化率及生成率和增强自然杀伤细胞活性进而提高机体免疫功能[17]。本研究观察组在提高免疫细胞水平方面优于对照组,差异有统计学意义,提示榄香烯可以提高食管癌患者的免疫功能。
新辅助化疗是指在恶性肿瘤局部实施手术或放疗前应用的全身性化疗。其能够缩小原发病灶及转移的淋巴结,为无手术条件的患者提供手术的可能,并进一步提高根治性手术的切除率,还能够降低肿瘤细胞的活力,减少术中转移及术后并发症的发生,由此认为该方案可能同样适用于食管鳞癌的新辅助化疗。
综上所述,榄香烯口服乳联合多西他赛和奥沙利铂方案对晚期食管鳞癌患者疗效无差异,但可提高患者的生活质量,增加其体重,提高免疫力,且安全性高,无明显不良反应。

