一种水稻穗腐病新病原的鉴定
陈利军,王春生,田雪亮,智亚楠,刘焱琨,卫云飞
(1.信阳农林学院 农学院,河南 信阳 464000; 2.河南省豫南农作物有害生物绿色防控院士工作站,河南 信阳 464000; 3.河南科技学院 资源与环境学院,河南 新乡 453003)
近年来,水稻穗腐病(Rice spikelet rot disease,RSRD)在我国各稻区的发生危害逐年加重[1-8]。水稻穗腐病危害稻穗,造成谷粒腐坏、变色、结实率降低或不实、稻米畸形等,不仅影响产量、降低稻米品质,同时病原菌还会产生毒素,对食用者的安全和健康构成危害,已成为水稻高产、稳产和优产的限制因子之一[1-6]。
水稻穗腐病由多种病原真菌复合侵染引起[1-3,6-8]。目前,已确认的病原菌有9种:层出镰刀菌(Fusariumproliferates)、藤仓镰刀菌(F.fujikuroi)、拟轮枝镰刀菌(F.verticillioidess)、尖孢镰刀菌(F.oxysporum)、禾谷镰刀菌(F.graminearum)、澳大利亚平脐孺孢(Bipolarisaustraliensis)、新月弯孢菌(Curvularialunata)、稻黑孢菌(Nigrosporaoryzae)和细交链格孢(Alternariatenuis)。不同种植生态区水稻穗腐病的病原菌种类不完全相同,长江流域以层出镰刀菌和新月弯孢菌为主,江淮流域以层出镰刀菌、新月弯孢菌和稻黑孢菌为主[6]。
水稻穗腐病原菌侵染稻穗谷粒后,初期一般表现为谷粒颖壳有黄褐色或铁锈色椭圆形小斑点,后期病斑扩大并变为褐色至黑褐色,有些伴有霉层[5]。水稻是河南省信阳市的主要粮食作物,近年来,水稻穗腐病的危害逐年加重。在对信阳市水稻穗腐病的调查研究过程中,发现部分受穗腐病危害的水稻谷粒外颖开裂,外露籽粒伴有白色、粉红色、黑色或蓝绿色霉层。经初步镜检鉴定,谷粒上蓝绿色霉层为一种青霉(Penicilliumsp.)病菌,在水稻穗腐病病原菌中未见报道。为了明确该青霉与水稻穗腐病的关系,本研究对该菌进行分离纯化、致病性测定、形态学鉴定和多基因系统发育分析,以期进一步明确信阳市水稻穗腐病病原菌种类,为防控措施的制定提供理论依据。
1 材料和方法
1.1 病原菌分离和纯化
2015年8月,从信阳农林学院水稻研究所三桥试验基地采集病株样本,记录样本信息后带至实验室,在超净工作台上用接种针挑取病害材料表面的霉层,接种到含硫酸链霉素(50 μg/mL)的马铃薯葡萄糖琼脂(PDA)培养基上。待培养基上菌落形成后,采用水琼脂单孢纯化法对菌株进行纯化,纯化后的单菌落接种至PDA斜面,4 ℃保存备用。
1.2 病原菌致病性测定
于2017年8月在信阳农林学院水稻研究所三桥试验基地开展致病性测定,接种水稻品种为红优2009。采用颖内注射法接种[4],将供试菌株制成5×106个/mL孢子悬浮液,于扬花始期注射,每小穗注射10粒。接种后7 d,观察发病情况。取接种发病谷粒,按照1.1中的方法分离病原物,将分离纯化得到的菌株与原接种菌株进行形态学比较。
1.3 病原菌形态学鉴定
供试菌株的形态学鉴定参照孔华忠[9]的方法进行,使用查氏琼脂(CA)培养基、查氏酵母膏琼脂(CYA)培养基和25%甘油硝酸盐琼脂(G25N)培养基,25 ℃下培养。参照康振生[10]的方法用扫描电镜观察菌株的产孢结构和分生孢子。
1.4 病原菌分子生物学鉴定
1.4.1 菌株DNA提取 将供试菌株孢子悬浮液均匀涂抹在铺有1层无菌玻璃纸的PDA平板上,25 ℃培养7 d后刮取玻璃纸上的菌丝,采用CTAB法[11]提取菌株基因组DNA。
1.4.2 多基因序列扩增 采用PCR扩增供试菌株核糖体内转录间隔区(Internal transcribed spacer,ITS)、β-tubulin微管蛋白基因(BenA)和钙调蛋白基因(CaM)部分序列。PCR反应体系为20 μL:DNA模板(100 ng/μL)1 μL、上下游引物各1 μL、PCR mix 10 μL、Taq酶(5 U/μL)0.25 μL、ddH2O 6.75 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸5 min。PCR扩增所用引物见表1。PCR产物经1%琼脂糖凝胶电泳检测后,送北京擎科生物科技有限公司测序。

表1 PCR扩增所用引物Tab.1 Primers for PCR amplification
1.4.3 系统发育分析 通过在NCBI数据库中对供试菌株的ITS、BenA和CaM序列的测序结果进行BLAST比对,对该病原菌种属进行初步鉴定。选取青霉菌属Lanata-Divaricata组中代表种的模式菌株(Ex-type strain)及外群菌株[15],并从GenBank数据库中下载上述菌株的ITS、BenA和CaM序列,具体菌株和基因序列见表2。利用ClustalX软件对供试菌株和下载菌株序列进行比对分析。比对后的序列用BioEdit软件编辑后,利用Sequence Matrix软件将所有菌株的ITS、BenA和CaM序列拼接在一起,将拼接好的多基因序列导入MEGA 7中,采用邻接法(Neighbor-Joining,NJ)构建系统发育树。
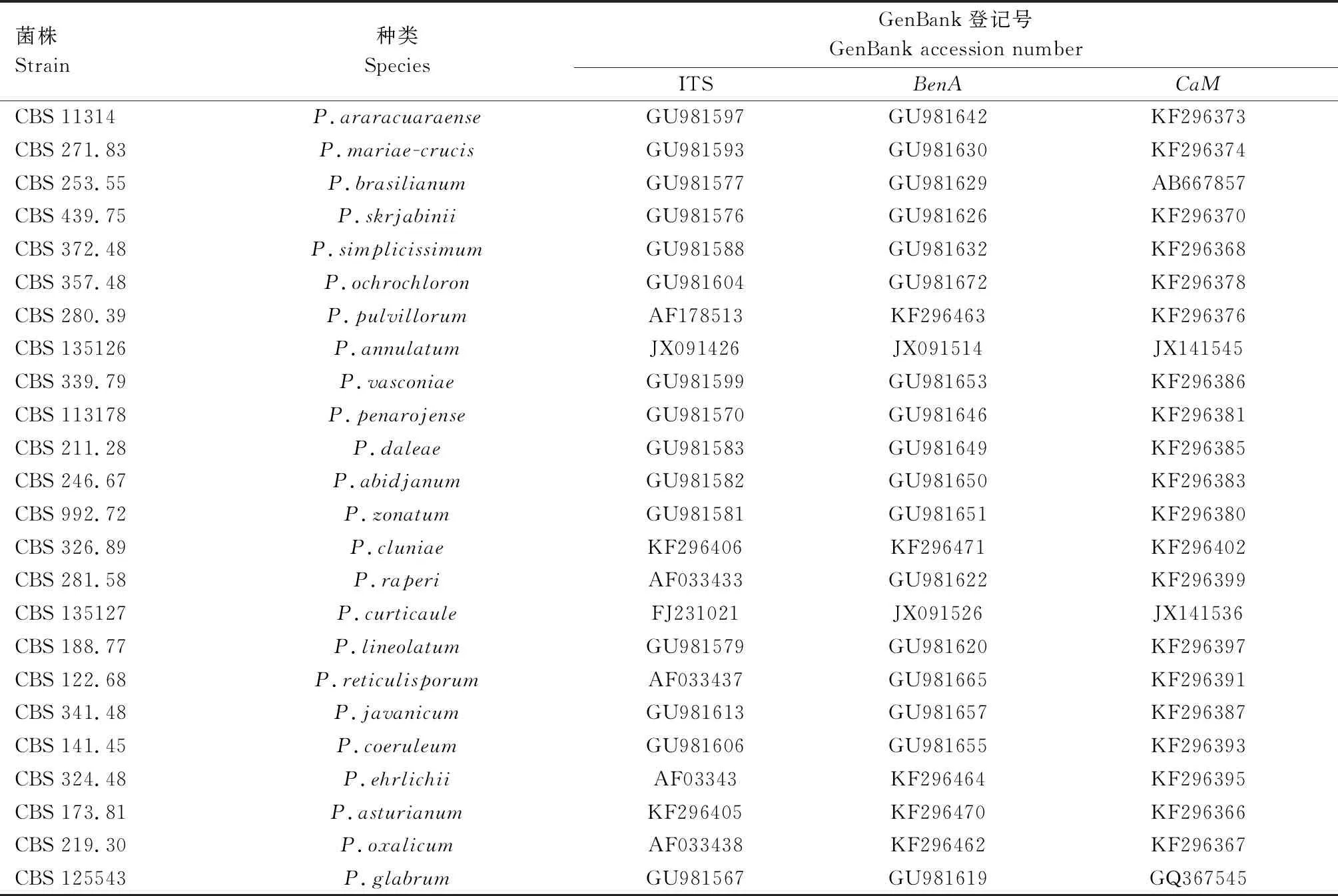
表2 系统发育分析所用青霉属菌株相关信息Tab.2 Related information of Penicillium strains used in phylogenetic analysis
2 结果与分析
2.1 田间水稻受害症状
受侵染的水稻同其他水稻穗腐病菌危害的症状相似,颖壳初期也呈现黄褐色至黑褐色,但后期外颖开裂,外露蓝绿色霉层,谷粒部分受害或无谷粒(图1A)。

A:田间;B:接种7 d
2.2 病原菌分离及致病性测定
将通过PDA培养基分离得到的菌株初步确认为青霉菌属(图2),菌株编号为R1。颖内注射接种菌株R1孢子悬浮液后,水稻穗粒外颖开裂,外露蓝绿色霉层,颖内无谷粒或谷粒遭受危害,同田间受害症状相似(图1B)。对发病谷粒进行再分离,发现分离物与接种菌株有相同的形态学特征。
2.3 病原菌形态学鉴定
对菌株R1进行菌落形态观察,结果见图2。25 ℃条件下,在CA培养基上培养12 d后,菌落直径介于62~79 mm,近平坦,质地绒状,菌落正面暗绿色,反面橙黄色,分生孢子大量产生,易脱落;相同条件下在CYA培养基上培养7 d后,菌落直径介于44~59 mm,正面暗绿色,反面橘褐色,分生孢子大量产生;在G25N培养基上培养7 d后,菌落直径仅介于10~18 mm,菌落正面暗绿色,反面中部黄色。
对菌株R1进行显微形态观察,结果见图3。该菌株产孢结构呈扫帚状,帚状枝通常双轮生,梗基每轮2~3个,彼此通常较紧贴,瓶梗每轮4~8个,分生孢子长椭圆形,(4.3~5.3)μm ×(3.2~3.9)μm。扫描电镜观察结果表明,孢子壁呈波纹状褶皱。R1菌株形态学特征与草酸青霉(Penicilliumoxalicum)相似。

图2 不同培养基上菌株R1菌落形态Fig.2 Colony characteristics of strain R1 on different mediums

A:分生孢子梗(光学显微镜);B:分生孢子梗(扫描电镜);C:分生孢子(扫描电镜);标尺=10 μm
2.4 病原菌分子生物学鉴定
对菌株R1的ITS、BenA、CaM序列进行PCR扩增和测序,GenBank登记号分别为MH265216、MH265217、MH265218。通过BLAST比对,菌株R1与草酸青霉模式菌株(CBS 219.30)序列的相似性达到98%。利用MEGA 7软件构建的多基因系统发育树显示,菌株R1与草酸青霉模式菌株(CBS 219.30)处于同一分支,支持率为100%(图4)。因此,菌株R1被鉴定为草酸青霉。
3 结论与讨论
草酸青霉为常见的腐生菌,主要分布在土壤以及腐烂杂物、枯枝落叶上,在玉米、稻谷、小麦等谷物上也有分布,但都是腐生性[9]。近年来研究发现,草酸青霉能溶解土壤中的难溶性磷,增强作物对土壤磷的吸收利用,并从关键性土壤酶和土壤微生物方面改善土壤的生物学特性,促进植物生长[16];草酸青霉对一些植物病害也具有显著的生防功效[17-19],是潜在的生防真菌,尤其对Fusariumspp.引起的枯萎病有较好的防控效果[19]。
而近年来有关草酸青霉引起植物病害的报道逐渐增多,这些植物包括甘薯(Ipomoeabatatas)[20]、膜荚黄芪(Astragalusmembranaceus)[21]、番茄(Lycopersiconesculentum)[22]等,该病菌引起的病害多称为蓝霉病(Blue mold)。已发现草酸青霉寄生玉米引起穗腐病[23],侵染高粱引起青霉颖枯病[24]。在水稻方面,柴荣耀等[25]从水稻病穗分离到21个属的真菌,其中青霉Penicilliumsp.的检出频率最高,因认为其是腐生菌,而未进行致病性测定。
本研究通过田间病害症状观察,依据病原菌形态学特征及基于ITS、BenA和CaM序列的系统发育分析,并根据致病性测定结果,将草酸青霉确定为水稻穗腐病的一种新病原菌。草酸青霉侵染水稻引起水稻穗腐病尚属首次报道。
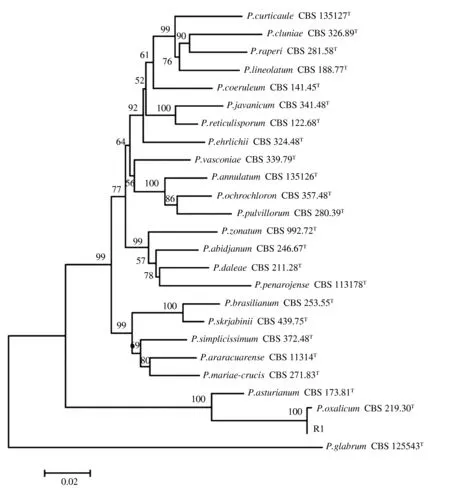
P.glabrum为外群;T代表模式菌株

