HPLC-DAD-MS-DPPH在线筛选与定性黑脉羊肚菌抗氧化活性成分*
游金坤,严 明,庄阳秋,吴素蕊,崔佳丽
(1.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221;2.云南省药物研究所,云南 昆明 650111)
黑脉羊肚菌(Morchella angusticeps) 又称小尖羊肚菌,是野生名贵食(药) 用菌[1],其营养丰富,富含蛋白质、氨基酸、多种矿物质及丰富的脂肪酸[2]。现代研究发现,羊肚菌有降血脂、调节免疫、抗疲劳、抗辐射、抗肿瘤等作用[3-7]。目前,关于羊肚菌的研究多集中于多糖、无机元素及菌丝培养[8-10]。针对黑脉羊肚菌抗氧化活性成分的研究报道较少。前期研究结果表明,黑脉羊肚菌具有良好的抗氧化活性,主要成分为水溶性小分子极性化合物,以水提取部位含量最为丰富[11],但对于该化合物的定性分析尚未见报道。
本试验中,通过HPLC-DPPH在线检测法,筛选黑脉羊肚菌不同提取物的抗氧化活性成分,并应用UPLC-Q Exactive超高效液相色谱高分辨质谱联用仪对筛选所获得抗氧化成分进行定性分析,以期建立直观、快速、准确并适用于复杂天然产物中抗氧化活性成分快速筛选与定性的方法。
1 材料与方法
1.1 材料与试剂
黑脉羊肚菌由中华全国供销合作总社昆明食用菌研究所提供;固相萃取小柱,Waters Oasis HLB,美国;DPPH,优级纯,美国Sigma公司;甲醇,色谱纯,美国Merck公司;甲醇,质谱纯,美国Thermo Fisher Scientific公司;甲酸,色谱纯,上海阿拉丁生化科技股份有限公司;三氯甲烷、无水乙醇,分析纯,上海阿拉丁生化科技股份有限公司;超纯水,自制。
1.2 仪器与设备
高效液相色谱仪,Agilent 1200 Series,美国 Agilent公司;Chemstation B.03.02色谱工作站;中压恒流泵,同田生物科技有限公司;反应圈:PEEK管(长 5.000 m,内径 0.250 mm);液质联用仪,Thermo Q Exactive,美国Thermo Fisher Scientific公司;分析软件为Xcalibur 4.0;电子分析天平,DV215CD,美国OHAUS公司;旋转蒸发仪,N-1100,东京理化器械株式会社;超纯水机,ELIXTM+Milli-Qsynthesis,美国 Millipore公司等。
1.3 方法
1.3.1 试验装置流程图
参考文献[12]进行适当调整,设计HPLC-DPPH在线检测黑脉羊肚菌抗氧化活性部位试验装置流程图如图1。
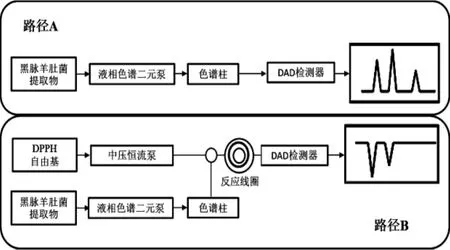
图1HPLC-DAD-MS(路径A) 和HPLC-DPPH/ABTS(路径B)在线快速检测黑脉羊肚菌抗氧化成分方法示意图Fig.1 Schematics of HPLC-DAD-MS(Line A)and HPLCDPPH/ABTS(Line B)for rapid detection of antioxidants in Morchella angusticeps
由图1可知,试验流程体系路径分别为A路径(HPLC-DAD分析系统)和B路径(DPPH自由基清除检测系统)。A路径中,待测样品由路径A进入液相色谱,检测获得原样品的色谱图。B路径中,液相色谱流动相与DPPH自由基溶液经T形连接管处混合,二者共同进入长5.000 m、内径0.250 mm的PEEK管反应线圈中并于其中充分反应,DAD检测器检测获得样品反应后的色谱图。抗氧化活性化合物与DPPH反应使其吸收减弱从而出现倒峰,即可通过二者对比筛选获取抗氧化活性成分。
1.3.2 样品处理
黑脉羊肚菌水提物:取黑脉羊肚菌约50 g,用200 mL的超纯水超声提取1 h,取滤液,重复3次,合并3次的滤液,60℃水浴旋蒸,冷冻干燥备用。
黑脉羊肚菌50%乙醇提取物:95%乙醇提取物溶剂分别为50%乙醇、95%乙醇,其余提取、浓缩、干燥步骤同水提物。
黑脉羊肚菌三氯甲烷提取物:溶剂为三氯甲烷,提取步骤同水提物,旋蒸浓缩浸膏其余提取步骤同水提物,合并3次的滤液,40℃水浴旋蒸,浓缩成为浸膏备用。
分别称取水提物、50%乙醇提物、95%乙醇提物100 mg,少量超纯水溶解后,上样至HLB固相萃取小柱,先用100 mL超纯水进行洗脱,再用100 mL的甲醇洗脱,收集洗脱液,60℃水浴旋蒸,分别对应以超纯水、50%乙醇提物、95%乙醇提物溶解并定容至10 mL容量瓶中,0.22 μm滤膜过滤备用。另取氯仿总提物100 mg,以色谱纯甲醇溶解并定容至10 mL容量瓶中,0.22 μm滤膜过滤备用。
DPPH溶液配制:精密称定DPPH标准品10.00 mg,以无水乙醇溶解,定容于1 000 mL棕色容量瓶中,即得浓度为10.00 μg·mL-1DPPH自由基溶液,-20℃保存备用。
1.3.3 色谱条件
1) 路径A条件
色谱柱:Agilent ZORBAX SB-Aq(250.0 mm×4.6 mm,5.0 μm);检测波长为254 nm;流速为1.0 mL·min-1;柱温为 30℃;进样量为 15.0 μL。
2) 梯度洗脱条件
梯度洗脱条件具体见表1、表2。
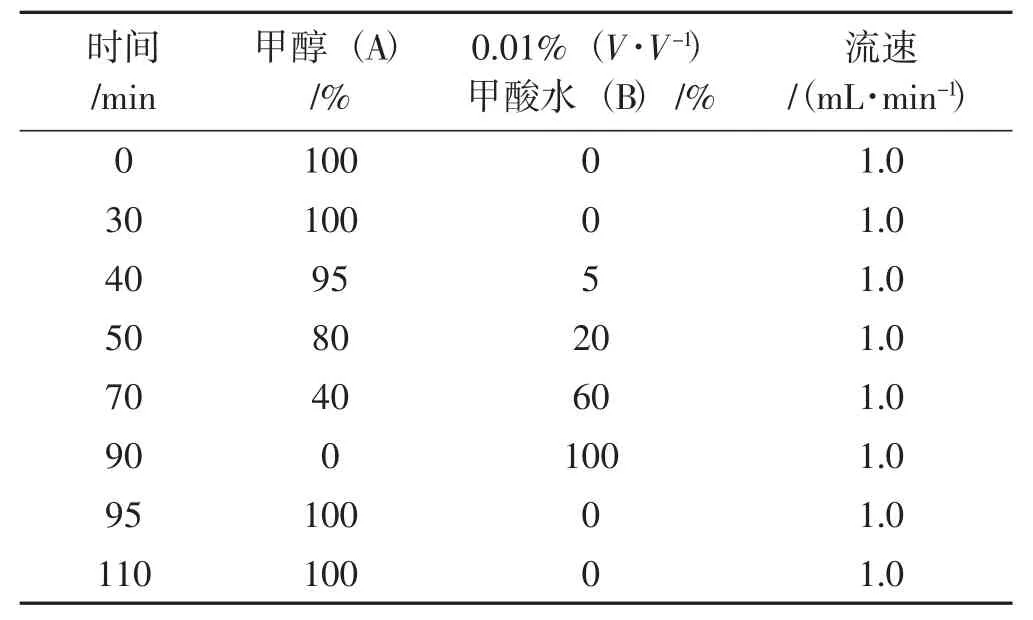
表1 水提物、50%乙醇提物、95%乙醇提物色谱洗脱梯度Tab.1 Chromatographic elution gradient of water extract,50%ethanol extract and 95%ethanol extract

表2 三氯甲烷提取物色谱洗脱梯度Tab.2 Chromatographic elution gradient of trichloromethane extract
3) 路径B条件
色谱条件与路径A条件一一对应,DPPH自由基流速为0.4 mL·min-1,DAD检测波长为517 nm。
1.3.4 抗氧化活性成分筛选
由于路径B较路径A的反应线圈长5.000 m,路径B的色谱图横轴检测时间有所延迟,故需对路径B的色谱图检测时间进行调整。B路径色谱图横轴时间需延后值(T,min)的计算公式为:
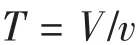
式中:V为反应线圈容积(mL);v为反应液流速(mL·min-1)。
本研究反应线圈长5.000 m、内径0.250 mm,即反应线圈的容积为0.245 mL,因路径A流速为是1.000 mL·min-1,路径 B 的流速为 0.400 mL·min-1,即总流速为1.400 mL·min-1,即B路径延迟需校正时间T为0.175 min。
1.3.5 质谱定性分析
1) 色谱条件
色谱柱:Agilent InfinityLab Poroshell 120 SB-Aq(100.0 mm×2.1 mm,2.7 μm);流速为 0.15 mL·min-1;柱温为30℃;进样量为10.00 μL。
2) 梯度洗脱条件
质谱定性分析中梯度洗脱条件具体见表3。

表3 水提物、50%乙醇提物、95%乙醇提物、三氯甲烷色谱洗脱梯度Tab.3 Chromatographic elution gradient of water extract,50%ethanol extract,95%ethanol extract and trichloromethane extract
3)质谱全扫描条件
ESI正负离子同时检测,扫描方式采用Full Mass模式。正离子:喷雾电压3.50 kV,传输毛细管温度350℃,离子源温度350℃,鞘气和辅助气分别为35和15,S-lens RF电压为50 V;分辨率70 000,自动增益控制(AGC) 和离子注入时间(IT) 分别为3e6和50 ms,扫描范围(scan range) 为m/z 75~1 125。负离子:喷雾电压2.50 kV,传输毛细管温度350℃,离子源温度350℃,鞘气和辅助气分别为35和15,S-lens RF电压为50 V;分辨率35 000,自动增益控制(AGC) 和离子注入时间(IT) 分别为3e6和50 ms,扫描范围为m/z 75~1 125。喷雾气为氮气,碰撞气为高纯氮气。
4)质谱全扫描/数据依赖性子离子扫描条件
ESI正负离子同时检测,扫描方式采用Full Mass/dd-MS2模式;正负离子检测的离子源参数与同Full Mass模式相关参数与质谱Full Mass条件一致。正离子:dd-MS2模式,分辨率17 500,自动增益控制(AGC) 和离子注入时间 (IT) 分别为1e5和50 ms,离子筛选窗口为m/z 4.0,扫描范围为m/z 50~1125,碰撞能量30 V。负离子:dd-MS2模式,分辨率17 500,自动增益控制(AGC) 和离子注入时间(IT) 分别为1e5和50 ms,离子筛选窗口为m/z 4.0,扫描范围为m/z 50~1 125,碰撞能量35 V。喷雾气为氮气,碰撞气为高纯氮气。
1.3.6 抗氧化活性成分定性分析
通过HPLC-DPPH在线检测法获得筛选抗氧化活性成分的正确指认及峰定位,并应用UPLC-Q Exactive高分辨质谱仪的全扫描模式及质谱全扫描/数据依赖性子离子扫描模式对筛选所获得抗氧化成分进行定性分析,获得其精确分子量及其特征模式下产生的碎片离子,应用Xcalibur 4.0计算其可能的化学组成(误差小于5×10-6)并推测分子式,应用HighChem Mass Frontier 7.0库搜索抗氧化活性成分并定性或通过其特征碎片离子峰信息、归属信息以及已有的相关化学成分信息报道,推断其可能的结构。
2 结果与分析
2.1 HPLC-DPPH在线抗氧化活性成分筛选结果
HPLC-DPPH在线抗氧化活性成分筛选结果如图 2~图 5。

图2 水提物HPLC-DPPH在线分析Fig.2 On-line HPLC-DPPH analysis of water extracted

图350%乙醇提取物HPLC-DPPH在线分析Fig.3 On-line HPLC-DPPH analysis of 50%ethyl alcohol extracted
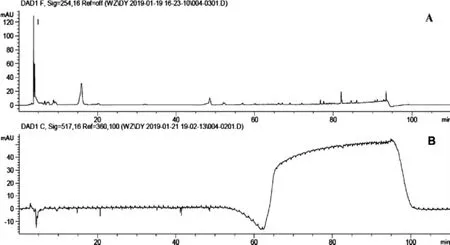
图4 95%乙醇提物HPLC-DPPH在线分析Fig.4 On-line HPLC-DPPH analysis of 95%ethyl alcohol extracted
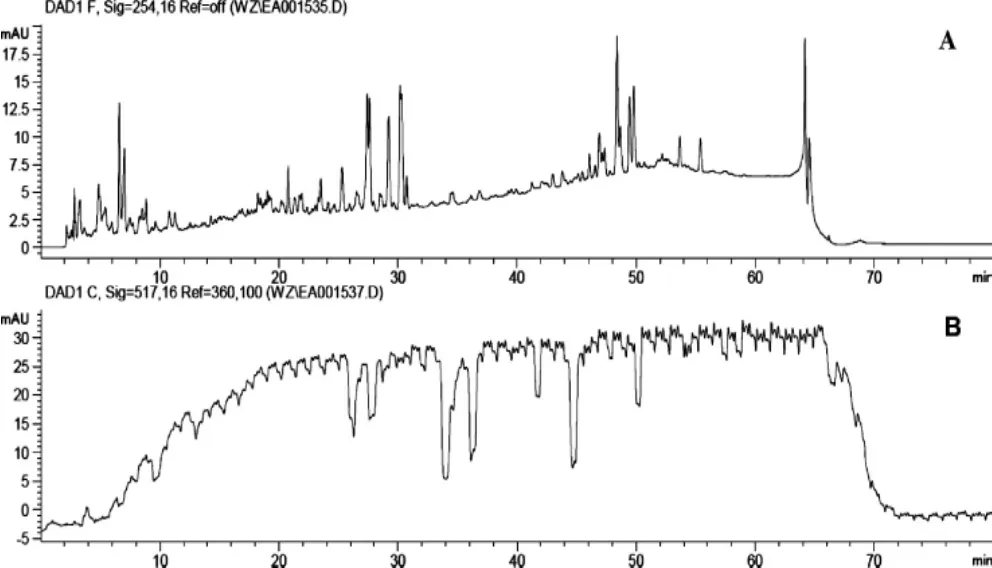
图5 三氯甲烷提取物HPLC-DPPH在线分析Fig.5 On-line HPLC-DPPH analysis of trichloromethane extracted
由图2~图5可知,对比路径A所获得原色谱图与路径B所获得反应色谱图,抗氧化活性成分筛选结果表明,水提物得到的抗氧化成分最多,为3个;50%乙醇、95%乙醇提取物得到的抗氧化成分均为1个,且该成分与水提取物中1号峰出峰时间一致,因色谱条件一致,故可判断为该成分与水提取物中1号峰为同一抗氧化活性成分;三氯甲烷提取物中未筛选获得抗氧化成分。
因倒峰面积与抗氧化活性能力强弱呈正相关,故可判断水提取物中筛选获得抗氧化活性成分3的抗氧化活性较优;50%乙醇提取物及95%乙醇提取物中筛选获得抗氧化活性成分1,即水提取物中抗氧化活性成分1,其抗氧化活性较优;而水提取物中筛选获得抗氧化活性成分2的抗氧化成分活性均较弱。
经筛选,获得3个抗氧化活性成分,均可于水提取物中筛选获得,故后续3个化合物抗氧化活性成分定性分析仅分析黑脉羊肚菌水提取物即可。
2.2 UPLC-QE在线抗氧化活性成分定性分析结果
质谱全扫描结果见图6~图8,由图中结果可获得黑脉羊肚菌抗氧化活性成分质谱分析结果见表4。
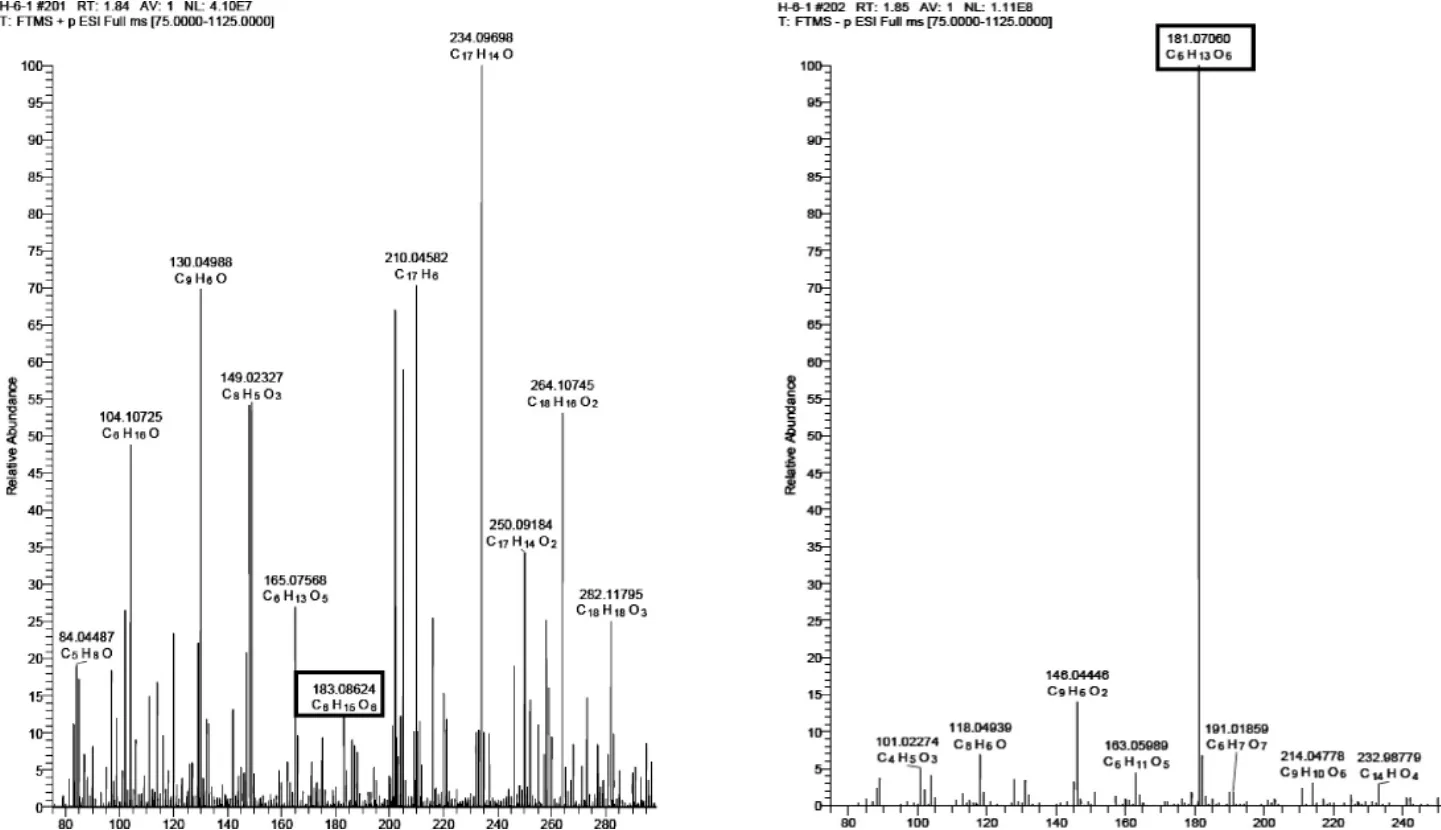
图6 1号峰质谱全扫描分析Fig.6 Full mass spectrum analysis of No.1 chromatographic peak
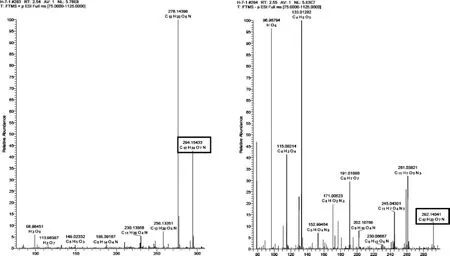
图7 2号峰质谱全扫描分析Fig.7Full mass spectrum analysis of No.2 chromatographic peak

图8 3号峰质谱全扫描分析Fig.8 Full mass spectrum analysis of No.3 chromatographic peak
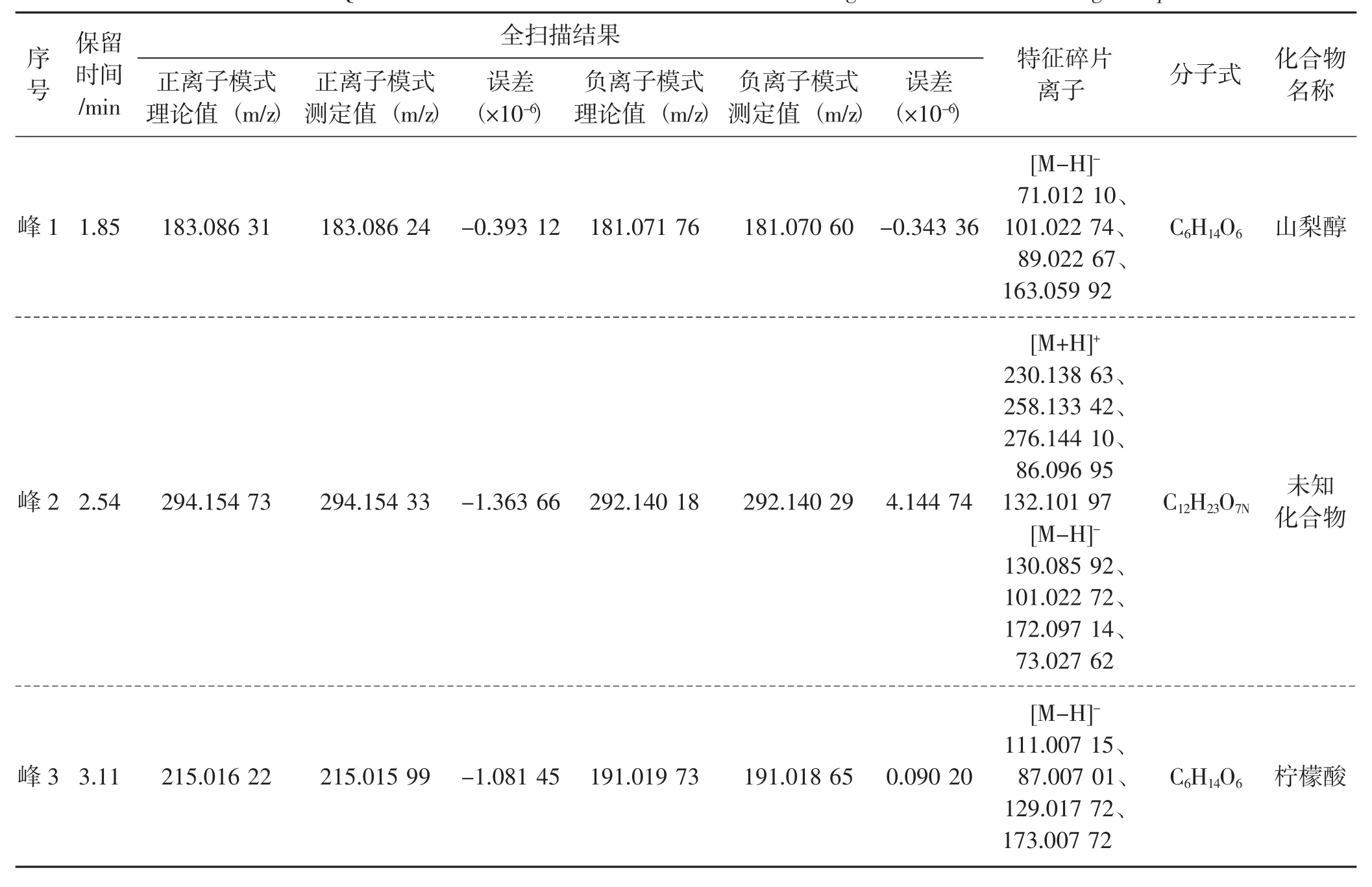
表4 黑脉羊肚菌中抗氧化活性成分的质谱数据及化合物推断Tab.4 UPLC-Q exactive data and identification of antioxidative ingredients in Morchella angusticeps
由图6~图8可知,峰1化合物的保留时间为1.85 min,其化合物正、负离子扫描模式下获得的加合离子分子量测定值分别为 [M+H]+:183.086 24、[M-H]-:181.070 60;峰2化合物的保留时间为2.54 min,其化合物正、负离子扫描模式下获得的加合离子分子量测定值分别为 [M+H]+:294.154 33、[M-H]-:292.140 29;峰3化合物的保留时间为3.11 min,其化合物正、负离子扫描模式下获得的加合离子分子量测定值分别为 [M+Na]+:215.015 99、[M-H]-:191.018 65。
应用Xcalibur 4.0计算其可能的化学组成(误差小于5×10-6)并推测分子式,峰1、峰2、峰3的分子式分别为 C6H14O6、C12H23O7N、C6H14O6,应用HighChem Mass Frontier 7.0库及相关文献报道推断其可能的结构,推断3个抗氧化活性成分分别为峰1:山梨醇(sorbitol)、峰2:未知化合物、峰3:柠檬酸 (citric acid)。
3 讨论
目前,针对黑脉羊肚菌抗氧化活性成分研究报道多见对其多糖、多酚氧化酶研究[13-14],且除本研究前期[11]应用在线抗氧化分析黑脉羊肚菌抗氧化活性外,均为仅应用传统离线抗氧化分析测定方法分析其总提物的抗氧化能力。应用HPLC-DPPH在线分析方法,对水提、50%乙醇提、95%乙醇提取物的抗氧化活性进行检测,筛选其抗氧化活性成分,并应用高分辨质谱对筛选所得抗氧化活性成分进行定性分析,以期建立在线HPLC-DAD-MS-DPPH快速筛选和定性黑脉羊肚菌中抗氧化活性成分的方法。
研究表明,黑脉羊肚菌水提物抗氧化活性最优,获得抗氧化成分3个,成分3的抗氧化活性较优;50%乙醇提取物及95%乙醇提取物中各筛选获得抗氧化活性成分1个,即水提取物中各抗氧化活性成分1,其抗氧化活性较优;水提取物中筛选获得抗氧化活性成分2的抗氧化成分活性均较弱;三氯甲烷提取物中未筛选获得抗氧化成分。应用高分辨质谱对获得抗氧化成分进行定性分析,3个抗氧化活性成分分别为:山梨醇、未知化合物、柠檬酸。天然山梨醇、柠檬酸在自然界中分布广泛,二者均具有极好的抗氧化活性,易溶于水、醇,柠檬酸可直接作为食品的抗氧化剂应用。
为保证筛选获得抗氧化活性成分的正确指认,本研究中于HPLC-DPPH在线检测法及UPLC-Q Exactive高分辨质谱定性分析过程采用统一品牌与型号色谱柱,并对HPLC转换至UPLC方法进行摸索确认。但因本试验中DPPH自由基由中压恒流泵泵入,其压力控制能力远弱于二元泵,故造成B路径中抗氧化活性化合物与DPPH反应后色谱图基线不稳定,可能一定程度上会影响倒峰的识别,从而影响抗氧化活性物质的筛选,后续研究中将对其进行改进。
石芳等[15]应用高分辨质谱对黑脉羊肚菌多酚化合物进行鉴定,共鉴定出15种多酚成分,多酚成分均具有不同程度的抗氧化活性,但与本研究中3种抗氧化活性成分结果并无重合,推测原因为酚类成分较不稳定,易氧化,而本研究提取纯化过程中存在加热等步骤,造成其文中所述多酚类成分的不稳定,故有上述结果。
黑脉羊肚菌抗氧化活性成分主要为水溶性小分子极性化合物,以水提取部位含量最为丰富。本试验中通过HPLC-DPPH在线检测法,筛选黑脉羊肚菌不同提取部位的抗氧化活性成分,并应用UPLCQ Exactive超高效液相色谱高分辨质谱联用仪对筛选所获得抗氧化成分进行定性分析,获知黑脉羊肚菌的抗氧化活性成分,建立了较为直观、快速、准确并适用于复杂天然产物中抗氧化活性成分快速筛选与定性的方法。

